高产淀粉酶黑曲霉菌种诱变选育及固态发酵条件研究
2015-11-05鲍勇阳王德培
鲍勇阳,王 露,王德培,2
高产淀粉酶黑曲霉菌种诱变选育及固态发酵条件研究
鲍勇阳1,3,王 露1,*王德培1,2
(1.天津科技大学生物工程学院,天津 300457;2.工业发酵微生物教育部重点实验室,天津 300457;3.天津达美科技有限公司,天津 300457)
真菌产生的淀粉酶具有水解条件温和耐酸的特性,具有广泛的应用价值。为了筛选高产淀粉酶黑曲霉菌种,通过采用微波诱变和硫酸二乙酯处理等方法联合诱变黑曲霉出发菌株,并对筛选出的黑曲霉菌株固态发酵产α-淀粉酶最佳条件进行了优化。结果显示,经过微波诱变16 s和硫酸二乙酯处理20 min筛选出了一株高产α-淀粉酶菌株黑曲霉MD-17,其最佳产酶固态发酵条件为:麸皮与玉米粉干重比为7:3,硫酸铵0.6%,初始pH = 5,料水比1:1.5,α-淀粉酶的酶活力最高达到6011 U/g湿曲。
黑曲霉;α-淀粉酶;联合诱变;固态发酵
α-淀粉酶是一类广泛存在于动物、植物和微生物(主要是胞外酶)中的水解酶[1],其中微生物来源的淀粉酶具有来源丰富、性能多样和易于工业化生产的特点,包括丝状真菌、酵母、细菌和放线菌等[2]。目前能够满足工业应用需求的α-淀粉酶主要来源于细菌和丝状真菌[3-4],其中由真菌产生的α-淀粉酶即称为真菌α-淀粉酶,可水解淀粉内部的α-1,4糖苷键,也能水解麦芽三糖,使中产物中不含大分子极限糊精,并具有耐酸性,在工业上有广泛应用[5-6]。
真菌α-淀粉酶在生产中主要应用于淀粉的糖化作用。真菌α-淀粉酶与细菌α-淀粉酶相比,反应温度温和,作用pH偏酸性,在工业生产中主要应用在高麦芽糖浆生产、啤酒发酵过程中以提高原料转化率,在面制品中作为质改良剂,在浓缩果汁加工中分解果汁中的淀粉提高生产效率和产品稳定性以及在医药上用作助消化剂等食品医药方面。
我国近年来才开始真菌α-淀粉酶的研究工作,大部分尚停留在菌种选育阶段。主要生产菌株有:米曲霉、白曲霉、黑曲霉、青霉等[8],一般发酵酶活力(固体湿曲)3000~5000 U/g,而国外一般发酵酶活力15000~20000 U/g,进口真菌淀粉酶垄断国内市场的局面一直未能被打破。本研究针对已有产α-淀粉酶的黑曲霉进行多重联合诱变,通过筛选获得高产α-淀粉酶的菌株,并对其固态发酵产α-淀粉酶的条件进行优化,以期实现饲用α-淀粉酶添加剂的工业化生产。
1 材料和方法
1.1 实验材料
1.1.1实验菌种
出发菌株:黑曲霉()AS 381由试验室筛选并保藏。
1.1.2 实验原料及试剂
麸皮、玉米粉、玉米浆均由天津达美科技有限公司提供,其他试剂均为分析纯。
1.1.3 培养基
斜面培养基:可溶性淀粉1%,Vogel’s母液4%[9],蛋白胨 0.1%,琼脂2%,pH = 4.8;
筛选培养基:可溶性淀粉1.5%,Vogel’s母液4%[9],玉米浆0.3%,琼脂2%,pH = 4.8;
固体发酵培养基:玉米粉(过60目筛) 20 g,麸皮(过20目筛) 80 g, (NH4)2SO41.5 g,MgSO4.7H2O 0.05 g,K2HPO4 0.3 g,固液比(M/V)=1:1.5,初始pH = 5.5,装料量为50 g/500 mL三角瓶。
1.2 实验方法
1.2.1 筛选高产菌株
采用筛选培养基平板涂布法培养30 ℃,60 h,观察单菌落透明圈,以透明圈直径与菌落直径之比的大小来判断其产酶能力。
1.2.2固体发酵培养
孢子悬液接种,250 mL三角瓶装20 g固体培养基,于培养箱28~30 ℃静置培养4~5 d。
1.2.3 实验菌株诱变方法
1.2.3.1 出发菌株的活化
黑曲霉AS 381于斜面培养基中, 30℃恒温箱中培养5 d,斜面培养基上长满孢子。
1.2.3.2 孢子悬浮液的制备
无菌水洗斜面孢子倒入装有玻璃珠的三角瓶中,置于180 r/min 摇床上30 ℃恒温振荡30 min,使孢子分散,再经无菌脱脂棉过滤,滤液即为单孢子悬液,用血球计数板对单孢子悬液进行计数,调节孢子浓度约为106个/mL。
1.2.3.3 微波诱变
微波诱变:选用最大功率700 W,额定微波频率2450 MHz,按不同累积处理时间,对孢子悬浮液进行辐照处理。取10 mL孢子悬液于φ90培养皿中置于微波炉内,累积处理时间分别为10、12、14、16、18、20 s,各取1 mL处理孢子悬液经适当稀释后(每平板10~12菌落为宜),取各稀释度0.5 mL,涂布于筛选培养基表面,30 ℃,培养60 h,观察单菌落透明圈,以透明圈直径与菌落直径之比的大小来判断其产酶能力,并将产酶较好的单个菌落分别挑到斜面上,进行摇瓶液体发酵实验。
1.2.3.4 硫酸二乙酯(DES)诱变
制备孢子悬浮液106个/ mL,取1 mL孢子悬液,分别DES诱变处理10、15、20、25、30、35、40 min,无菌水离心洗涤数次,停止诱变,倾注法分离。
1.2.3.5 微波(MW)、硫酸二乙酯(DES)联合诱变
制备孢子悬浮液,取10 mL孢子悬液,φ90培养皿中置于微波炉内,累积处理时间为16 s,5 mL DES诱变处理30 min,无菌水大量稀释停止诱变,倾注法分离。
1.2.3.6 高产菌株的筛选
(1)高产菌株的初筛
将经诱变处理过的孢子稀释适当倍数后涂布于筛选培养基平板上,30 ℃恒温培养60 h,挑取生长旺盛且透明圈与菌落直径比大者接种斜面培养基。
(2)高产菌株的复筛
将初筛所获菌株接入固体发酵培养基中,30 ℃条件下培养72 h,得到固态发酵培养物,测定其酶活力,以出发菌株作对照,产酶活超过出发菌株为正突变株进入第二次筛选。
(3)高产菌株遗传稳定性试验
复筛获得的突变高产菌株通过斜面传代12次后,测定每代的产酶性。
1.2.4 固态发酵产α-淀粉酶的发酵条件优化
将所产真菌α-淀粉酶酶活力作为发酵培养基优化的指标,对发酵培养基的成份及发酵条件进行整体优化,使发酵培养基优化到产酶活力最大。
1.2.4.1 麸皮添加量对产酶的影响
麸皮占总固态原料的比例为60%、65%、70%、75%,则玉米粉所占比例分别为40%、35%、30%、25%,其它组分保持不变,灭菌后,接种孢子悬液, 30 ℃培养96 h,发酵测定酶活,考察其对菌株产酶的影响,采用最优添加比例作为发酵培养基的碳源进行后续实验。
1.2.4.2 不同氮源对产酶的影响
分别用硫酸铵、尿素、草酸铵、硝酸钠、蛋白胨、玉米浆等量代替固体发酵培养基中的氮源,接种孢子悬液,30 ℃培养96 h,测定酶活力。每种氮源设置3个重复,取其平均值作为实际酶活力。
1.2.4.3 培养基起始pH对产酶的影响
将固体培养基初始pH值分别调整为pH为3、4、5、6、7,灭菌后,孢子接种培养于30 ℃恒温箱72 h,发酵测定酶活,采用最优初始pH值作为固态发酵培养基的初始pH值。
1.2.4.4 固体培养基外加入水量对产酶的影响
将固体培养基配制时,按照固体物质与外加水的重量体积比分别为1:0.8、1:1、1:1.2、1:1.5、1:1.8配制,灭菌后孢子接种,培养于30 ℃恒温箱72 h,测定酶活。
1.2.4.5 固态发酵培养基组成成分的正交优化
选择培养基组成成份中影响较大的四个因素即麸皮与玉米粉比例、硫酸铵加入量、外加水量、初始pH为实验因素,进行四个因子的三水平正交试验,所选因素的代码、水平代码及实际取值如表1所示。
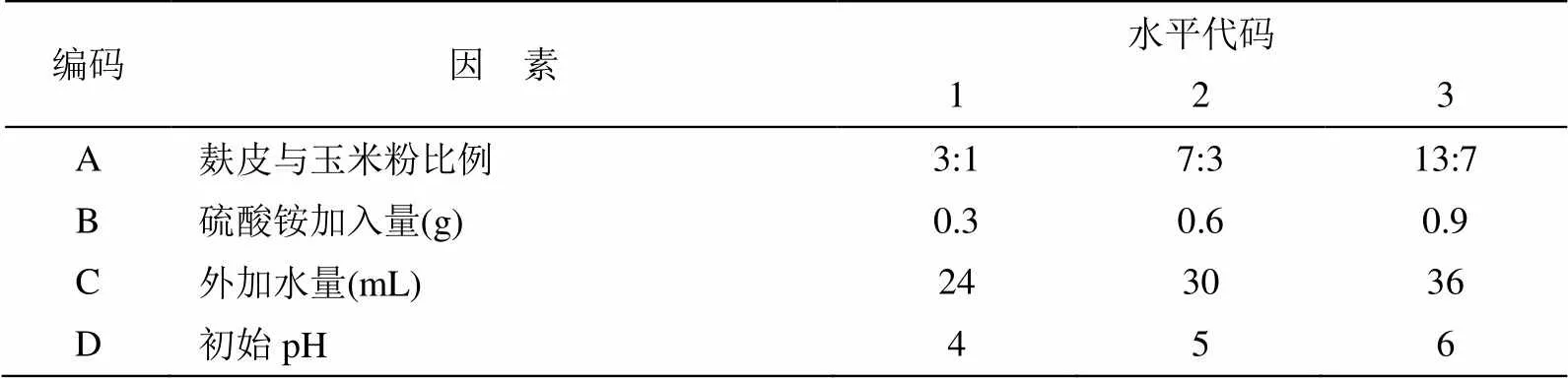
表1 固态发酵培养基组分正交试验的因素水平表
1.2.5 酶活力的测定方法
1.2.5.1 真菌α-淀粉酶测定[11]
酶活力定义:在上述条件下反应30 min,反应液中产生相当于10 mg葡萄糖的还原糖所需的酶量定义为1个淀粉糖化酶活力单位。
淀粉糖化酶活力按式(1)计算
酶活力(U/g) = (T0-T30)×f×1.62×1/10×n (1)
式中:T30:酶反应液滴定消耗硫代硫酸钠标准溶液的体积,mL;
T0:空白溶液滴定消耗硫代硫酸钠标准溶液的体积,mL;
f:0.05 mol/L硫代硫酸钠溶液浓度的校正系数;
1.62:换算系数;
1/10:该分析方法的常数(相当于10 mg葡萄糖的还原糖);
n:样品的稀释倍数。
2 结果与讨论
2.1 联合诱变对孢子致死率的影响
以黑曲霉()AS381为出发菌株,先采用微波诱变,然后进行硫酸二乙酯(DES)联合诱变,以期获得高产菌株。
2.1.1 微波诱变致死率
黑曲霉孢子悬液经2400 Hz 70 W微波照射不同时间后,取样稀释,倾注培养,30 ℃,48 h,计算致死率,绘制曲线,结果如图1。由图1可见,随着微波处理时间的延长,孢子致死率越高,上16 s之后孢子致死率达到90%以上。一般认为,致死率在90%~95%之间突变率最高。采用孢子致死率达到80%~85%的致死剂量时,正突变率较高[10],因此拟采用微波诱变时间为16 s。
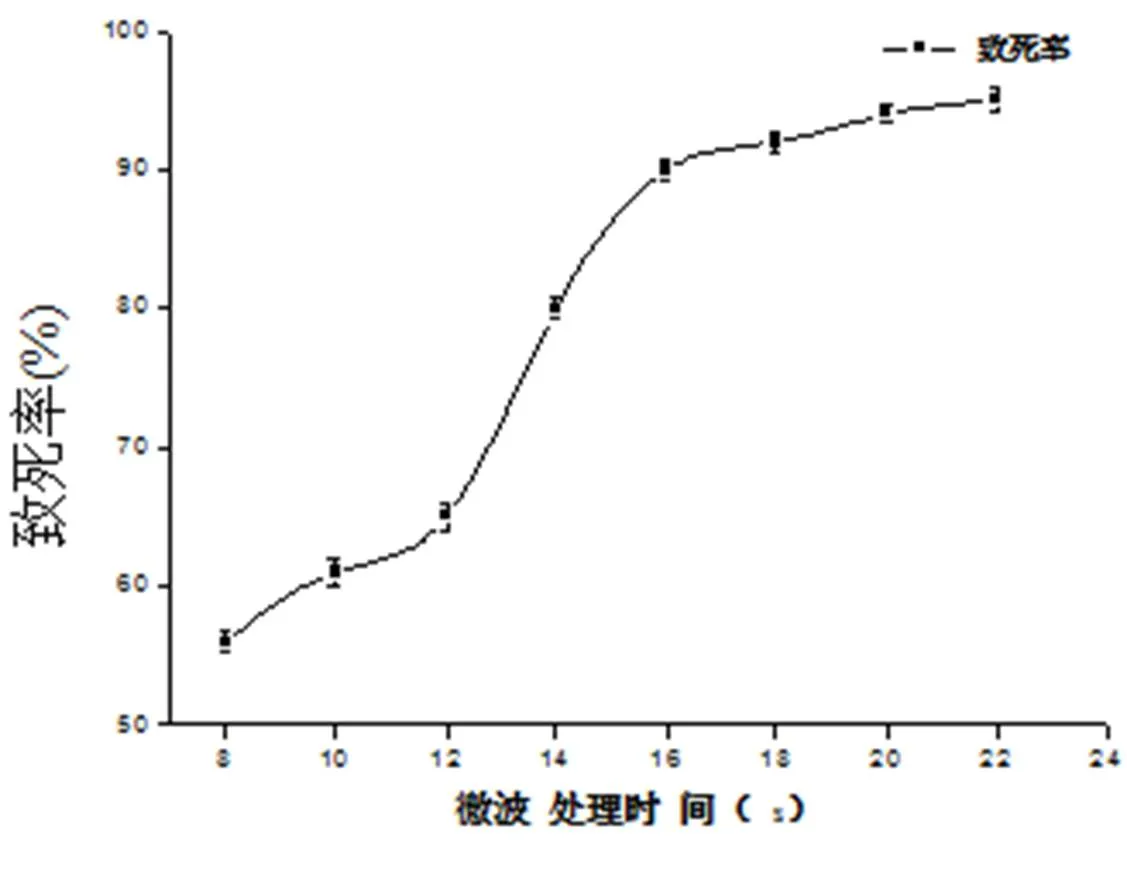
微波处理时间(s)
2.1.2 硫酸二乙酯(DES)诱变致死率
黑曲霉孢子经DES(浓度为0.05%)处理不同时间后,取样稀释,倾注培养,30 ℃,48 h,计算致死率,结果如图2。如图2,诱变15~30 min时,随时间的增加,致死率上升;在30 min以后,致死率达到92%左右。
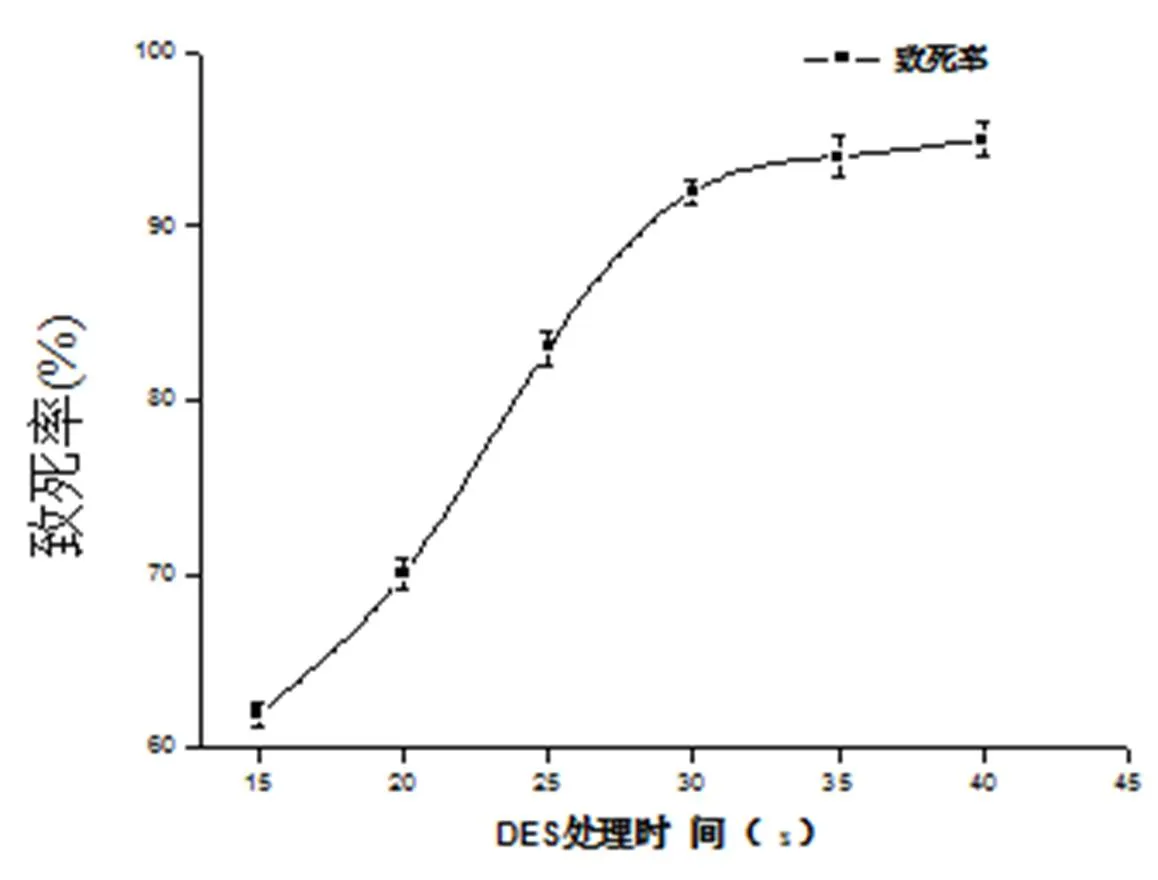
DES处理时间(s)
2.1.3 微波与硫酸二乙酯(DES)联合诱变致死率
黑曲霉孢子经微波处理16 s后再由DES处理不同时间后,取样稀释,倾注筛选培养基上,30 ℃培养48 h,计算致死率。结果如图3,联合诱变效果明显,孢子经DES诱变处理20 min后,致死率达到92.91%以上,致死效果显著。
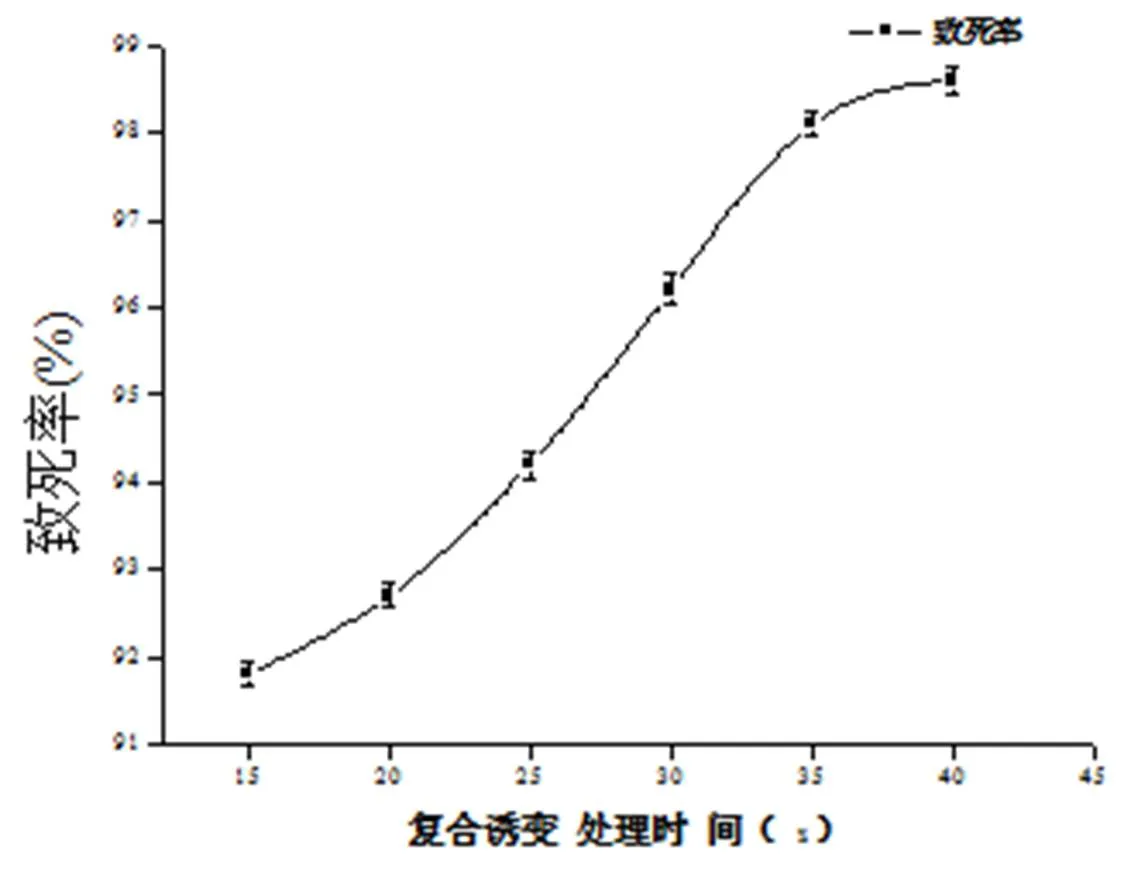
复合诱变处理时间(s)
2.2 诱变菌种的筛选
将黑曲霉AS318孢子通过微波16 s诱变,然后由DES处理20 min,离心洗涤两次后涂布于含有淀粉的筛选培养基中。已有研究经验表明,在淀粉培养基平板上生长的微生物,如果其菌落所产透明圈较明显,且菌落直径、所产透明圈直径和二者之比较大,则为真菌α-淀粉酶高产菌株,见图4。采用透明圈法进行初筛,从微波诱变中筛选挑取3株菌为MW-161、MW-182、MW-163,从DES诱变种筛选挑取2株菌DES-304、DES-305,从微波和DES复合诱变中筛选挑取4株菌MD-64、MD-17、MD-58、MD-9。
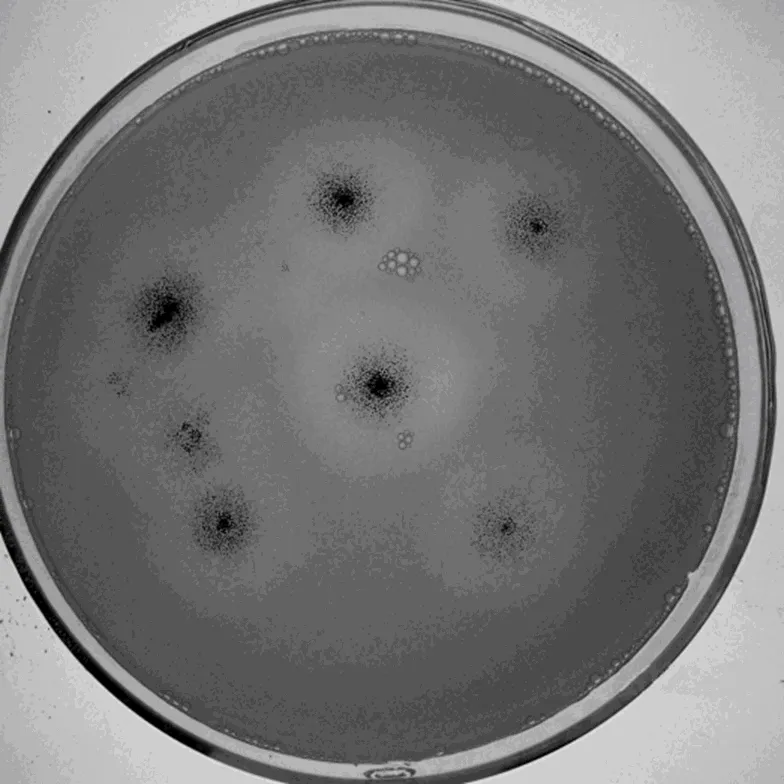
图4 菌株MD-17在筛选培养基平板上所产透明圈
选取初筛结果较好的9株菌株进行固体发酵复筛, 结果如表2。

表2 固态发酵α-淀粉酶复筛结果
从表2中看出,联合诱变处理所获得的四株菌产酶活力均高于单一诱变处理,证明联合诱变处理具有协同作用,效果优于单一诱变处理。挑选获得两株高产菌MD-64、MD-17,其固态发酵酶活力分别为4049 U/g和4190 U/g。
将两株高产菌经过12 次传代培养后,黑曲霉MD-17仍保留了较高的真菌α-淀粉酶产酶能力,具有较好的遗传稳定性,将其作为后续试验的出发菌株。
2.3 固态发酵产α-淀粉酶的工艺优化
2.3.1不同碳源比例对黑曲霉MD17产酶的影响
碳源中麸皮由于富含多糖、蛋白质、维生素和矿物质等成分,既为微生物提供碳源又是氮源,而且在潮湿条件下能保持较松散的状态,利于空气扩散,是固态发酵的常用原料。但麸皮过多,培养基粘性增大,不利于透气,影响酶的生产和产量。
配制固态发酵培养基添加麸皮占总固态原料的比例为60%、65%、70%、75%,则玉米粉所占比例分别为40%、35%、30%、25%,接种后培养72 h,测其酶活力。固态发酵麸皮添加比例在65%~75%时菌株的生长都很旺盛,由图5可见其中加入70%的麸皮可以使产酶活力达到最高,这可能是因为麸皮中含有微量的微生物生长促进因子。当添加量为65%以上,生长因子刺激菌体生长旺盛,从而使菌体产酶增加;而当麸皮添加量超过75%以后物料粘性增加,影响固态发酵过程中氧的传质,对菌体产酶产生了一定的负作用,表现出发酵产酶活力低的现象。所以,麸皮与玉米粉的添加比例以7:3为宜。
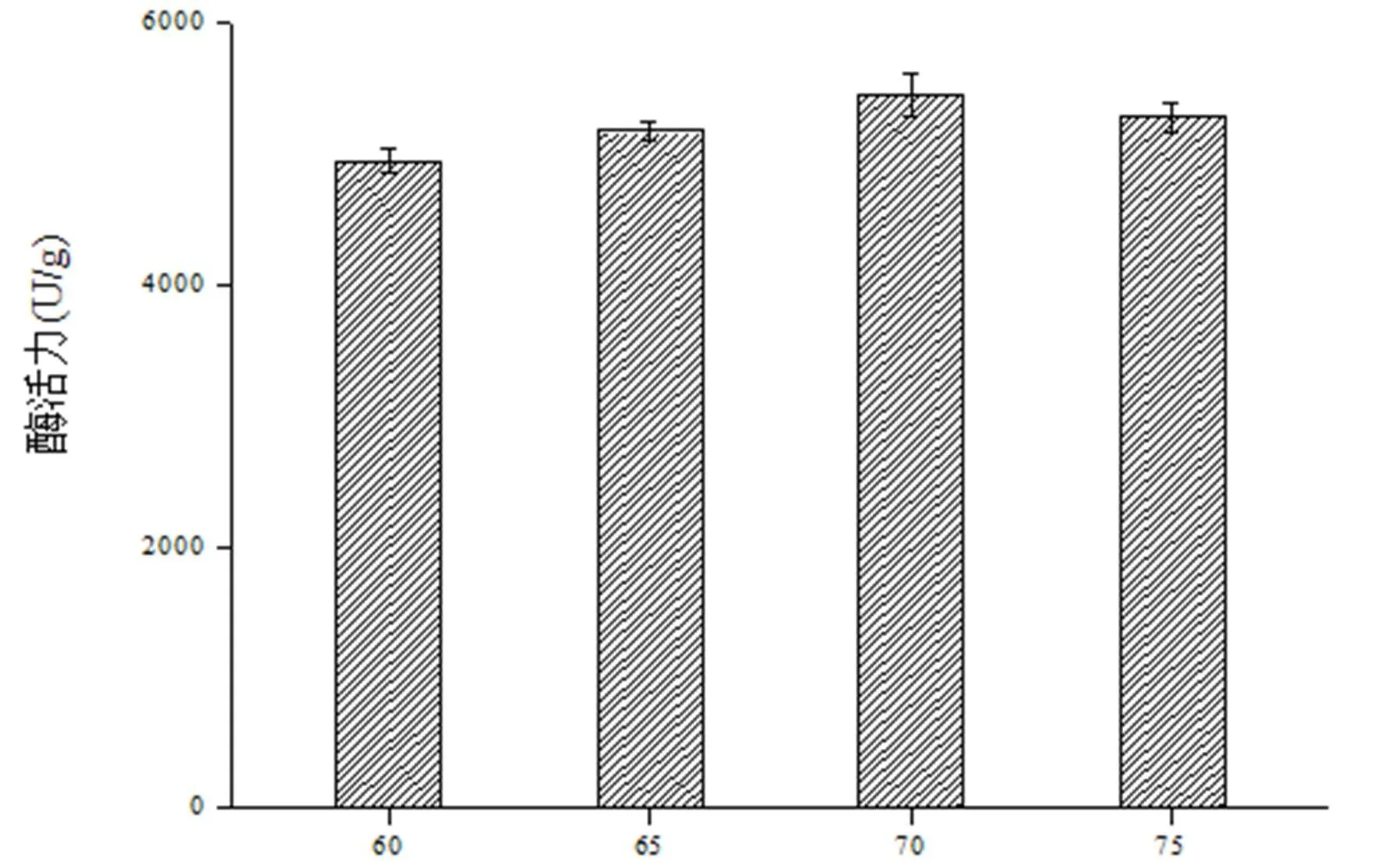
麸皮添加量(%)
2.3.2 不同氮源对黑曲霉MD17产酶的影响
氮源对微生物的生长有重要作用,主要用于构成菌体细胞物质。添加氮源一方面是为了满足菌株的快速生长,另一方面是为了调节碳氮比,保证菌株的正常生长。向培养基中分别添加不同种类的氮源,进行固态发酵试验,结果如图6。由图6可以看出,在氮元素添加量相同的情况下,以硫酸铵为氮源时菌株的产酶活性显著高于其它氮源。
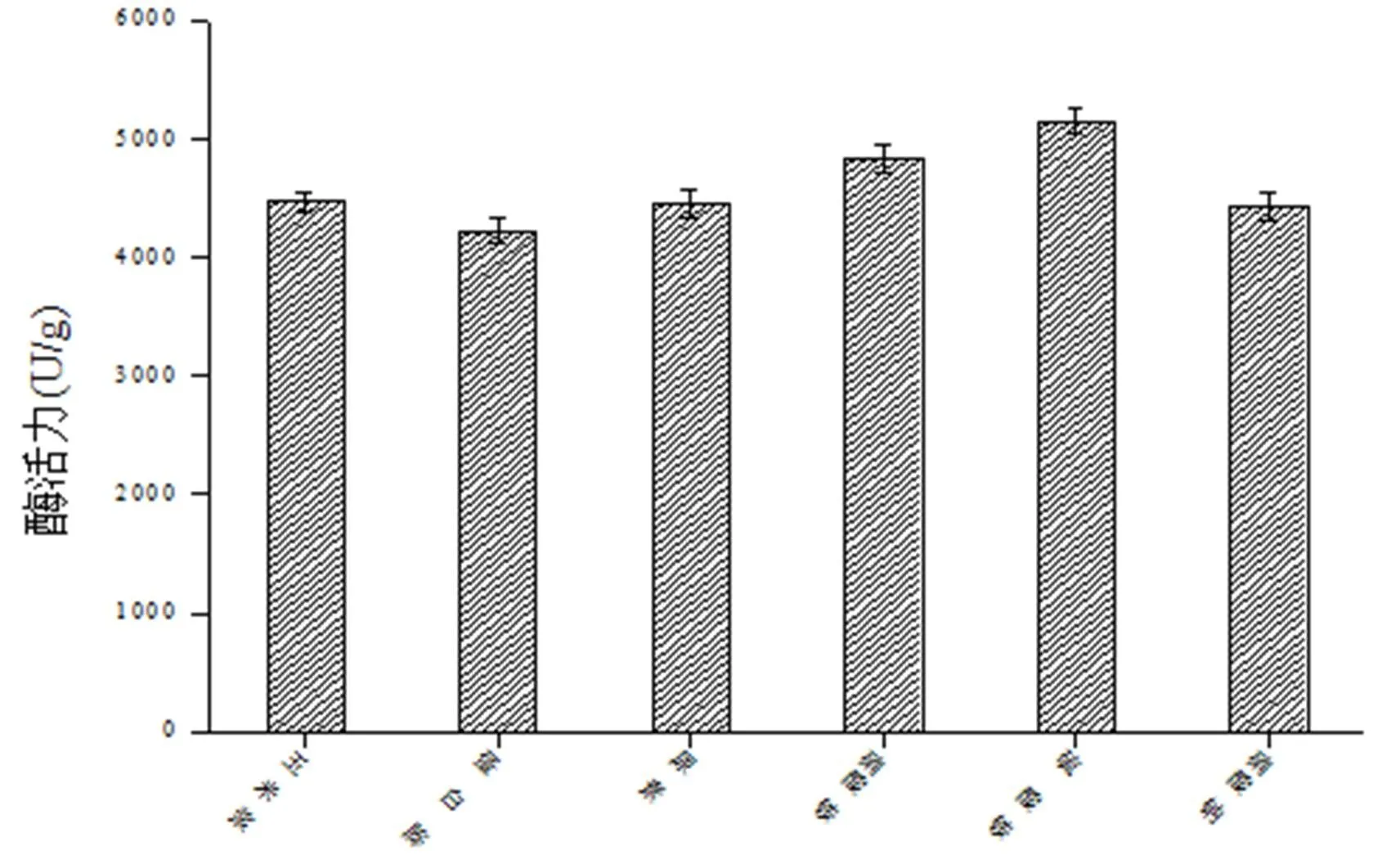
不同氮源
2.3.3 培养基起始pH对黑曲霉MD17产酶的影响
由表3可以看出,起始pH为5时,发酵效果最好,酶活力最高。初始pH = 6、pH = 7的条件下生长情况良好,但产酶活力未达到最高值,可见该菌株的pH值适应性较强,起始pH对固态发酵产酶的影响较大,应控制在pH = 5。
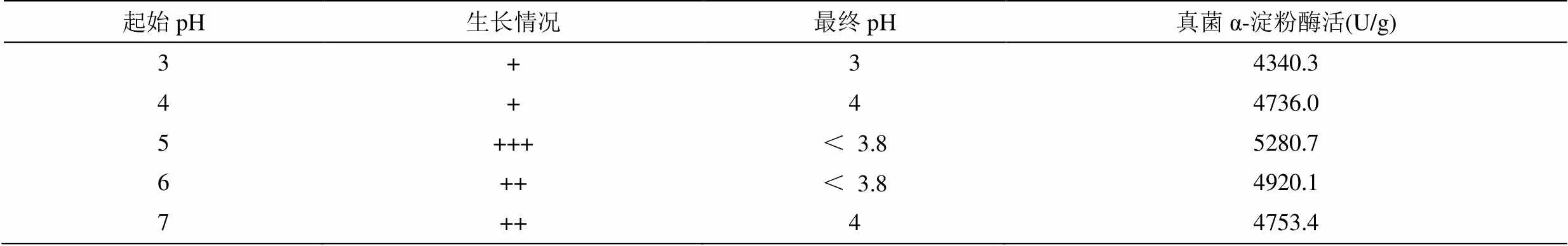
表3 初始 pH对产酶的影响
2.3.4 料水比对黑曲霉MD17产酶的影响
固态培养基含水量过高,灭菌后培养基容易结块成团,通气状况差不利于产酶;培养基含水量过低,菌株生长不良,产酶量低。图7显示了不同料水比下菌株MD-17在固态发酵培养基上的产酶情况。从图7中可知,培养基中水分含量对菌株产酶有明显影响,当料水比为1:1.5时,产酶水平达到最高。
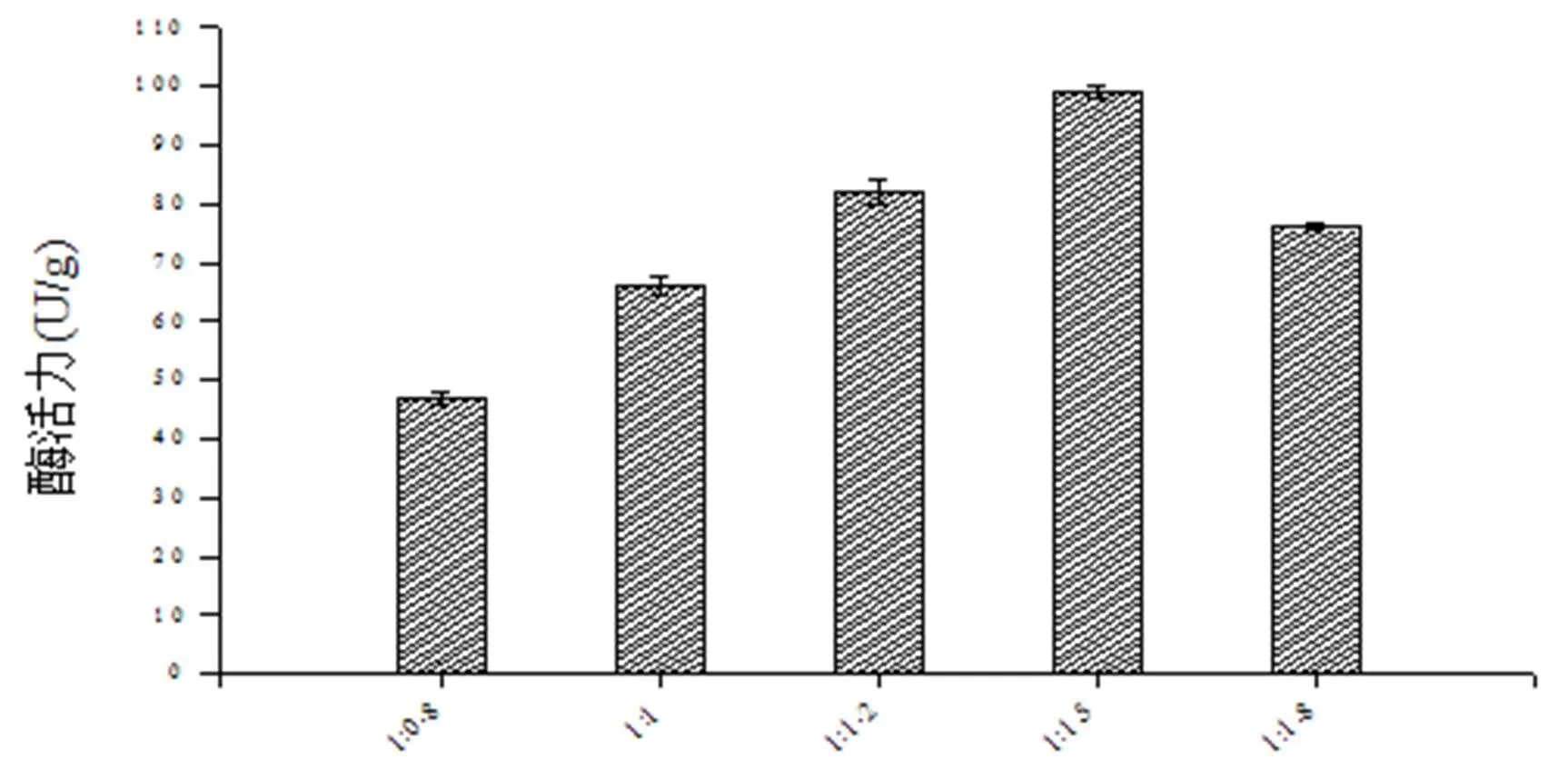
基质/外加水量
2.3.5 正交实验结果分析
在单因素实验的基础上,采用L9(34)正交试验法对麸皮和玉米粉的添加比例、硝酸铵添加量、外加水量、初始pH四个影响因素进行优化,结果如表4和表5所示。
经极差与方差分析,从表4和表5可知,不同碳源比例是主要的影响因素,此外各因素对产酶影响次序为A > B > C > D。最佳组合是A3B3C3D1,不在正交试验内,为验证正交试验结果,按最佳组合的配方进行验证试验,结果最佳组合酶活力为6011 U/g。可见,按正交分析所得最佳组合制备培养基,进行发酵产酶量更高。

表4 正交试验结果及极差分析
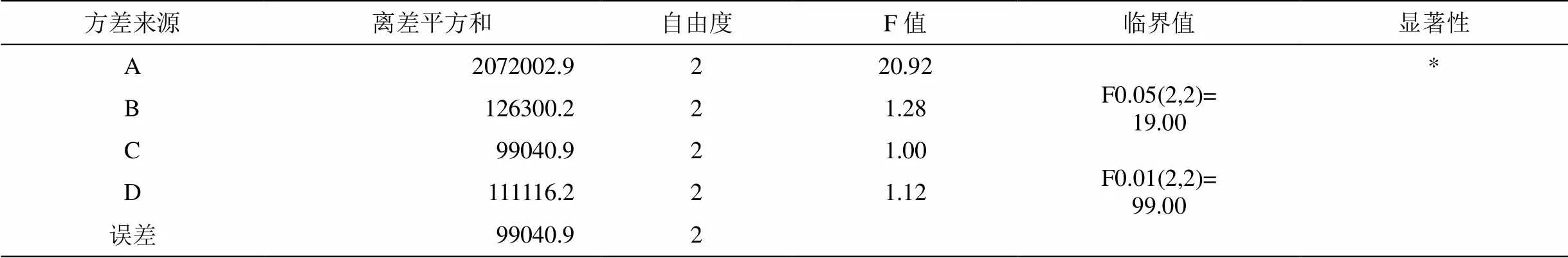
表5 正交试验酶活的方差分析
3 小结
采用联合诱变先经微波处理16 s由硫酸二乙酯诱变20 min筛选出一株黑曲霉高产菌株 MD-17。在此基础上通过单因素和多因素正交实验得到黑曲霉MD-17 固态发酵产真菌淀粉酶的最佳条件,麸皮:玉米粉= 7:3;硫酸铵:0.6%;初始pH = 5;料水比1:1.5。在此条件下,真菌α-淀粉酶的酶活力达到6011 U/g湿曲。
参考文献:
[1] 韩一生,韩学林. 酶制剂在不同饲料中的应用[J]. 饲料与种植, 2010(6):56-59.
[2] Nielsen J E, Borchert T V. Protein engineering of bacterial α-amylases[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2000, 1543(2): 253-274.
[3] 李松,王正祥. 真菌α-淀粉酶的研究进展[J]. 生物技术通报, 2011,3:67-71.
[4] Gupta R, Gigras P, Mohapatra H, et al. Microbial α-amylases: a biotechnological perspective[J]. Process Biochemistry, 2003, 38(11): 1599-1616.
[5] Swetha S, Dhanya G, Kesavan M N, et al. α-Amylases from microbial sources-an overview on recent developments[J]. Food Technol Biotechnol, 2006,44(2): 173-184.
[6] Yuan X L, van der Kaaij R M, van den Hondel C A, et al. Aspergillus niger genome-wide analysis reveals a large number of novel alpha-glucan acting enzymes with unexpected expression profiles[J]. Molecular Genetics and Genomics, 2008, 279(6): 545-561.
[7] 于珠.酶制剂对饲料中抗营养因子的作用机理及应用中注意问题[J]. 饲料与种植, 2010(4):43-46.
[8] Nielsen J E, Borchert T V. Protein engineering of bacterial α-amylases[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2000, 1543(2): 253-274.
[9] Vogel H J. A convenient growth medium for Neurospora (medium N)[J]. Microb. Genet. Bull, 1956, 13(4): 2-43.
[10] 王德培,周婷,张灵燕,等. 氮离子注入和微波复合诱变选育高产柠檬酸的黑曲霉研究[J].中国酿造,2012,242(31):123-126.
[11] 闫祥洲,刘金爱,吴勃,等.一种低温α-淀粉酶的酶学性质研究[J].饲料工业,2014,6:79-83.
Mutation breeding and Solid-state fermentation Conditions Optimization ofWITH high yield OF α-amylase
BAO Yong-yang1,3, WANG Lu1,*WANG De-pei1,2
(1.College of Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China; 2.Key Laboratory of Industrial Microbiology, Ministry of Education, Tianjin 300457, China;3. Tianjin Damei Technology Company, Tianjin 300457, China)
The fungalamylase has the characteristic of mild hydrolusis conditions and acid-resistance, and a wide range of application. By composite mutagenesis of microwave mutagenesis and diethyl sulfate treatment, isolate with high yield of α-amylase was screened and the solid-state fermentation conditions were optimized. The results showed that,MD-17 was obtained after 16 s microwave mutagenesis and 20 min diethyl sulfate treatment.The optimal solid-state fermentation conditions followed asbran:corn flour= 7:3; (NH4)2SO4:0.6%; initial pH 5;solid material : water 1:1.5. Fungal α-amylase enzyme activity could reached the highest 6011 U/g.
; α-amylase; mutation breeding; solid-state fermentation
1674-8085(2015)01-0040-06
TQ925+.1
A
10.3969/j.issn.1674-8085.2015.01.008
2014-06-05;修改日期:2014-12-12
天津市科技型中小企业技术创新项目(09ZXCXSH04400)
鲍勇阳(1981-),男,天津人,硕士,主要从事有机酸发酵和固态发酵酶制剂研究(E-mail:byy0007@gmail.com);
王 露(1987-),男,湖南衡阳人,硕士生,主要从事有机酸发酵和固态发酵酶制剂研究(E-mail:294979404@qq.com);
*王德培(1972-),女,辽宁锦州人,教授,硕士生导师,主要从事有机酸发酵和发酵饲料及固态发酵酶制剂研究(E-mail:wangdp@tust.edu.cn).
