视黄酸刺激RARE调控荧光素酶报告基因表达系统的构建与应用
2015-10-27袁源陈亚琼
袁源 陈亚琼
(中国科学院上海生命科学研究院营养科学研究所,上海 200031)
视黄酸刺激RARE调控荧光素酶报告基因表达系统的构建与应用
袁源 陈亚琼
(中国科学院上海生命科学研究院营养科学研究所,上海 200031)
类维生素A,通过视黄酸(retinoic acid,RA)代谢旺盛组织的靶基因调控,与生物节律通路相互作用,在代谢性疾病发展过程中发挥着重要作用。在293T及小鼠肝原代细胞中,构建视黄酸反应元件(RARE)调控的荧光素酶报告基因表达系统,为研究类维生素A与节律和代谢研究中靶基因上游调控信号分子提供可能。用定点突变PCR方法在pGL3-Basic载体中插入RARE片段,检测报告基因表达及RARE对视黄酸响应的半数有效浓度(EC50),初步筛选可能调控RARE的靶基因,通过酶切连接将荧光素酶报告基因Luciferase和启动子RARE片段构入穿梭载体pShuttle,转入感受态细胞BJ518获得重组腺病毒载体Ad-Basic-RARE-Luc,转染MGH细胞并进行扩增,在小鼠肝原代细胞检测腺病毒活性。结果显示,构建的RARE调控的荧光素酶报告基因表达载体在293T细胞可被RA刺激,RARβ促进RA刺激RARE表达,而CRY1抑制RARE-Luc对RA的响应,并成功构建了在小鼠肝原代细胞响应RA刺激的Adeasy-Basic-RARE-Luc腺病毒载体。
视黄酸;RARE;荧光素酶报告基因;节律;代谢
类维生素A,包括视黄醇及其衍生物[1],调控着细胞的分化、增殖与凋亡[2]。近年来研究表明,在代谢性疾病发展过程中,类维生素A发挥着重要作用。类维生素A通过调控靶基因表达进而调节哺乳动物的糖脂代谢,被认为是糖尿病,肥胖等重要的治疗靶点。报道称RA过量会引起小鼠体重减轻,白色脂肪减少[3,4],改善小鼠胰岛素敏感性[4]。有研究表明维生素A还影响着生物钟和节律,尤其是视黄酸(retinoid acid,RA)信号通路与生物钟信号通路相互调节[5]。肝脏是维生素A主要的吸收代谢场所,同时也高表达节律基因参与机体生物钟调节,此外在中枢神经系统发现高表达RARα,其转录mRNA水平呈周期性变化,有力证明了RA影响中枢生物钟[6]。越来越多的证据表明生物节律紊乱和糖尿病肥胖等代谢性疾病有着重要关系,如CRY1节律基因过表达可以降低血糖以及改善db糖尿病老鼠胰岛素敏感性[7]。RA作为维生素A中最主要的具有转录活性的组分,通过与视黄酸受体(Retinoic acid receptors,RARs)和类视黄醇X受体(Retinoid X receptors,RXRs)结合[8],调控超过500种基因的表达。众多功能各异的维生素A靶基因的启动子序列中均含有两个重复的PuG(G/T)TCA的位置[9],即视黄酸反应原件(RARE)。RARs和RXRs形成的异源二聚体可以结合到RARE上,调控靶蛋白的转录。类维生素A对代谢的调控主要是通过RA代谢旺盛组织的基因调控实现的,但其具体的的分子机制还不清楚。因此研究肝脏类维生素A对节律调控以及代谢的信号通路具有深远意义,而RA对其靶基因调控的分子机制是一个重要方向,RARE可能可以作为研究类维生素A与靶基因调控的重要位点。本研究通过构建RARE元件调控的荧光素酶报告基因表达系统,更直接高效地筛选出影响RARELuc对RA响应敏感性的基因,并构建在小鼠肝原代细胞表达的RARE-Luc腺病毒表达载体,更好地模拟小鼠体内信号通路,旨在为进一步探寻RA调控代谢靶基因的分子机制奠定基础。
1 材料与方法
1.1 材料
pGL3-Basic荧光素酶报告基因质粒及pShuttle穿梭载体质粒购于Promega,大肠杆菌XL-1 Blue及BJ 5183为本实验室保存,人胚胎肾细胞株293T及MGH细胞由本实验室保存,C57正常小鼠购自南京模式动物研究所。Kpn I-HF、Sal I-HF及T4连接酶购自NEB公司,Cutsmart酶切缓冲液(BioLabs)、细胞培养液DMEM(GIBCO)、胎牛血清(Hyclone)、胰蛋白酶Trypsin、M199 和HBSS缓冲液购自Invitrogen,HEPES、台盼蓝染液和胶原酶购自Sigma,DNA ladder marker V、6×loading buffer 及2×Taq Master Mix购自莱枫DNA 胶回收试剂盒(Bio Dev-Tech),Prime Star HS DNA Polymerase和 5×PS buffer 来自TaKaRa。荧光素酶报告基因检测系统(Thermo Scientific),Master Flex蠕动泵(Cole-Parmer Instrument Company)。
1.2 方法
1.2.1 定点突变PCR 根据GenBank提供的RARE序列,参照pGL3-Basic-Luc序列,根据引物设计原则,用Primer5软件设计一段完全互补的引物序列。所用引物由上海桑尼生物科技公司合成。正向引物:TAT CGA TAG GTA CCG AGC TCG CGA GTT CAG CAA GAG TTC AGC CGG CGA GTT CAG CAA GAG TTC AGC CGG GGC TCG AGA TCT GCG ATC,反向引物:AGA TCG CAG ATC TCG AGC CCC GGC TGA ACT CTT GCT GAA CTC GCC GGC TGA ACT CTT GCT GAA CTC GCG AGC TCG GTA CCT ATC GAT。
取10 ng pGL3-Basic质粒,用PrimerStar试剂盒进行20 μL体系PCR反应:93℃ 3 min,93℃ 30 s,60℃ 30 s,72℃ 4 min,22个循环,72℃ 5 min,最后4℃保存。取PCR反应前后样品通过1%琼脂糖凝胶电泳方法鉴定长度,分别在4 600 bp和4 800 bp左右。将PCR产物用Dpn I在37℃ 酶切2 h,将酶切后产物转化涂板:将XL-1 Blue感受态从-80℃取出,放置冰上10 min,加入 Dpn I酶切产物再在冰上静置15 min,在42℃水浴锅热击1 min,然后放回冰上10 min,取300 μL 含Kam的LB液体培养基,在37℃ 摇床培养30 min,涂含有Kam抗生素LB平板,37℃培养过夜,挑单克隆测序。
1.2.2 pGL3-Basic-RARE-Luc质粒转染和报告基因检测 将培养的293T细胞用含有10%FBS的DMEM培养基接种于24孔细胞培养板,37℃培养箱培养约18 h后,细胞长到80%左右,用脂质体瞬转细胞的方法,通过PEI介导,每个孔共转染50 ng pGL3-Basic-RARE-Luc 和25 ng 内参质粒pRSV-Renilla,6 h后换液加入RA(1 μmol/L),18 h后去掉培养基,用荧光素酶报告基因裂解缓冲液裂解细胞,静置10 min后,取上清分别检测Luc和Renilla报告基因表达:50 μL 裂解液加50 μL报告基因显色液。用Renilla报告基因的表达量对Luc进行校正,以Luc/Renilla比值作为最终的报告基因活性。
1.2.3 重组穿梭质粒pShuttle-Basic-RARE-Luc的构建 取测序正确的pGL3-Basic-RARE-Luc和pShuttle质粒,用Kpn I-HF和Sal I-HF进行双酶切,40 μL反应体系如下:pGL3-Basic-2RARE-Luc和pShuttle质粒各500 ng,用ddH2O补平至33.2 μL,Cutsmart酶切缓冲液4 μL,BSA 0.4 μL,Kpn I-HF和Sal I-HF各1.2 μL。37℃培养箱酶切5 h,酶切产物用1%琼脂糖凝胶进行鉴定,根据预估目的片段大小,切胶并用DNA胶回收试剂盒进行回收纯化。测定回收DNA浓度,按照如下体系进行连接:10 ng pShuttle酶切产物,2 μL T4 ligasion buffer,1 μL T4连接酶,实验组加入pGL3-Basic-RARE-Luc酶切产物补平至20 μL,对照组则加入等体积的ddH2O至20 μL室温连接过夜。连接产物取10 μL用于转化XL-1 Blue感受态(转化步骤同前),涂含有Kam抗生素LB平板,37℃培养过夜,挑单克隆送上海博尚测序公司测序。
1.2.4 重组腺病毒载体Adeasy-Basic-RARE-Luc的构建 取测序正确pShuttle-Basic-RARE-Luc质粒10 μg用Pme1酶切:cutsmart buffer 44 μL,BSA 0.4 μL,Pme I μL。37℃恒温培养箱酶切5 h。酶切产物用DNA胶回收纯化试剂盒进行纯化,用50 μL ddH2O洗脱,取一半用于转化BJ5183感受态(同XL-1 Blue转化步骤,37℃摇床活化30 min,涂Kam LB 平板,37℃恒温培养箱培养过夜,挑取单克隆)。用质粒小抽试剂盒提取质粒,用50 μL ddH2O洗脱,取30 μL用PacI酶切鉴定:30 μL洗脱的质粒,buffer I 4 μL,BSA 0.4 μL,Pac I 0.7 μL ddH2O补平到40 μL。37℃酶切5 h后,用0.8%琼脂糖凝胶鉴定,如果酶切产物有30 kb左右和4.5 kb(或3 kb)两条片段,则认为Adeasy-Basic-RARE-Luc重组质粒构建正确,可转XL-1 Blue,摇菌并中抽质粒,可用于包装腺病毒。
1.2.5 腺病毒包装与扩增 取60 μg重组腺病毒载体Adeasy-Basic-RARE-Luc在30 μL Buffer I,15 μL BSA和15 μL Pac I体系酶切4 h,酶切产物用DNA回收纯化试剂盒纯化,最后用50 μL ddH2O洗脱。在长到80%左右的10 cm MGH培养皿中加入纯化过的酶切产物,37℃细胞培养箱培养1-2周,等细胞几乎全部漂起,收培养基得到第一代包装成功的腺病毒。选取活力较好,可在传代后3 d内长满的MGH细胞,在MGH 长满的15 cm 细胞培养皿中加入包装成功的第一代腺病毒。等待细胞全部漂起后,收取培养基,加入到6个长满的MGH 15 cm细胞培养皿中,等待细胞全部漂起,收获的培养基再感染30个长满的MGH 15 cm细胞培养皿,收获全部漂起的细胞,6 000 r/min 离心8 min,离心下来的细胞沉淀用10 mL PBS重悬,补足到20 mL,在液氮中冻融3次,每次10 min,储存在-80℃。把上清收集到一个新的广口瓶,按照242.3 g/L加入硫酸铵,在室温搅拌2 h,6 000 r/min离心6 min,去掉上清,沉淀用10 mL PBS重悬,补足到20 mL,储存在-80℃。
1.2.6 原代肝细胞分离与重组腺病毒活力检测 准备肝原代分离所需的缓冲液:冲洗缓冲液(HBSS+50 mmol/L HEPES+5 mmol/L EGTA), 消 化 缓 冲 液(HBSS+50 mmol/L HEPES+5 mmol/L EGTA+5 mmol/L CaCl2+30 mmol/L胶原酶),预热到37℃。选取正常C57小鼠,称重,按照6 μL/g体重腹腔注射10%水合氯醛。等老鼠麻醉后,打开老鼠腹腔,将针管刺入肝门静脉,打开蠕动泵,灌流冲洗缓冲液把血冲干净,换消化缓冲液灌流。关掉蠕动泵,把整个肝脏组织剪下来,放入冲洗缓冲液中,在超净台用镊子和剪刀把细胞刮下来,用250 μmol/L尼龙滤网进行过滤,滤液600 r/min 离心2 min。去掉上清,加入无血清的M199培养基重悬混匀,600 r/min 离心3 min,去掉上清,用30 mL含有10% FBS的M199培养基重悬混匀,取100 μL重悬液与100 μL台盼蓝染液混匀涂板计数,按照每个孔20万细胞种在已经包被好的24孔板。37℃培养4 h后,去掉培养基,换成无血清M199培养基,在实验组加入重组腺病毒,对照组加入GFP腺病毒,培养过夜。第2天换液加入RA 1 μmol/L,2 h后去掉上清,裂解细胞,检测荧光素酶报告基因表达。
2 结果
2.1 pGL3-Basic-RARE-Luc的活性鉴定
将测序正确的定点PCR突变产物pGL3-Basic-RARE-Luc在293T细胞中瞬转,以RSV-Renillla作为对照,6 h后加入RA,18 h后检测报告基因的表达,结果(图1)显示,用Renilla检测值校正后,pGL3-Basic-RARE-Luc的报告基因活性明显高于空白对照,相对活性约为1.4(Luc/Renilla),具有统计学意义,说明pGL3-Basic-RARE-Luc能在293T细胞中正常表达。加入RA后,表达活性增强4倍左右,RA能促进pGL3-Basic-RARE-Luc报告基因的表达,差异均具有统计学意义。

图1 pGL3-Basic-RARE-Luc在293T中报告基因活性检测及对RA的响应
2.2 pGL3-Basic-RARE-Luc对RA的响应受RARβ和CRY1调控
在293T细胞中瞬转pGL3-Basic-RARE-Luc,同时过表达RARβ,以RSV-Renillla作为对照,6 h后加入RA,从10 μmol/L依次10倍稀释,设置8个浓度梯度,18 h后检测报告基因的表达,绘制曲线求得EC50。结果(图2-A)显示RARβ过表达后,pGL3-Basic-RARE-Luc对RA响应的EC50值从53 μmol/L降低到93 nmol/L,差异具有统计学意义,说明RARβ增强RARE-Luc对RA刺激响应的敏感性。以RARβ作为阳性对照,β-Gal作为空白对照,在293T细胞中过表达HA-CRY1,检测RA刺激(1 μmol/L)下RARE-Luc报告基因表达,结果(图2-B)显示与对照组比,RA显著促进RARE-Luc的表达,约为对照的2-3倍;与β-Gal空白对照相比,RARβ增强RARE-Luc对RA刺激的响应,而HA-CRY1下调RA促进的RARE-Luc的表达,差异均具有统计学意义。
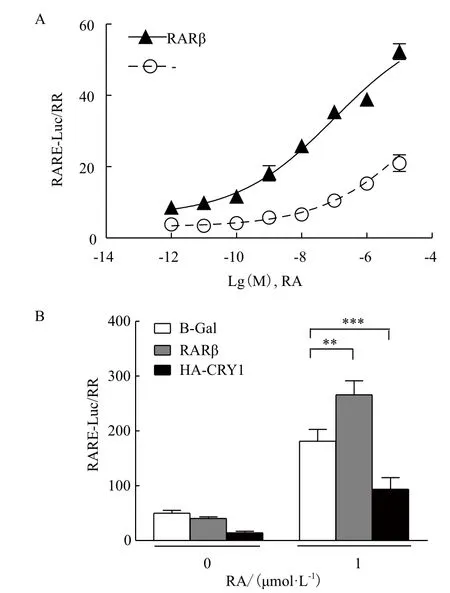
图2 RARβ和CRY1调控 RARE-Luc在293T细胞对RA的响应
2.3 重组穿梭质粒pShuttle-Basic-RARE-Luc的构建
对载体pShuttle和构建正确的pGL3-Basic-RARE-Luc用Kpn I-HF和Sal I-HF进行双酶切,以酶切前质粒作为对照,用琼脂糖凝胶电泳对酶切产物进行检测。载体pShuttle双酶切产物琼脂糖凝胶电泳显示(图3),与酶切前对比,在6 000 bp左右有一条清晰的带,与理论值相符,pGL3-Basic-RARE-Luc酶切前条带在靠近5 500 bp处,双酶切后产物显示有两条清晰的条带,分别在3 500 bp和2 500 bp,2 500 bp和1 500 bp之间,RARE-Luc酶切片段理论值应该在1 700 bp左右,即靠下面的一条(1 500 bp和2 500 bp之间)。切下来正确的片段用于胶回收以及后续的连接反应,构建重组穿梭质粒pShuttle-Basic-RARE-Luc。
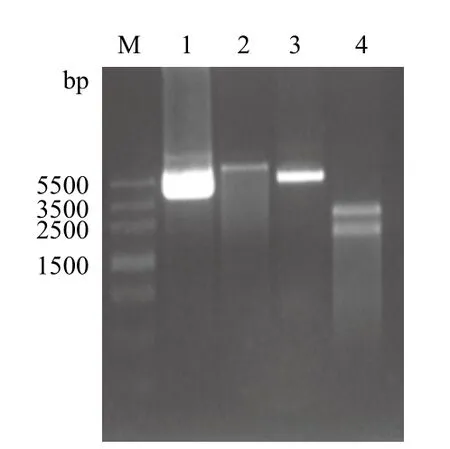
图3 重组穿梭质粒pShuttle-Basic-2RARE-Luc构建中载体和插入片段双酶切图
2.4 重组腺病毒载体Adeasy-Basic-RARE-Luc的酶切鉴定
重组腺病毒载体Adeasy-Basic-RARE-Luc阳性克隆鉴定。首先将测序鉴定正确的pShuttle-Basic-RARE-Luc用Pme I酶切后转化BJ5183感受态,涂含Kam的平板,挑取阳性克隆摇菌培养,小抽提取质粒,用Pac I酶切后的产物在1%琼脂糖凝胶电泳进行鉴定。结果(图4)显示有两条清晰条带,和Adeasy空载体酶切产物比较,分别在大于5 500 bp,以及3 500 bp和2 500 bp之间,和理论值30 kb和3 kb符合,酶切鉴定结果为阳性。

图4 重组腺病毒Adeasy-Basic-RARE-Luc用Pac I酶切鉴定图
2.5 RA促进腺病毒Adeasy-Basic-RARE-Luc在肝原代细胞表达
在肝原代细胞中感染Adeasy-Basic-RARE-Luc重组腺病毒颗粒,饥饿过夜后加入RA刺激,1 h后检测荧光素酶报告基因表达活性,结果(图5)显示,加入腺病毒感染后,肝原代细胞中报告基因信号明显被启动,Luciferase报告基因信号强度约为空白对照的3倍左右,加入RA刺激,可以增强报告基因的表达,信号强度为刺激前的2倍左右,差异均具有显著统计学差异。
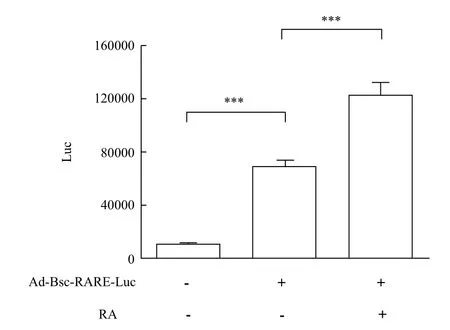
图5 重组腺病毒在肝原代细胞中表达活性检测及对RA的响应
3 讨论
类维生素A(以下简称维生素A)既指食物中存在的天然物质,又包含人工合成的化学药剂。研究表明 VA缺乏饮食的大鼠在食物摄入量差异不大的情况下,丙糖肝糖异生能力下降,肝糖原消耗增加[10],饮食摄入的维生素A和胡萝卜素与NAFLD的发展负相关[11-13],目前关于维生素A缺乏对肝脏脂肪代谢的影响还没有定论。McGrane等[14]发现在维生素A缺失饮食的小鼠,其肝脏线粒体和脂肪酸氧化相关基因表达量下降,并发展为脂肪肝。但Oliveros的研究发现在维生素A缺失引起大鼠肝脏脂肪酸合成减少,线粒体脂肪酸氧化增强[15]。由于在动物模型上维生素A缺乏研究结果不一致,在基因水平上维生素A相关蛋白研究成为一个新的热门方向,有研究表明通过肝细胞中表达负显性RARα的转基因小鼠能抑制肝脏中维生素A信号通路[16],以及利用RAR信号通路的激动剂,通过小鼠腹腔注射atRA建立维生素A过量模型,脂肪酸合成及肝脏甘油三酯量均下降[17]。目前关于维生素A信号通路还没有深入报道,由于小鼠模型的复杂性及其耗费大量的时间和资源,如果能在已有研究提示的基础上,建立一个体外的研究模型,利用荧光素酶报告基因系统的灵敏性,可以更直观深入的研究维生素A相关基因作用。类维生素A中最具有转录活性的视黄酸(RA),通过与RARs/RXRs异源二聚体及RARE结合,调控靶基因的转录。RARE序列位于众多类维生素A靶基因的启动子中,含有两个重复的PuG(G/T)TCA的位置。类维生素A主要通过RA代谢旺盛组织的基因调控,在肥胖和糖尿病发展过程中发挥重要作用,成为一个重要的治疗靶点。因此以RARE作为类维生素A调节代谢与节律信号通路的关键位点,来寻找可能的调控基因,对于研究RA及其信号通路调控的具体分子机制,深入探讨维生素A在肝脏节律与代谢调节中的作用,具有重要的临床意义。本研究采用定点突变PCR的方法,在pGL3-Basic的质粒中插入RARE序列,用荧光素酶报告基因检测系统鉴定重组质粒pGL3-RARE-Luc在293T表达活性及对RA的响应,建立由RA刺激RARE调控荧光素酶报告基因的表达系统,与已有的小鼠模型相比,可以简便高效地筛选影响RA对RARE调控作用的基因,更直接地研究其作用机制,为进一步研究维生素A及其通路在代谢中的作用提供体外细胞筛选模型。
RA是生物节律调控因子,其信号通路中的许多基因具有节律震荡,与节律通路互相调控。在节律通路中,BMAL1和CLOCK结合促进CRY/PER的转录,而CRY和PER上调后又抑制BMAL1/CLOCK,形成一个基于Ebox生物钟反馈调节通路[18]。研究发现RARα与RARβ启动子含有Ebox位点[19],而且RA促进RARα/RXRα二聚体与BMAL竞争性和CLOCK结合,抑制BMAL/CLOCK转录活性[20]。此外发现在PER1/BMAL启动子中含有RARE序列[21],提示RA与节律通路的相互调节。本研究利用已经构建的RA刺激荧光素酶报告基因载体,在293T分别过表达CRY1和RARβ,检测RARE-Luc对RA响应信号的变化,结果发现RARβ可以增强RARELuc对RA的响应,而CRY1则抑制RA刺激 RARELuc的表达。揭示了CRY1可能通过RARE启动子对RA下游靶基因的调控作用,进而提示节律通路与RA互相作用,并为研究其具体作用机制提供一个新的突破点,具体靶基因的筛选待后续研究。
为了更好地模拟肝脏中RA调控通路,用已构 建 的pGL3-Basic-RARE-Luc把RARE序 列 及Luciferase报告基因构建到pShuttle穿梭质粒中,转化到BJ5183大肠杆菌感受态中,成功构建重组腺病毒载体Adeasy-Basic-RARE-Luc,在小鼠肝原代细胞中响应RA刺激,可用于更好地在体内研究CRY1及其他可能的调控因子与RA信号通路调控的机制,更深入阐释维生素A代谢紊乱与肥胖糖尿病等疾病的关系。
4 结论
本研究利用定点突变PCR方法构建了RARE启动子调控的荧光素酶报告基因载体,在293T细胞中,RA刺激RARE-Luc表达,RARβ增强RA刺激RARE-Luc表达,发现CRY1抑制RARE-Luc对RA的响应,并利用pGL3-Basic-RARE-Luc载体,进一步成功构建出在肝原代被RA刺激表达的Adeasy-Basic-RARE-Luc的腺病毒载体。
[1] Goodman DS. Vitamin A and retinoids in health and disease[J]. N Engl J Med, 1984, 310:1023-1031.
[2] Balmer JE, Blomhoff R. Gene expression regulation by retinoic acid[J]. J Lipid Res, 2002, 43(11):1773-1808.
[3] Felipe F, Mercader J, Ribot J, et al. Effects of retinoic acid administration and dietary vitamin A supplementation on leptin expression in mice:lack of correlation with changes of adipose tissue mass and food intake[J]. Biochim Biophys Acta, 2005, 1740(2):258-265.
[4] Berry DC, Noy N. All-trans-retinoic acid represses obesity and insulin resistance by activating both peroxisome proliferation-activated receptor β/δ and retinoic acid receptor[J]. Mol Cell Biol, 2009, 29(12):3286-3296.
[5] Glover J. Factors affecting vitamin-a transport in animals and man[J]. Proc Nutr Soc, 1983, 42(1):19-30.
[6] Ransom J, Morgan PJ, McCaffery PJ, et al. The rhythm of retinoids in the brain[J]. J Neurochem, 2014, 129(3):366-376.
[7] Zhang EE, Liu Y, Dentin R, et al. Cryptochrome mediates circadian regulation of cAMP signaling and hepatic gluconeogenesis[J]. Nat Med, 2010, 16(10):1152-1156
[8] Kastner P, Mark M, Ghyselinck N, et al. Genetic evidence that theretinoid signal is transduced by heterodimeric RXR/RAR functional units during mouse development[J]. Development, 1997, 124(2):313-326.
[9] Mangelsdorf DJ, Evans RM. The RXR heterodimers and orphan receptors[J]. Cell, 1995, 83:841-850.
[10] Wolf G, Lane MD, Johnson BC. Studies on the function of vitamin A in metabolism[J]. Biochem J, 1957, 225:995-1008.
[11] Suano de Souza FI, Silverio Amancio OM, Saccardo Sarni RO, et al. Non-alcoholic fatty liver disease in overweight children and its relationship with retinol serum levels[J]. Int J Vitam Nutr Res,2008, 78(1):27-32.
[12] Musso G, Gambino R, De Michieli F, et al. Nitrosative stress predicts the presence and severity of nonalcoholic fatty liver at different stages of the development of insulin resistance and metabolic syndrome:possible role of vitamin A intake[J]. Am J Clin Nutr, 2007, 86(3):661-671.
[13] Villaça Chaves G, Pereira SE, Saboya CJ, et al. Non-alcoholic fatty liver disease and its relationship with the nutritional status of vitamin A in individuals with class III obesity[J]. Obes Surg,2008, 18(4):378-385.
[14] Kang HW, Bhimidi GR, Odom DP, et al. Altered lipid catabolism in the vitamin A deficient liver[J]. Molecular and Cellular Endocrinology, 2007, 271(1-2):18-27.
[15]Oliveros LB, Domeniconi MA, Vega VA, et al. Vitamin A deficiency modifies lipid metabolism in rat liver[J]. Br J Nutr, 2007, 97(2):263-272.
[16] Shiota G. Role of retinoic acid receptor in steatohepatitis related tumor formation[J]. J Gastroenterol Hepatol, 2007, 22(Suppl. 1):S101-107.
[17] Amengual J, Ribot J, Bonet ML, et al. Retinoic acid treatment enhances lipid oxidation and inhibits lipid biosynthesis capacities in the liver of mice[J]. Cell Physiol Biochem, 2010, 25(6):657-666.
[18] Liu AC, Lewis WG, Kay SA. Mammalian circadian signaling networks and therapeutic targets[J]. Nat Chem Biol, 2007, 3(10):630-639.
[19] Navigatore-Fonzo LS, Golini RL, Ponce IT, et al. Retinoic acid re ceptors move in time with the clock in the hippocampus. Effect of a vitamin-A-deficient diet[J]. J Nutr Biochem, 2013, 24(5):859-867.
[20] McNamara P, Seo SB, Rudic RD, et al. Regulation of CLOCK and MOP4 by nuclear hormone receptors in the vasculature:a humoral mechanism to reseta peripheral clock[J]. Cell, 2001, 105(7):877-889.
[21] Golini RS, Delgado SM, Navigatore Fonzo LS, et al. Daily patterns of clock and cognition-related factors are modified in the hippocampus of vitamin A-deficient rats[J]. Hippocampus,2012, 22(8):1720-1732.
(责任编辑 李楠)
Construction and Application of RARE-regulated Luciferase Reporter Gene System Stimulated by Retinoid Acid
Yuan Yuan Chen Yaqiong
(Institute for Nutritional Science,Shanghai Institutes for Biological Sciences,Chinese Academy of Science,Shanghai 200031)
Biostearin plays a crucial role in the development of metabolic diseases by target gene regulation of retinoic acid(RA)in metabolically active tissues and interaction with circadian pathway. The luciferase reporter gene system regulated by retinoic acid response element(RARE)was constructed and expressed in 293T and primary hepatocyte of a mouse, which provides the possibility for studying biostearin and circadian, as well as signaling molecules of upstream regulation of target genes in researching metabolism. By PCR-based sitespecific mutagenesis, RARE promoter was inserted into multiple clone sites of pGL3-Basic vector. In 293T cells, we detected the gene expression and half maximal effective concentration(EC50)of RARE responding to RA and screened the possible target genes of regulating RARE. The pGL3-RARE-Luc plasmid and pShuttle vector were digested by restriction enzyme and ligated. Through transformation into competent cell BJ518 the recombinant adenovirus vector Ad-Basic-RARE-Luc was obtained and amplified after transfection to MGH cells. The activity of recombinant adenovirus was detected in primary hepatocyte of a mouse with Dual-luciferase Reporter Assay System. The results indicated that luciferase reporter gene vector regulated by RARE in 293T cells was stimulated by RA. RARβ promoted the stimulation of RA in RARE regulation, and CRY1 prohibited the response of RARE-Luc to RA. The adenovirus vector Adeasy-Basic-RARE-Luc responding to RA stimulation in primary hepatocyte of a mouse was constructed successfully.
retinoid acid;RARE;luciferase reporter gene;circadian;metabolism
10.13560/j.cnki.biotech.bull.1985.2015.06.033
2014-11-24
袁源,硕士研究生,研究方向: 二型糖尿病与肥胖的分子病理研究 ;E-mail:stacyy116@hotmail.com
陈亚琼,博士,研究方向:二型糖尿病与肥胖的分子病理研究;E-mail:yqchen@sibs.ac.cn
