应用RT—PCR方法检测牛轮状病毒的研究
2015-10-21李成元等
李成元等

摘 要:牛轮状病毒主要引起犊牛腹泻,近年来,其国内感染率不断增加,本研究参照牛轮状病毒VP7基因序列,设计合成特异性检测引物,通过RT-PCR反应条件的优化,建立了检测牛轮状病毒的一步法RT-PCR方法,并应用该方法进行了临床样品的检测。结果显示,该方法具有良好的特异性、敏感性、重复性和临床适用性。本研究为牛轮状病毒的检测提供了一种敏感、特异、快速、简单的方法,具有很好的临床应用价值,值得推广应用。
关键词:牛轮状病毒;RT-PCR;检测
Abstract: bovine rotavirus causes diarrhea in calves, in recent years, the infection rate is increasing, this study refers to the bovine rotavirus VP7 gene sequence, design and synthesis of specific primers, through the optimization of RT-PCR reaction conditions, established a one-step RT-PCR method for detection of bovine rotavirus, and application of the method for detection of clinical samples. The results showed that, the method has good specificity, sensitivity, reproducibility and clinical application. It provides a method for sensitive, specific, rapid, simple method for the detection of bovine rotavirus, which had good clinical application value, and it's worthy of popularization and application.
Keywords: bovine rotavirus; RT-PCR; detection
牛轮状病毒(bovine rotavirus,BRV)又称犊牛腹泻病毒(calfdiarrha virus),属于呼肠孤病毒科(Reoviridae)轮状病毒属(Rotavirus),是引起犊牛急性腹泻的主要病原之一,呈全世界范围内流行,给全球养牛业带来巨大的经济损失[1,2]。BRV主要感染1~7日龄的犊牛,可引起犊牛消化道机能紊乱,临床上以精神沉郁、食欲废绝、呕吐、水样腹泻、严重脱水和酸中毒等为主要特征,严重的可以导致死亡,病死率高达50%,成年牛多呈隐性感染[3,4],BRV感染后易继发细菌性感染,可使病情进一步恶化[5]。近年来,国内BRV感染的阳性率不断增加,对我国养牛业的健康发展造成了严重的影响和巨大的威胁[6]。RT-PCR技术操作简单、检测快速、敏感性高、特异性强,是目前动物疫病常用的分子生物学诊断技术,应用RT-PCR方法检测BRV,有助于对临床表现腹泻症状的病牛进行快速确诊,也有利于疾病的早期诊断和流行病学调查,为疾病的诊断提供更敏感、特异的方法。
1 材料和方法
1.1 病毒
牛輪状病毒(bovine rotavirus,BRV)、牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)、牛冠状病毒(bovine coronavirus,BCV)、牛病毒性腹泻病毒(BVDV)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)均由枣庄职业学院动物疫病检验检疫中心实验室保存。
1.2试剂、载体及试剂盒
Trizol试剂购自天根生化科技(北京)有限公司;鼠源M-MLV反转录酶、Ribonuclease Inhibitor 购自生工生物工程(上海)股份有限公司。Ex Taq酶、dNTP为TaKaRa公司产品;病毒基因组RNA提取试剂盒、病毒基因组DNA提取试剂盒购自百泰克科技(北京)有限公司。
1.3 病料处理
牛场送检的腹泻病料,用无菌研钵研磨并用PBS液(pH 7.2-7.4)5倍稀释,分装1.5 mL灭菌EP管,反复冻融3次,12 000 r/min离心5 min,取上清待用。
1.4病毒基因组RNA/DNA的提取
按病毒基因组RNA提取试剂盒分别提取牛轮状病毒(BRV)、牛病毒性腹泻病毒(BVDV)、牛冠状病毒(BCV)的基因组RNA、按病毒基因组DNA提取试剂盒提取牛传染性鼻气管炎病毒(IBRV)的基因组DNA,同时提取病料处理上清液的病毒基因组RNA,-70 ℃保存备用。
1.5引物的设计与合成
根据GeneBank上公布的BRV毒株VP7基因组序列(登录号:M63266.1),利用oligo6.0软件设计并合成1对特异性检测引物,BRVF1:5'-CTACGCAAA GTGAACCATT-3';BRVR1:5'-ATAGAACGCTGACGAATTAAG-3'。引物由生工生物工程(上海)股份有限公司合成。
1.6 RT-PCR扩增反应
1.6.1反转录合成cDNA 反转录反应按25 μL体系操作,取提取的RNA 10 μL,加入RNase free dH2O 0.5 μL,下游引物BRV R1 2.5 μL,10×M-MLV Buffer 2 μL,Ribonuclease Inhibitor 0.5 μL,dNTP 1 μL,M-MLV反转录酶1 μL,37 ℃作用50 min后95 ℃灭活5 min后用于PCR扩增。DNA病毒的基因组不用进行反转录直接进行PCR扩增。
1.6.2 RT-PCR条件的优化
1.6.2.1 最适模板含量的确定 将反转录合成的cDNA适当稀释,使其分别含有1 μg、0.1 μg、10 ng、
1 ng,分别以其为模板,确定最适模板含量。
1.6.2.2 最适引物含量的确立 在RT-PCR反应体系中分别加入上下游引物(20 μmol/L)各0.1 μL、0.3 μL、0.5 μL、0.7 μL、0.9 μL,确定最适引物含量。
1.6.2.3 最适退火温度的确立 分别取50 ℃、52 ℃、54 ℃、56 ℃为退火温度进行RT-PCR扩增,确定最适退火温度。
1.7特异性试验
分别以提取的牛轮状病毒(BRV)、牛病毒性腹泻病毒(BVDV)、牛冠状病毒(BCV)基因组RNA,牛传染性鼻气管炎病毒(IBRV)基因组DNA为模板,用已优化的最佳反应条件进行检测。
1.8敏感性试验
将反转录合成的cDNA适当稀释,使其分别含有0.1 μg、1 μg 、0.1 ng、1 ng、10 ng 的含量,分别以其为模板进行RT-PCR检测,确定PCR扩增的敏感性。
1.9重复性试验
用建立的RT-PCR方法分别对牛轮状病毒(BRV)、牛病毒性腹泻病毒(BVDV)、牛冠状病毒(BCV),牛传染性鼻气管炎病毒(IBRV)以及BRV 3份阳性和3份阴性样品重复检测3次,确定检测方法的重复性。
1.10检测方法的临床应用
利用建立的BRV RT-PCR检測方法检测不同牛场的送检22份临床疑似BRV感染的犊牛腹泻样品和35份临床组织病料,对RT-PCR扩增呈阳性的片段回收,送生工生物工程(上海)股份有限公司进行测序鉴定。将测序结果进行BLAST序列比对,以验证该检测方法的准确性。
2 结果与分析
2.1 RT-PCR反应条件的确定
经反应条件的优化试验确定RT-PCR的最适模板含量为0.1 μg,最适引物含量为10 μmol,最适退火温度为52 ℃。确定RT-PCR反应体系为: 5 μL 10× PCR Buffer、4 μL dNTP(2.5 mmol/L)、上下游引物P1、P2(20 μmol/μL)各0.5 μL、0.1 μg cDNA,加水至50 μL。RT-PCR反应条件为:95 ℃ 4 min;94 ℃ 45 s,52 ℃ 45 s,72 ℃ 60 s,30个循环;72 ℃ 10 min;4 ℃终止反应。
2.2特异性试验
如图1所示,BRV的扩增产物在761 bp处出现特异性的扩增条带,与试验预期设计的大小相符。而BVDV、BCV、IBRV均未出现扩增产物,表明检测方法具有良好的特异性。
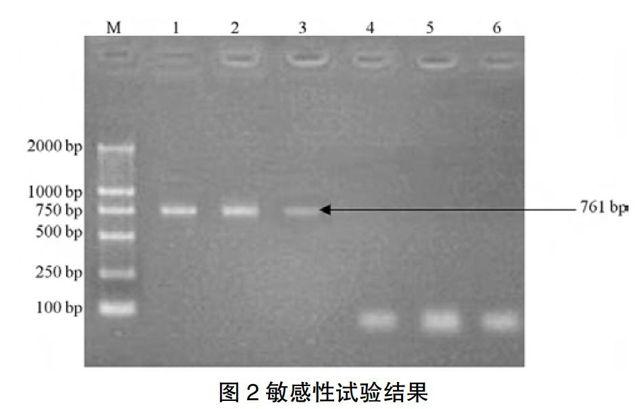
2.3敏感性试验
BRV的基因组RNA反转录合成的cDNA稀释至10 ng的含量仍然有特异性扩增条带,表明检测方法具有良好的敏感性(图2)。
2.4重复性试验
将保存的病毒基因组RNA/DNA进行3次重复操作,试验结果完全一致,说明该检测方法有很好的重复性。
2.5检测方法的临床应用
应用该方法检测22份疑似BRV感染的犊牛腹泻样品和35份临床组织病料样品,22份犊牛腹泻样品中16份为BRV阳性,阳性率达72.72 %(16/22),35份临床组织病料样品有6份为阳性,阳性率达17.14 %(6/35)。阳性RT-PCR扩增产物的测序结果经过BLAST序列比对,与BRV CHLY株(GenBank登录号:DQ195152.1)的同源性均在99.6 %以上,表明建立的RT-PCR检测方法有很好的准确性,值得临床样品检测的推广应用。
3 讨论
BRV是引起牛腹泻的重要病原之一,约50 %的犊牛腹泻是由BRV感染引起,给牛场造成了巨大的经济损失[7]。且轮状病毒为人畜共患病毒,人感染轮状病毒后也会引起腹泻及发生胃肠炎,故加强BRV的综合防控对养牛业和人类健康都具有十分重要的现实意义[8]。目前,BRV的检测方法主要包括病毒分离、血清中和试验、ELISA技术及PCR等方法。传统的病毒分离和血清中和试验方法,费时费力,并且由于BRV不容易在细胞中出现病变也影响结果的观察;ELISA方法虽然灵敏度高,但受到病毒感染时间的限制,不能进行早期诊断;PCR方法敏感性高、特异性强,可以准确快速检测出极低含量的BRV,且操作简单、检测快速[9]。因VP7基因是BRV的结构基因,具有高度的保守性,本研究选择在VP7基因内部设计RT-PCR检测引物,提高了BRV的检出率,减少了漏检的可能。本研究建立的BRV RT-PCR检测方法具有良好的特异性、敏感性、重复性和稳定性,将为BRV的病原检测及分子流行病学调查等提供一种敏感、特异、快速、准确的分子生物学方法。 应用该方法检测22份临床疑似BRV感染的犊牛腹泻样品16份为阳性,35份临床组织病料样品6份为阳性,阳性率达17.14 %(6/35),该结果与常继涛等[9]报道内蒙古、黑龙江、新疆、北京、安徽等地区BRV感染的平均阳性率为12 %具有高度的一致性,表明BRV在我国牛群中已普遍存在,建议加强对该病毒的诊断,及时淘汰感染牛,保障我国养牛业健康发展。
(编辑:李雨慈)
参考文献:
[1] 侯美如,高俊峰,周庆民,等.牛轮状病毒诊断方法研究进展[J].中国草食动物科学, 2013,33(2):63-66.
[2] Badaracco A,Garaicoechea L,Rodriguez D,et al. Bovine rotavirus strains circulating in beef and dairy herds in Argentina from 2004 to 2010[J].Vet Microbiol, 2012,158(3-4):394-399.
[3] 栾婧婧,杨少华,马广强,等.新分离牛轮状病毒及其血清型的研究[J].家畜生态学报,2006, 27(6):141-144.
[4] Papp H,Laszlo B,Jakab F,et al.Review of group A rotavirus strains reported in swine and cattle[J]. Vet Microbiol, 2013,165(3-4):190-199.
[5] 张庆新,唐和平,常智双,等.犊牛轮状病毒病的诊断和防控[J].畜牧与饲料科学, 2010, 31(3):163-164.
[6] 杨少华,何洪彬,杨宏军,等. A组牛轮状病毒基因工程亚单位疫苗的初步研究[J].中国人兽共患病学报, 2011, 27(6):506-510.
[7] Doan YH, Nakagomi T,Aboudy Y,et al. Identification by full-genome analysis of a bovine rotavirus transmitted directly to and causing diarrhea in a human child[J]. J Clin Microbiol, 2013,51(1):182-189.
[8] Basera SS,Singh R,Vaid N,et al. Detection of Rotavirus Infection in Bovine Calves by RNA-PAGE and RT-PCR[J]. Indian J Virol,2010,21(2):144-147.
[9] 常继涛,崔久辉,李建军,等.我国部分地区牛轮状病毒的病原学调查及一株G10P[11]型牛轮状病毒的分离鉴定[J].2008,30(10):755-759.
