超声造影在腹腔镜射频消融治疗原发性肝癌中的效果
2015-09-11白文庆等
白文庆等
[摘要] 目的 观察超声造影(CEUS)在腹腔镜射频消融(LURFA)治疗原发性肝癌中的临床效果。 方法 选取2012年1月~2014年10月在我院接受原发性肝癌治疗的患者45例,按随机数字表法分为观察组(D组,超声造影+腹腔镜射频消融)25例,对照组(C组,腹腔镜射频消融)20例。比较两组患者术后消融率及术后并发症(发热、出血、疼痛等)的发生情况,术后1个月通过CEUS对手术疗效进行评价。随访术后6个月患者肿瘤无进展生存率及复发情况。 结果 D组术中射频消融的肿瘤直径为(2.92±0.89)cm,较术前超声直径[(2.21±0.32)cm]增大(P<0.05),C组射频消融肿瘤直径与术前比较,差异无统计学意义(P>0.05);术后1个月复查增强CT扫描,D组术前肿瘤76个,原位灭活或稳定68个(消融率89.4%),C组术前肿瘤59个,原位灭活或稳定40个(消融率67.8%),C组消融率较D组升高(P<0.05);术后6个月复查CT,D组肿瘤无进展生存率为78.9%,C组为59.3%,D组高于C组(P<0.05)。术后两组均有发热、出血、疼痛等并发症,无肝衰竭等并发症,并发症发生率比较差异无统计学意义(P>0.05)。 结论 超声造影在腹腔镜射频消融治疗原发性肝癌中,能够提高肿瘤消融率及术后6个月的肿瘤无进展生存率,且不增加术后并发症,值得临床推广。
[关键词] 超声造影;腹腔镜;射频消融;原发性肝癌
[中图分类号] R735.7 [文献标识码] A [文章编号] 1674-4721(2015)08(a)-0102-03
原发性肝癌首选治疗为手术切除[1],但大部分肝癌有临床症状时已无法切除,且术后复发率很高。目前临床多采用射频消融(RFA)治疗原发性肝癌[2-3]。RFA以其对癌灶的灭活效果确切、全身不良反应轻、对机体免疫状态影响小、患者依从性高、复发率低、操作安全简便等优点,已被广泛应用于临床。随着现代影像医学及内镜医学的发展,腹腔镜超声RFA(LURFA)的出现突破了常规RFA不可直视和触觉缺失两大限制,进一步拓宽了RFA的适用范围,已成为当前医疗水平下小病灶肝癌患者非外科治疗的首选方法[4]。本研究通过与传统腔镜射频治疗小病灶原发肝癌对比,以探讨围术期超声造影对腔镜射频治疗的临床意义。
1 资料与方法
1.1 一般资料
选择2012年1月~2014年10月在我院接受肝癌治疗的患者45例为研究对象,均签署知情同意书。入选标准:肝癌直径<5 cm,或者数目在5个以内,最大肿瘤在3 cm以下,肝功能Child-Pugh分级为A级或B级;经术前增强CT和活检病理证实。排除有弥散性病灶、病灶界限不清、肝衰竭等肿瘤患者。45例患者中,男28例,女17例,年龄43~67岁,平均(55.45±11.26)岁;Child-Pugh分级:A级35例,B级10例;26例患者合并有肝硬化,6例患者合并高血压,4例合并糖尿病。按随机数字表法将其分为治疗组(D组)和对照组(C组)。两组患者年龄、性别、Child-Pugh分级、合并症等比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
超声诊断仪使用飞利浦IU22型、GEE-9型,探头频率2.0~5.0 MHz,应用实时灰阶谐波造影技术,机械指数<0.1。造影剂系用意大利Bracco公司生产的造影剂声诺维(SonoVue)59 mg/支。射频治疗仪采用德国Selon双极RFA治疗系统,内置水循环冷却设计,主机输出功率1~200 W。对照组患者术前和术中先进行常规的超声检查,以观察消融治疗后的病灶边界情况、病灶大小和回声等。治疗组在术中进行彩超检查,记录血流情况,再进行超声造影,注入对比剂后扫描RFA前后的动脉期、门脉期和延迟期。RFA方法:先穿刺肿瘤供血动脉根部,用高温模式封闭供血动脉(即关闭冷循环,手动模式使针尖温度保持在90℃以上,加温30 s)再行RFA治疗。判定肿瘤灭活标准为:病灶在动脉期、门脉期和延迟期均无强化,显示为黑洞样。
1.3 观察指标
观察两组术中灭活的肿瘤直径大小,术后1个月增强CT证实的灭活肿瘤数,消融率以及术后发热、感染、出血等并发症的发生率。术后随访6个月,观察患者肿瘤无进展生存率及复发情况。
1.4 统计学方法
采用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,采用t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
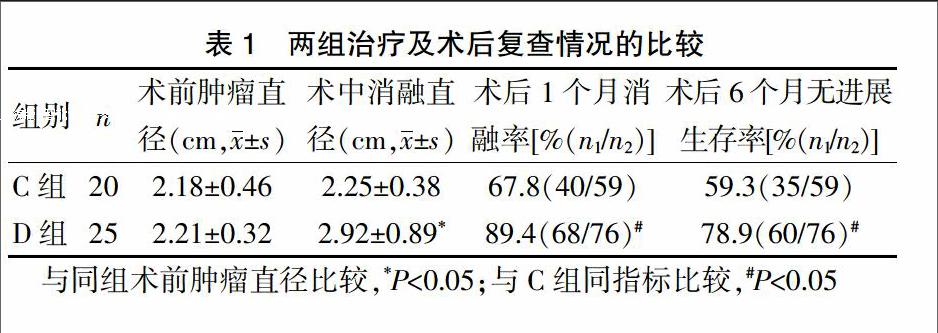
2.1 两组治疗及术后复查情况的比较
D组术中射频消融的肿瘤直径为(2.92±0.89)cm,较术前超声直径[(2.21±0.32)cm]增大(P<0.05),C组射频消融肿瘤直径与术前比较,差异无统计学意义(P>0.05);术后1个月复查增强CT扫描,D组术前肿瘤76个,原位灭活或稳定68个(消融率89.4%),C组术前肿瘤59个,原位灭活或稳定40个(消融率67.8%),两组比较差异有统计学意义(P<0.05);术后6个月复查CT,D组无进展肿瘤60个,无进展生存率为78.9%,C组无进展肿瘤35个,无进展生存率为59.3%,两组比较差异有统计学意义(P<0.05)(表1)。
2.2 术后两组患者并发症比较
术后C组发热1例,疼痛3例,渗血1例;D组发热2例,疼痛4例,无渗血。两组患者均未发生急性肝衰竭、死亡等并发症。两组并发症发生率比较,差异无统计学意义(P>0.05)。
3 讨论
RFA为一种微创治疗技术,其操作简单易行,疗效肯定,可重复性强,已经为临床所广泛应用,成为治疗肝癌的主要手段之一[5],也是肿瘤联合治疗的方法[6]。其中RFA的灼烧边缘范围被认为是影响肝内远处复发的独立影响因素之一[7]。在临床实际治疗当中,往往扩大肿瘤边界的消融范围,在术后的1~6个月的增强CT复查中仍然有部分肿瘤复发或存在。目前单纯的术前常规超声检查对原发性小肝癌肿瘤的边界及肿瘤活性范围界定可能存在不足和局限。在原发性肝癌的超声介入治疗中的关键问题是如何提高困难病灶的检出率,定位残留肿瘤组织和局部复发灶,准确、迅速地判断消融疗效[8]。研究证明超声造影在明确肿瘤范围及确定肿瘤病灶大小、性质方面具有明显的优势[9]。孙雅林[10]的研究也证明,RFA前进行超声造影能够显示普通超声所不能诊断的局限病灶,同时在RFA后进行超声造影能够提高RFA后残余病灶的灵敏度和特异度。而本试验中超声造影所消融的肿瘤直径比术前常规超声测量值更大,说明超声造影增加了肿瘤和周围正常肝组织的对比度[11],更能准确反映肿瘤的活性和实际范围,从而为更精确地灭活肿瘤、提高消融率提供了支持,优于常规超声。
本研究应用腹腔镜射频治疗肝癌,腹腔镜较常规的超声穿刺射频有以下优势:可视,更加直观,能够在超声辅助下更加准确地定位肿瘤及边界,消融定位准确[12-13],能够发现超声可能遗漏的肿瘤。同时腹腔镜能够多角度穿刺消融,动态掌握消融进程及效果。也可以直视下止血,防止超声穿刺出血、肝脏周围脏器(胃、胆囊、膈肌等)穿孔损伤等并发症,更加方便地处理并发症,减少患者后遗效应[14-17]。本研究应用的超声造影更能准确、清楚地显示肿瘤边缘,将肿瘤与周围组织区分开来[18]。因此超声造影辅助腹腔镜在原发小肝癌的治疗上较常规超声射频能够更加准确地确定肿瘤的活性和边界,直观判断消融的程度和效果。而术后的疼痛、出血及发热等并发症无差异[19-21]。
综上所述,超声造影辅助腹腔镜射频在治疗原发性肝癌的临床治疗中,比常规超声射频更加准确,消融率更高,术后肿瘤无进展生存率更高,且并发症无差异,因此值得临床推广应用。
[参考文献]
[1] Ministry of Health of the People′s Republic of China.Diagnosis and treatment standardization of primary liver cancer(2011 version)[J].Chin Clin Oncol,2011,16(10):929-946.
[2] Yin XY,Xie XY,Lu MD,et al.Percutaneous ablative therapies of recurrent hepatocellular carcinoma after hepatectomy:proposal of a prognostic model[J].Ann Surg Oncol,2012,19(13):4300-4306.
[3] Xu HX,Wang Y,Lu MD,et al. Percutaneous ultrasound-guided thermal ablation for intrahepatic cholangiocarcinoma [J].Br J Radiol,2012,85(1016):1078-1084.
[4] 刘爽,牟培源.腹腔镜超声在射频消融治疗肝癌中的应用[J].新医学,2010,41(10):682-683.
[5] Rhim H.Complications of radiofrequency ablation in hepatocellular carcinoma[J].Abadom Imaging,2005,30(4):409-418.
[6] 陈岚芬,李丹丹,黄进,等.超声引导单极冷循环射频消融联合TACE治疗肝癌的对比研究[J].中国超声医学杂志,2014,30(3):238-242.
[7] 骆惊涛,魏玺,周洪渊,等.肝癌射频消融术后肝内远处复发的相关因素分析[J].中华外科杂志,2009,47(20):1529-1531.
[8] Kim SK,Lim HK,Kim YH,et al.Hepatocellular carcinoma treated with radiofrequency ablation:spectrum of imaging findings[J].Radiographics,2003,23(1):107-121.
[9] Yeong-Kim A,Woo-Lee M,Rhin H,et al. Pretreatment evaluation with contrast-enhanced ultrasonography for percutaneous radiofrequency ablation of hepatocellular carcinomas with poor conspicuity on conventional ultrasonography[J].Korean J Radiol,2013,14(5):754-763.
[10] 孙雅林.超声造影在肝恶性肿瘤射频消融治疗疗效评估中的应用[J].中国当代医药,2013,20(9):100-101.
[11] 陈敏华,杨薇,严昆,等.超声造影对确定肝癌消融射频范围及治疗策略的应用价值[J].中华超声影像学杂志,2006,15(3):193-197.
[12] Hirooka M,Kisaka Y,Uehara T,et al.Efficacy of laparoscopic radiofrequency ablation for hepatocellular carcinoma compared to percutaneous radiofrequency ablation with aftificial ascites[J].Dig Endose,2009,21(2):82-86.
[13] 张玉杰,李文伦,李丹丹,等.超声引导经皮射频消融治疗毗邻横膈部肝癌的疗效与安全性评估[J].中国超声医学杂志,2012,28(8):737-740.
[14] Koda M,Murawaki Y,Hirooka Y,et al. Complications of radiofrequency ablation for hepatocellular carcinoma in a multicenter study: an analysis of 16346 treated nodules in 13283 patients[J].Hepatol Res,2012,42(11):1058-1064.
[15] 冯钜涛,陈劲松,岑钧华,等.腹腔镜肝切除术治疗肝癌的疗效观察[J].中国现代医生,2013,51(17):157-158.
[16] 伍远维,叶勇,李薇,等.腹腔镜切除与射频消融治疗小肝癌的疗效比较[J].现代诊断与治疗,2014,25(23):5455-5456.
[17] 聂剑宏.腹腔镜肝切除和开腹肝切除术治疗原发性肝癌的临床疗效比较[J].现代诊断与治疗,2014,25(23):5427-5428.
[18] Wu J,Yang W,Yin S,et al. Role of contrast-enhanced ultrasonography in percutaneous radiofrequency ablation of liver metastases and efficacy evaluation[J].Chin J Cancer Res,2013,25(2):143-154.
[19] 张航宇,窦科峰.超声联合肿瘤标志物CA199及超敏C反应蛋白检测对胆囊癌早期诊断准确性的影响[J].解放军医学杂志,2014,39(3):222-225.
[20] 常彬霞,霍丹丹,孙颖,等.206例非酒精性脂肪性肝炎患者的临床特点分析[J].解放军医学杂志,2013,38(9):743-746.
[21] 姜凯,陈继业,刘洋,等.活体猪肝射频消融河流效应对相应流域肝细胞的影响:病理学初步研究[J].解放军医学杂志,2013,38(5):347-350.
(收稿日期:2015-06-08 本文编辑:卫 轲)
