柴达木盆地梭梭耐盐相关基因PrxQ的克隆及其蛋白结构预测
2015-09-10马玉花冶贵生冯志鹏
马玉花+冶贵生+冯志鹏
摘要: 对柴达木盆地梭梭的PrxQ基因进行扩增,并利用生物软件对PrxQ基因序列进行分析,对蛋白结构进行预测。结果表明:柴达木盆地梭梭PrxQ基因长度为657 bp,编码218个氨基酸;PrxQ蛋白亲水性、二级结构、亚细胞定位、信号肽、跨膜螺旋区、三级结构预测结果显示,柴达木盆地梭梭PrxQ蛋白亚细胞定位于叶绿体,蛋白二级结构主要为无规则卷曲;PrxQ具有2个N-糖基化位点、7个蛋白激酶C磷酸化位点、2个酪蛋白激酶Ⅱ磷酸化位点,此外PrxQ蛋白的亲水性较强,无跨膜螺旋区。柴达木盆地梭梭PrxQ蛋白三维结构预测结果显示,PrXQ蛋白三维结构由α螺旋、β折叠、无规则卷曲互相盘绕而成。
关键词: 梭梭;PrxQ基因;序列分析;蛋白结构
中图分类号: S718.43 文献标志码: A
文章编号:1002-1302(2015)08-0027-04
梭梭(Haloxylon ammodendron)为藜科(Chenopodiaceae)梭梭属(Haloxylon Bunge)多年生小乔木,别称琐琐、梭梭柴,属强旱生植物 [1],主要分布在我国新疆的准噶尔盆地、塔里木盆地,内蒙古阿拉善盟、巴彦淖尔盟,甘肃的河西走廊西端,青海柴达木地区荒漠地区,生长于海拔2 700~3 000 m的半荒漠、荒漠地区的沙地,为国家濒危三级保护植物 [2]。
柴达木盆地是我国土地盐碱化的主要发生地区之一,由于该地区气候高寒干燥,蒸发量大而降水量小,加上风蚀、沙化严重,使盆地存在着沙漠化、盐渍化的双重危害,严重制约着该区社会经济的可持续发展。作为柴达木盆地旱生、盐生荒漠植被组成的主体,梭梭是当地流动沙地治理的先锋树种,它不仅具有显著的生态价值,而且具有很重要的药用价值,因而对其研究和开发利用具有重要的生态、经济、社会价值。
盐胁迫导致的渗透胁迫和离子毒害使植物产生大量的活性氧(ROS),ROS浓度的提高会积累丙二醛(MDA)等有害过氧化物,造成膜脂过氧化,使ROS产生与清除之间的动态平衡被破坏,如果不能及时清除ROS就会造成氧化胁迫 [3]。为了防止活性氧对细胞造成伤害,植物细胞会启动针对活性氧的清除机制。盐胁迫下盐生植物抗氧化酶活性高于非盐生植物 [4],盐胁迫下植物体内抗氧化酶的活性上升可清除过多的活性氧,从而保护膜系统不受破坏并提高植物的耐盐性 [5-6]。
过氧化物还原酶是植物抗氧化过程中的一种酶,其分布广泛,几乎存在于所有植物、酵母、细菌、寄生虫、哺乳动物等多种生物体内,基于氨基酸序列中半胱氨酸残基的保守性及催化机制可将植物的过氧化物还原酶分为4种:1-Cys Prx、2-Cys Prx、Ⅱ型Prx、Ⅱ型PRxQ [7-8]。过氧化物还原酶在原核生物、真核生物中都高度保守 [9],它可以催化H2O2还原为水,或在供体氢的存在下,催化各种烷基过氧化物还原为水和相应的醇,通过调节细胞内H2O2浓度参与信号传导 [10]。Kong等首先从佛甲草中克隆到PrxQ [11],目前已在四翅滨藜、拟南芥、梭梭(内蒙古阿左旗巴丹吉林沙漠)、小麦等植物中获得了PrxQ基因 [12-15]。甘晓燕等对内蒙古巴丹吉林沙漠梭梭的PrxQ基因进行了克隆和分析 [14]。由于不同生境下的植物基因具有变异性,本研究在对柴达木盆地梭梭进行PrxQ基因克隆的基础上,对PrxQ基因的核苷酸序列、氨基酸序列进行分析,在此基础上对PrxQ基因蛋白的亚细胞定位、二级结构、三级结构、功能位点及跨膜区进行了预测,以期为下一步PrxQ基因的表达特性研究奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 供试梭梭的种子采自青海省柴达木盆地;供试土壤为园土,按1 ∶ 2的比例加入泥炭。2013年9月中旬采集梭梭的种子,经消毒后播种到30 cm(高)×25 cm(内径)的花盆中,待梭梭苗木长到10 cm左右时采集位于中上部的绿色同化枝进行总RNA的提取。
1.1.2 主要试剂 Ex Taq DNA聚合酶、反转录酶、DL2000 DNA marker,购自宝生物工程(大连)有限公司;植物RNA提取试剂盒,购自北京艾德莱生物科技有限公司。
1.2 试验方法
1.2.1 引物设计与合成 根据已发表的PrXQ基因序列设计引物,由大连宝生物工程有限公司合成,预期目的片段长度为657 bp。引物序列为:PrXQ-F:5′-ATGGCTACCCTCTCACTT-3′;PrXQ-R:5′-TCAAAGGCTTTGTAGAAATT-3′。
1.2.2 梭梭总RNA的提取 参照试剂盒说明提取梭梭总RNA。
1.2.3 RT-PCR 取5 μL提取的梭梭总RNA、4 μL下游引物、3 μL dNTP Mixture、3 μL RNase-Free ddH2O,70 ℃预热 5 min,立即冰浴2 min;再分别加入4 μL 5倍的反转录缓冲液、1 μL反转录酶,置于42 ℃水浴50 min,95 ℃ 5 min;补加RNase-Free ddH2O至总体积为50 μL。将得到的cDNA于-20 ℃保存。
1.2.4 PCR扩增 取2 μL上述反转录产物、5 μL 10倍的PCR缓冲液、3 μL MgCl2、4 μL dNTP、各2 μL上下游引物、05 μL Taq DNA聚合酶,加RNase-Free ddH2O至50 μL后进行扩增。PCR扩增的程序为:94 ℃预变性5 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃ 延伸1 min,共35个循环;72 ℃延伸10 min。
1.2.5 序列测定与分析 将扩增正确的PCR产物送交生物公司进行序列测定,应用DNAStar对PrxQ基因序列进行分析,并预测PrxQ蛋白的二级结构和亲水性。用SignalP4.1进行蛋白信号肽分析,TMHMM进行蛋白跨膜螺旋区分析,PredictProtein 进行蛋白细胞定位及蛋白修饰位点分析,应用 I-TASSER 在线服务器预测蛋白的三级结构。
2 结果与分析
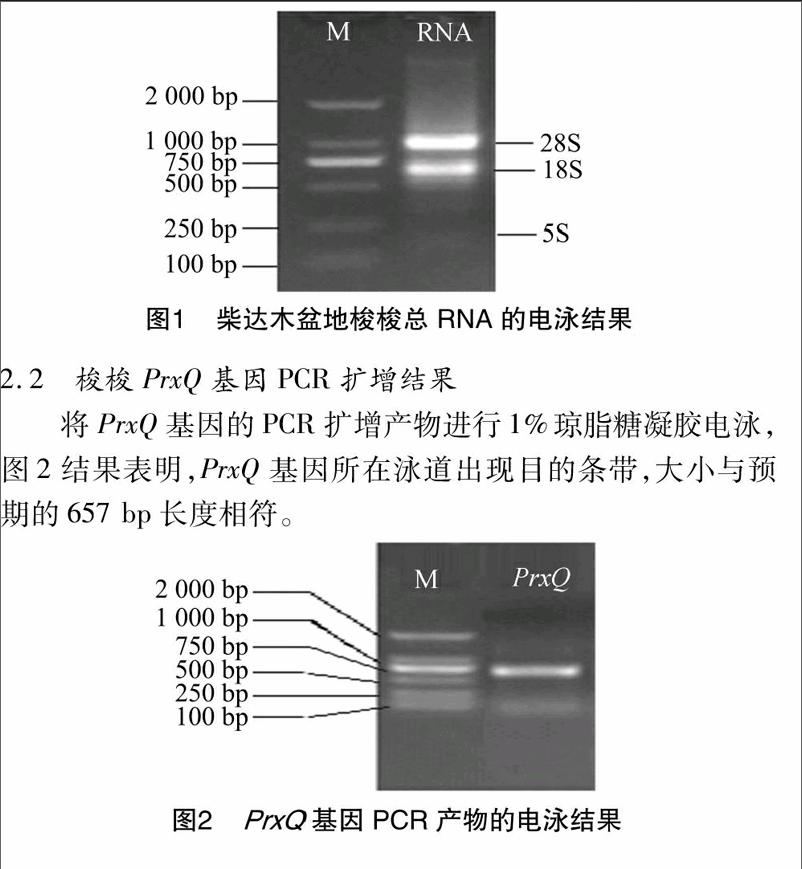
2.1 梭梭总RNA提取
由图1提取的梭梭总RNA经1%琼脂糖凝胶电泳的检测结果看出,RNA所在泳道目的条带清晰,28S亮度为18S的2倍,提取的总RNA可以满足后续试验的要求。
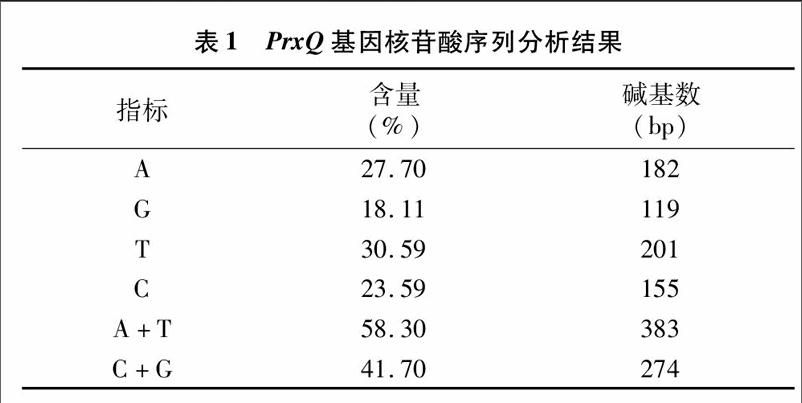
2.2 梭梭PrxQ基因PCR扩增结果
将PrxQ基因的PCR扩增产物进行1%琼脂糖凝胶电泳,图2结果表明,PrxQ基因所在泳道出现目的条带,大小与预期的657 bp长度相符。
2.3 PrxQ基因核苷酸序列和氨基酸序列分析
2.3.1 核苷酸序列分析 测定的PrxQ基因核苷酸序列经DNASTAR软件分析,表1结果表明:PrxQ基因核苷酸序列长度为657 bp,T的含量较高,达到30.59%;整个基因序列中 A+T 的含量高于G+C的含量。
2.3.2 氨基酸序列分析 推导的PrxQ基因氨基酸序列经DNASTAR软件进行分析表明,氨基酸序列长度为218个,相对分子质量为23 977.06 u,等电点为9.317。根据表2数据计算各类氨基酸中碱性、酸性氨基酸的数量比例分别为151%、8.3%,疏水性、亲水性氨基酸的数量比例分别为353%、41.3%。
2.3.3 柴达木盆地梭梭PrxQ基因与参考基因核苷酸序列、氨基酸序列的比较结果 将获得的柴达木盆地梭梭PrxQ基因与GenBank中登录的内蒙古巴丹吉林沙漠梭梭(JN657416.1)、胶杨(Populus balsamifera,AY530803.1)、盐角草 (Salicornia herbacea,FJ443123.1)、佛甲草(Sedum lineare,AB037598.1)、盐地碱蓬(Suaeda salsa,AY373447.1)、冬小麦(Triticum aestivum,JQ739147.1)、团藻(Volvox carteri,XM_002954776.1)等植物的PrxQ基因核苷酸序列、氨基酸序列进行比较。表3结果表明,所得梭梭PrxQ基因序列与非梭梭属植物PrxQ基因序列间存在着丰富的变异,其核苷酸序列的同源性在40.5%~86.8%间,氨基酸序列同源性在 33.6%~89.3% [JP+1]间,与已登录的梭梭PrxQ基因核苷酸序列同源性为98.8%,氨基酸序列同源性为97.7%,有一定的突变发生,可见不同来源梭梭的PrxQ基因存在着丰富的变异。
2.4.2 PrxQ蛋白二级结构预测 PredictProtein预测二级结构结果显示,梭梭PrxQ蛋白二级结构主要组成为:α螺旋,占20.18%;β折叠,占23.39%;无规则卷曲,占56.42%。可见无规则卷曲是梭梭PrxQ蛋白二级结构的主要构成元件。
利用SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)对PrxQ蛋白进行信号肽的预测,结果表明,PrxQ蛋白为非分泌蛋白,该蛋白不含信号肽。用TMHMM预测梭梭PrxQ基因跨膜区,结果显示PrxQ蛋白不含跨膜螺旋的结构。
利用PredictProtein对PrxQ进行功能位点预测,结果表明,PrXQ具有2个 N-糖基化位点,分别为8~11位的NHTL、31~34位的NISI,其糖基化的连接点均为天冬酰胺;7个蛋白激酶C磷酸化位点,分别为19~21位的TPK、59~61位的SPR、62~64位的SYK、81~83位的TLK、144~146位的SHK、147~149位的SFK、211~213位的TLK;2个酪蛋白激酶Ⅱ磷酸化位点,分别为81~84位的TLKD、138~141位的SGDD。
图4的亲水性预测结果显示,PrxQ蛋白的亲水性较强,分布区域较多,主要的分布区为17~30、37~41、49~64、81~ 90、94~97、106~115、117~130、139~154、159~172、181~189、198~210位。可见该蛋白亲水性较强,具有多个连续亲水区。
在蛋白质二级结构的基础上,采用I-TASSER在线软件对柴达木盆地梭梭PrxQ蛋白进行蛋白质三维结构的预测。由图5的预测结果可知:5个得分最高的PrxQ蛋白三维结构均主要由α螺旋、β折叠、无规则卷曲互相盘绕而成,其中模型1的C-score(表示预测模型的置信度)达到了-2.51,说明所建模型可信度较高。
3 结论与讨论
对于同一个物种而言,不同的生境使其具有不同的生物学特性,长期生长于高盐环境的植物往往具有比生长于低盐环境的植物更强的耐盐性 [16-17],柴达木盆地梭梭长期生长于盐碱地中,具有很强的耐盐性。前人对干旱区盐生植物的生理生化研究显示,相对于白梭梭、柽柳、胡杨、枸杞、柠条、扬柴、沙棘、沙枣等旱生植物,梭梭具有更强的耐盐性。除了在高盐环境中Na+的吸收、转运、区室化作用对梭梭的生存起着关键作用外 [18],抗氧化酶系统及时清除自由基也起着至关重要的作用。本研究通过对柴达木旱生、盐生植物梭梭的PrxQ基因的克隆、序列分析及结构预测,以期为阐明柴达木盆地梭
梭耐盐机制奠定基础。
本研究获得的柴达木盆地梭梭PrxQ基因总长657 bp,编码218个氨基酸,序列比对分析表明:柴达木盆地梭梭PrxQ基因核苷酸序列与不同科属植物PrxQ基因的同源性在405%~86.8%间,氨基酸序列同源性在33.6%~89.3%间;而与已发表的内蒙古巴丹吉林沙漠梭梭PrxQ基因的核苷酸序列存在一定的差异性,其同源性为98.8%,氨基酸序列同源性为97.7%。不同地域和自然环境的梭梭不仅存在着核苷酸序列上丰富的变异,其氨基酸序列也存在着丰富的变异,从而保证了梭梭在极端环境下能够正常生长发育。
此外通过在线分析软件预测可知,梭梭PrxQ蛋白定位于叶绿体中,且该蛋白不含信号肽,为非分泌蛋白,不含跨膜螺旋的结构,为非跨膜蛋白,且属亲水蛋白。二级结构预测显示,无规则卷曲为梭梭PrxQ蛋白二级结构的主要构成元件。功能位点预测显示,PrxQ具有2个 N-糖基化位点,说明柴达木盆地梭梭可能通过PrxQ蛋白的糖基化实现蛋白的翻译后调控,并参与细胞信号识别等生命过程 [19];另外含有7个蛋白激酶C磷酸化位点、2个酪蛋白激酶Ⅱ磷酸化位点,说明梭梭PrxQ蛋白可能通过磷酸化级联反应依次控制基因表达并进行细胞的信号传导。在蛋白质二级结构的基础上对柴达木盆地梭梭PrxQ蛋白进行蛋白质三维结构的预测并获得了其三维结构,主要由α螺旋、β折叠、无规则卷曲互相盘绕而成。
参考文献:
[1] 盛晋华,乔永祥,刘宏义,等. 梭梭根系的研究[J]. 草地学报,2004,12(2):91-94.
[2]邹 婷,李 彦,许 皓,等. 不同生境梭梭对降水变化的生理响应及形态调节[J]. 中国沙漠,2011,31(2):428-435.
[3]Rai M K,Kalia R K,Singh R,et al. Developing stress tolerant plants through in vitro selection-an overview of the recent progress[J]. Environmental and Experimental Botany,2011,71(1):89-98.
[4]Seckin B,Turkan I,Sekmen A H,et al. The role of antioxidant defense systems at differential salt tolerance of Hordeum marinum Huds. (sea barleygrass) and Hordeum vulgare L.(cultivated barley)[J]. Environmental and Experimental Botany,2010,69(1):76-85.
[5]Castelli S L,Grunberg K,Muoz N,et al. Oxidative damage and antioxidant defenses as potential indicators of salt-tolerant Cenchrus ciliaris L. genotypes[J]. Flora-Morphology,Distribution,Functional Ecology of Plants,2010,205(9):622-626.
[6]Lee S H,Ahsan N,Lee K W,et al. Simultaneous overexpression of both Cu Zn superoxide dismutase and ascorbate peroxidase in transgenic tall fescue plants confers increased tolerance to a wide range of abiotic stresses[J]. Journal of Plant Physiology,2007,164(12):1626-1638.
[7]Tripathi B N,Bhatt I,Dietz K J. Peroxiredoxins:a less studied component of hydrogen peroxide detoxification in photosynthetic organisms[J]. Protoplasma,2009,235(1/2/3/4):3-15.
[8]Dietz K J. Peroxiredoxins in plants and cyanobacteria[J]. Antioxidants & Redox Signaling,2011,15(4):1129-1159.
[9]Verdoucq L,Vignols F,Jacquot J P,et al. In vivo characterization of a thioredoxin h target protein defines a new peroxiredoxin family[J]. The Journal of Biological Chemistry,1999,274(28):19714-19722.
[10] 王 蔚,祁婷婷,刘 芸,等. 过氧化物氧还蛋白家族的功能及调节机制[J]. 生命的化学,2010,3(2):184-188.
[11]Kong W,Shiota S,Shi Y,et al. A novel peroxiredoxin of the plant Sedum lineare is a homologue of Escherichia coli bacterioferritin co-migratory protein (Bcp)[J]. The Biochemical Journal,2000,351(Pt 1):107-114.[HJ1.7mm]
[12]Bouchenak F,Henri P,Benrebiha F Z,et al. Differential responses to salinity of two Atriplex halimus populations in relation to organic solutes and antioxidant systems involving thiol reductases[J]. Journal of Plant Physiology,2012,169(15):1445-1453.
[13]Adén J,Wallgren M,Storm P,et al. Extraordinary μs-ms backbone dynamics in Arabidopsis thaliana peroxiredoxin Q[J]. Biochimica et Biophysica Acta,2011,84(12):1880-1890.
[14]甘晓燕,石 磊,周晓燕,等. 梭梭过氧还蛋白基因(PrxQ)克隆与序列分析[J]. 西北农业学报,2012,21(6):53-57.
[15]张 盈,牛祖彪,李 娜,等. 异附加系小麦过氧化物还原酶基因TaPrxQ的克隆与序列分析[J]. 分子植物育种,2012,10(3):285-289.
[16]Ahmad M S,Ashraf M,Ali Q. Soil salinity as a selection pressure is a key determinant for the evolution of salt tolerance in blue panicgrass (Panicum antidotale Retz.)[J]. Flora,2010,205(1):37-45.
[17]Long X H,Huang Z R,Huang Y L,et al. Response of two jerusalem artichoke (Helianthus tuberosus) cultivars differing in tolerance to salt treatment[J]. Pedosphere,2010,20(4):515-524.
[18]Jampeetong A,Brix H. Effects of NaCl salinity on growth,morphology,photosynthesis and proline accumulation of Salvinia natans[J]. Aquatic Botany,2009,91(3):181-186.
[19]Helenius A,Aebi M. Intracellular functions of N-linked glycans[J]. Science,2001,291(5512):2364-2369.
