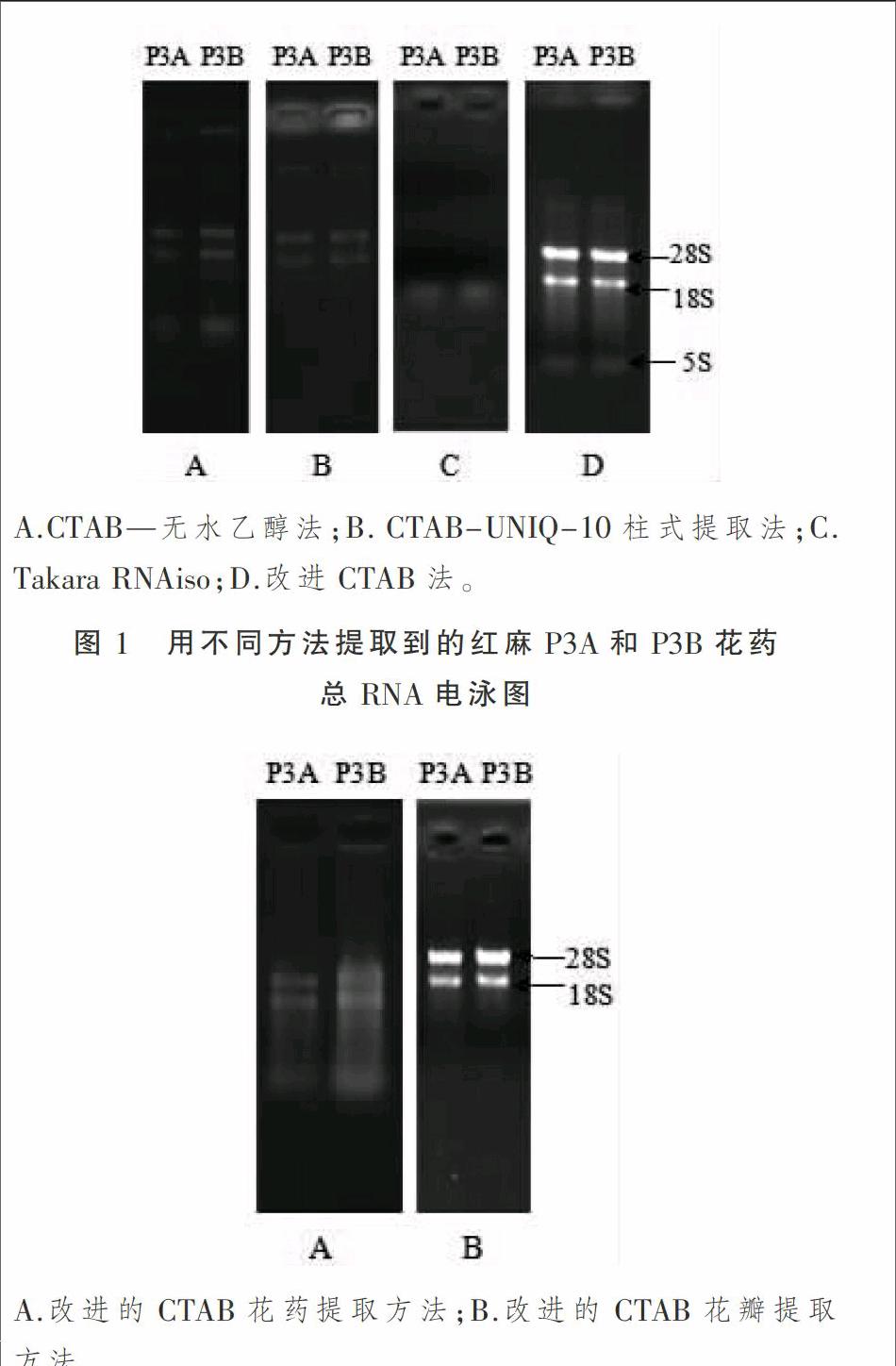
从红麻花药和花瓣中提取高质量总RNA的方法
2015-09-02周瑶瑶陈春妍陈鹏刁勇周瑞阳
周瑶瑶 陈春妍 陈鹏 刁勇 周瑞阳
摘 要:红麻(Hibiscus cannabinus L.)花药和花瓣因含有较多的多糖、酚类等物质而较难提取高质量的RNA,本研究探索一种适用于红麻花药和花瓣高质量总RNA的方法以进行cDNA文库构建等后续试验。通过借鉴植物DNA的CTAB提取法,结合RNA的理化性质,在提取液中加入6%的β-巯基乙醇,并在开始裂解时加入1/10体积的5 mol·L-1 KAc和1/10体积的无水乙醇对去除多糖特别有效。结果显示,利用该方法得到的RNA质量高,条带清晰完整,检测OD 260/280在1.8~2.1之间,OD 260/230在2.0~2.6之间,产量为花药987.3 ng·μL-1,花瓣752.1 ng·μL-1。该方法提取的总RNA可直接用于mRNA纯化,cDNA文库构建及RT-PCR等后续分子试验。
关键词:红麻;花药;花瓣;RNA提取
中图分类号:S563.5 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2015.09.004
A Method of Extracting High Quality Total RNA from the Anthers and Petals of Kenaf
ZHOU Yao-yao, CHEN Chun-yan,CHEN Peng,DIAO Yong,ZHOU Rui-yang
(Provincial Key Laboratory of Plant Genetics and Breeding, Guangxi University, Nanning 530005, China)
Abstract:The anthers and petals of Kenaf contain high content polysaccharide and polyphenol. An efficient method for high quality total RNA extraction from the anthers and petals of Kenaf is requisite for the following experiments such as cDNA library construction and so on. Based on the CTAB extraction method for plant DNA and combined with the physicochemical properties of RNA. 6% β-mercapto ethanol was added to extraction buffer and 1/10 volume 5 mol·L-1 KAc with 1/10 volume anhydrous ethanol was used in the initial cell disruption so as to remove polysaccharide from the anthers and petals. The result showed that by this improved method,high quality RNA could be obtained, and the band was clear and complete. A D260/D280 ratio ranged between 1.8 and 2.1. A D260/D230 ratio stand between 2.0 and 2.6. The RNA productivities from the anthers and petals of kenaf were 987.3 ng·μL-1 and 752.1 ng·μL-1 respectively. High quality RNA could be obtained by this improved RNA extraction protocol, and RNA was suitable for RT-PCR, mRNA purification, cDNA library construction and so on.
Key words:kenaf;anther;petal;RNA extraction
红麻(Kenaf)是锦葵科(Malvaceae)木槿属(Hibiscus)一年生韧皮纤维作物,学名为Hibiscus cannabinus L.,别名为洋麻、槿麻等。从红麻中提取高质量的总RNA是进行红麻基因表达研究的重要基础,只有纯度高、完整性好的总RNA才可用于mRNA纯化、Northern杂交、构建cDNA文库及差减文库、Real-time PCR定量分析、蛋白质的体外翻译等进一步研究。而红麻的花药和花瓣富含多糖、多酚、蛋白质和未知次级代谢产物,它们通常与RNA不可逆结合或与RNA共同沉淀,难以提取到高质量、高纯度的RNA;另外,植物组织中存在RNase,在细胞破碎后释放出来的RNA会被其分解,所以要采取有效措施抑制RNase并使之失活[1]。高质量的花药和花瓣总RNA是进行红麻分子育种的基础,也为揭示细胞质雄性不育分子机理提供了重要保证。
目前,有关植物组织中RNA提取方法的报道已有很多,诸如Trizol法[2]、CTAB-PVP法[3]、盐酸胍法[4],酚-SDS法[5]及CTAB/酸酚法[6]等,这些方法已广泛用于许多植物总RNA的提取。陈美霞等[7]比较了多种传统的RNA提取方法,发现用热硼酸法可以提取到红麻福红992叶片的总RNA。由于不同植物或同种植物的不同组织含有的糖类、酚类以及次级代谢产物的成分复杂,而且各不相同,如果这些物质不能得到有效的去除,RNA提取的产量和纯度会受到影响,现已有报道在猕猴桃[8]、柿果[9]、香蕉果肉[10]、芍药花瓣[11]、木薯[12]和荷花花瓣[13]等植物组织中成功地提取到总RNA,但是关于红麻花药和花瓣的总RNA提取尚未见报道。为纯化mRNA以构建花药及花瓣的消减杂交文库,需要高质量的总RNA,本研究做了大量的探索实践,比较了CTAB-乙醇沉淀法、商业化RNA抽提试剂盒(Takara RNAiso plus(Total RNA)提取试剂盒)、UNIQ-10离心柱法[14]以及笔者根据红麻的生理生化特性改进的CTAB法,以获得具有高质量、高纯度的红麻花药和花瓣总RNA。
1 材料和方法
1.1 试验材料
红麻P3A:红麻CMS系材料;P3B:红麻保持系材料。两种材料由广西大学周瑞阳教授提供。摘取花蕾期花药和花瓣,立即用液氮预冷,于-70 ℃保存。
1.2 试验方法
1.2.1 前处理 提取前,为杜绝RNase存在而降解RNA,事先将提取过程中所用的所有器具(离心管,枪头)均用0.1%的DEPC水浸泡处理12 h以上,试验中所用到的试剂用DEPC处理水配制(Tris-HCl和SDS不可用DEPC直接处理)。研磨样品用的研钵清洗干净,用0.1%的DEPC处理至少12 h,然后高压灭菌或者放置烘箱180 ℃烘烤6 h以上。
试验过程中,应注意戴口罩,勤换手套(防止开离心盖时污染盖子内侧进而引入RNase)。
1.2.2 RNA提取方法比较 (1) CTAB-乙醇沉淀法。根据刘洋等[3]报道的用CTAB-PVP法提取棉花各组织总RNA的研究加以改进, 将LiCl沉淀的过程改成在抽提之前加入1/10体积的5 mol·L-1 KAc去除多糖,在两次氯仿∶异戊醇(24∶1)抽提后取上清液,加入1/10体积NaAc和2.5倍体积无水乙醇。-20 ℃沉淀6 h,其余步骤一样。
(2)CTAB-UNIQ-10柱式提取法。UNIQ-10 RNA离心纯化柱购于上海生工生物工程技术服务有限公司,将纯化柱和CTAB法结合使用,根据何海旺等[14]报道的用玻璃粉吸附植物核酸的方法,用UNIQ-10 RNA离心纯化柱代替玻璃粉吸附柱,既节省时间,又提高RNA的吸附能力。
(3)商品化试剂盒。采用宝生物工程(大连)有限公司的Takara RNAiso plus(Total RNA)试剂盒提取红麻P3A和P3B的总RNA,操作步骤按试剂盒说明书进行。
(4)本研究改进的CTAB法。根据CTAB-乙醇法做了一些改进,在研磨样品时不将样品转移至离心管中,而是将提取液直接倒入研钵中,用无RNase处理的锡箔纸覆盖,在后面的提取步骤中加入了去除多酚多糖的步骤。具体操作如下:1)取8 mL CTAB提取液加2%的PVP于65 ℃温浴15 min直至PVP完全溶解,同时用液氮预冷研钵;2)称取1 g左右花药(或0.3~0.4 g红麻花瓣)放于液氮预冷的研钵中研磨成粉末状,立即将预热的CTAB提取液(加6%β-巯基乙醇)倒入研钵中,将粉末完全覆盖并均匀涂抹,用锡箔纸盖住研钵,待裂解液完全解冻,用研棒充分研磨;3)分装800 μL到2 mL离心管中,65 ℃水浴8 min,加入1/10体积的5 mol·L-1 KAc和1/10体积的无水乙醇,以及等体积的水饱和酚和氯仿∶异戊醇(24∶1),并涡旋震荡5 min;4)室温静置2 min,12 000 r·min-1,4 ℃离心15 min;5)将上清液转移至新的2 mL离心管中,加等体积的氯仿∶异戊醇(24∶1),12 000 r·min-1,4 ℃离心10 min(花瓣需要加入1/10体积的5 mol·L-1 KAc和1/10体积的无水乙醇);6)如果中间蛋白层较多,重复步骤5)2次,吸取上清液时动作要慢,注意不要吸到蛋白层,而且上清液不宜吸取过多;7)上清液转移至新的离心管中,加入1/3体积的8 mol·L-1 LiCl,-20 ℃下沉淀4 h;8)14 000 r·min-1,4 ℃离心30 min;9)弃上清,用400 μL 3 mol·L-1 LiCl轻微漂洗以去除残留的多糖;10)加入200 μL STE buffer溶解RNA沉淀,再加入1/10体积NaAc和2.5倍体积无水乙醇。-80 ℃沉淀30 min;11)14 000 r·min-1,4 ℃离心20 min;12) 小心丢弃上清液,用1 mL70%的乙醇漂洗沉淀,14 000 r·min-1,4 ℃,5 min洗涤沉淀2次;13)室温干燥RNA 5~10 min,溶于40 μL DEPC水中,电泳检测完整性,保存于-80 ℃备用。
1.2.3 琼脂糖凝胶电泳检测 电泳槽在电泳前进行了预处理,采用1 mol·L-1 的NaOH浸泡2 h,然后用DEPC水冲洗晾干备用,用DEPC处理水配制1×TAE缓冲液,取3 μL提取的总RNA,于1.2%琼脂糖凝胶中进行电泳检测。
1.2.4 RT-PCR 为进一步验证改进方法提取的总RNA的完整性和转录活性,采用Clontech公司的SMARTer PCR cDNA Synthesis Kit反转录合成cDNA,步骤按照试剂盒说明书先合成cDNA第1链,再稀释10倍后进行第2链合成(LD-PCR) 同时以获得的cDNA为模板,以红麻管家基因甘油醛-3-磷酸脱氢酶(GAPDH)引物(5′引物为5′-ACATAAAGGGTGGTGCCAAGAAAGT-3′;3′引物为5′-GGTTGCTGTATCCCCATTCGTTGT-3′)(该引物由本实验室博士研究生赵艳红提供)进行PCR扩增,PCR反应程序为:94 ℃预变性3 min;94 ℃ 20 s, 50 ℃ 30 s, 72 ℃ 90 s, 32个循环; 最后72 ℃延伸10 min。用1.2% 琼脂糖凝胶电泳检测扩增产物。该段GAPDH的PCR产物预期长度为635 bp。
1.2.5 从总RNA中抽提mRNA 将提取的总RNA收集到一个无菌无RNase的离心管中,用真空离心浓缩仪浓缩到500 μL,mRNA的提取用Promega公司的polyATtract mRNA Isolation Systems,按照试剂盒提供的操作指南进行。抽提完后,各取10 μL(总体积250 μL)用1.2%琼脂糖凝胶于1×TAE缓冲液电泳检测,剩余mRNA溶液浓缩到所需要的浓度后立即进行后续试验,或短时间保存于-70 ℃。
2 结果与分析
2.1 RNA完整性分析
经琼脂糖非变性凝胶电泳检测,结果表明,CTAB-无水乙醇沉淀法能提取较纯净的红麻花药总RNA,有完整的28S、18S和5S条带,但是RNA浓度较低,对于需求量大的文库构建,此方法不能满足试验的要求;CTAB-UNIQ-10柱式提取法提取红麻的花药RNA,点样孔较亮,存在多糖和蛋白质严重污染,同时还有DNA污染,RNA浓度低;Takara RNAiso plus(Total RNA)试剂盒提取红麻总RNA未见28S和18S条带,效果较差;如图1所示,本研究改良的CTAB法提取得到的红麻花药总RNA浓度最高,28S、18S和5S谱带清晰,28S条带明显亮于18S(其亮度为18S的2倍),无蛋白质、多糖污染,表明所提取的总RNA完整性较好。如图2所示,用普通的CTAB法得不到红麻花瓣总RNA,而按照提取红麻花药的方法得到的RNA含糖较多,通过抽提前向提取液加入1/10体积的5 mol·L-1 KAc和1/10体积的无水乙醇可有效将红麻多糖和RNA分离。
综合比较上述几种RNA提取方法,结果显示改进后的CTAB方法能彻底去除多糖、多酚、蛋白质和DNA,RNA条带清晰,无拖尾现象,通过紫外分光光度计检测,OD260/OD280值均在1.8~2.1之间,OD260/230值在2.0~2.6之间,符合后续试验对于RNA完整性和纯度的要求。根据OD260值计算RNA的浓度:RNA的浓度=稀释倍数×OD260值×40 ng·mL-1,RNA产量较高,分别为花药987.3 mg·μL-1,花瓣752.1 ng·μL-1(P3A和P3B的平均值)。
2.2 RT-PCR
以提取的总RNA为模板,按照Clontech公司的SMARTer PCR cDNA Synthesis Kit反转录合成cDNA(图3),由图3可知花药和花瓣的cDNA smear带主要分布在0.5~2.0 kb,符合一般植物cDNA分布范围。以此cDNA作模板扩增一段管家基因GAPDH,电泳结果显示,成功扩增出目的片段,而且片段长度约为635 bp(图4),与克隆测序得到的片段一致,由此说明提取的总RNA具有反转录活性,可以进行后续cDNA文库构建等。
2.3 抽提mRNA情况
用本方法提取的总RNA稳定,保存时间较长,且经过真空离心浓缩后不降解(图5),抽提得到的mRNA谱带大小在0.5~3.0 kb,质量较好(图6),可用于构建cDNA文库及Real-time PCR等高精度的后续试验。
3 结论与讨论
在本研究中,提取红麻花药总RNA采用改进的CTAB法得率最高,质量和纯度都能满足试验要求。CTAB-无水乙醇沉淀法虽然能得到完整的5S RNA,但起始花药用量不宜太大,得率也较少,但是通过此法可以得到完整的小RNA,可以进行后续micro RNA,siRNA及基因表达调控的研究,有一定的应用价值;CTAB-UNIQ-10柱式提取法采用的是离心柱吸附(过滤膜)的方法,它同样能吸附一定量的基因组DNA,特异性不强,吸附能力有限,得率低,同时由于柱子的机械阻隔作用,RNA单链可能会断裂,得到RNA不完整,尤其是红麻花药含多糖较多,使提取液过于黏稠,过滤效率大大降低;采用Takara的RNAiso plus(Total RNA)试剂盒提取法,由电泳图可知仅见有分子量很小的条带,说明红麻总RNA被降解。红麻花瓣的总RNA提取则相对要困难得多,采用上述提取花药的几种方法,均得不到完整的RNA,而改进的CTAB提取方法则能提取到完整无污染的总RNA,说明1/10体积的5 mol·L-1 KAc和1/10体积的无水乙醇联合去除红麻中的多糖效果较好,试验过程中注意花瓣起始量不能加太多,否则提取液粘稠度增加,RNA提取效率下降;采用6%的β-巯基乙醇大大抑制了RNase的活性,保证了RNA在细胞裂解后不被其降解;采用直接加提取液到研钵中有效避免了样品转移过程中外界RNase的污染,同时也使样品一直保持在低温状态,RNA降解的机会大大降低。在前期摸索中也尝试了天根的植物总RNA提取试剂盒(DP432)和上海生工的Trizol提取试剂盒,都得不到理想的RNA。
由于各种植物及植物的不同组织都有其各自的化学组成和结构特点,有的组织细胞壁厚,有的组织木质化程度高,不同组织中蛋白质、多糖、多酚以及未知的次生代谢物等物质含量各不相同,因此,在研究中无法用一套固定的操作方法去提取不同物种、不同组织的总RNA,只有在了解常用RNA提取方法的基础上,结合本材料特有的化学组分进行有效地摸索和改进,才能找到最佳方案[15]。本研究通过总结并试验前人在各种植物不同器官RNA的提取方法,结合红麻组织器官的理化性质摸索出一种能有效去除红麻中的多糖多酚等物质的RNA提取方法。本实验室已应用该方法成功提取了根、茎(韧皮部)、叶的总RNA,质量和纯度都很好,可以进行后续分子试验。
RNA提取主要受以下几方面因素的影响:(1)pH值。pH值主要影响DNA和RNA的分离,在pH值为5.3的酸性环境中,DNA和RNA分别进入有机相和水相,蛋白则被有机溶剂变性除去。水相经过再次变性和分相处理后只剩下RNA,后面经醇沉淀即可获得[16]。本试验中采用的水饱和酚(pH值为5.2)除去DNA,而醋酸钾和醋酸钠也都是照成一个低pH值的环境,使RNA更稳定。(2)多糖多酚。多糖多酚的存在使花药特别是花瓣中总RNA的分离更加困难,主要是由于多糖的许多理化性质同RNA极为相似,通常情况下,多糖会和RNA缠绕在一起以复合体形式存在,在除去多糖的同时,RNA也会一同流失。同时多糖可以抑制许多酶的活性,因此污染了多糖的RNA样品无法用于进一步的分子生物学研究[17]。本试验采用1/10体积的5 mol·L-1 KAc和1/10体积的无水乙醇在裂解细胞时即加入提取液中,提取效果较好,且对于花瓣这种含糖较高的组织,只加一次不足以去除全部多糖,需在后面有机溶剂抽提前根据需要再次加入,RNA得率明显提高。同时,还可以辅加LiCl来选择性沉淀RNA(可能会损失掉一些小分子的RNA)。(3)起始材料的加量。对于植物来说,由于多糖多酚等次生代谢产物是随着量累积的,初始样品量越多,不能充分研磨样品,分离RNA的难度就越大。由于多糖造成提取液黏稠,在相同体积的裂解液下,花瓣起始加量要比花药少。(4)环境。RNA很不稳定,极易被RNase降解,而RNase存在于吸头、试剂瓶、皮肤汗液等,所以提取过程中所使用的器皿和试剂耗材等尽量做到无RNase,清洁的试验环境,以及试验过程中勤换手套等可以消除外源RNase污染,-70 ℃可保存半年不降解。
综上分析,利用本方法提取的红麻花药及花瓣总RNA取得了较好的效果。提取到的RNA基本上排除了多糖、蛋白质和DNA的干扰,实践证明其质量和纯度完全满足包括小分子RNA测序、构建消减杂交文库、转录组测序等后续分子试验要求。
参考文献:
[1] 吴凯朝, 黄诚酶, 李杨瑞, 等. Trizol试剂法快速高效提取3种作物不同组织总RNA[J]. 南方农业学报, 2012, 43(12):1 934-1 939.
[2] 孙德权, 郭启高, 胡玉林, 等.改良Trizol法提取香蕉叶片总RNA[J]. 广西农业科学, 2009(5):162-164.
[3] 刘洋, 何心尧, 马红波, 等. 用CTAB-PVP法提取棉花各组织总RNA的研究[J].中国农业大学学报, 2006, 11(1):53-56.
[4] Su X, Gibor. A method for RNA isolation from marine macroalgae[J]. Anal Biochem, 1988, 174:650-657.
[5] 夏兰芹, 郭三堆. 棉花RNA的快速提取方法[J]. 棉花学报, 2000, 12(4):205-207.
[6] 蒋建雄, 张天真.利用 CTAB/ 酸酚法提取棉花组织总RNA[J]. 棉花学报, 2003, 15(3): 166-167.
[7] 陈美霞, 陈富成, 颜克伟, 等.红麻叶片高质量RNA提取方法比较分析[J]. 福建农林大学学报:自然科学版, 2011, 40(6):561-565.
[8] 陈昆松, 徐昌杰, 张上隆.富含多糖猕猴桃果实组织中总 RNA 提取方法的改进[J].植物生理学通讯, 1998, 34(5):371-373.
[9] 山蓝, 王保莉, 张继澍. 从富含多糖和多酚的柿果中提取具转录活性 RNA 的方法[J].植物生理学通讯, 2002, 38(5): 463-464.
[10] 冯斗, 张春发, 张颖. 一种适用于提取香蕉果肉 RNA 的方法[J]. 广西农业生物科学, 2004, 23(3):249-251.
[11] 黄凤兰,李长海,孙婷婷,等.芍药花瓣总RNA的提取[J]. 生物技术通讯, 2005, 16(3):282-283.
[12] 张根良,王文泉.木薯总RNA提取初步研究[J]. 广西农业科学, 2008, 39(6):713-716.
[13] 杨峰, 李创, 刘艺平, 等.荷花花瓣总RNA的提取方法[J]. 河南科学,2009, 27(10):1 226-1 227.
[14] 何海旺, 徐春燕, 李文, 等. 玻璃粉吸附核酸及其在植物核酸提取中应用的研究[J]. 生物技术进展, 2012, 2(5):359-365.
[15] 陈晖, 何海福.植物组织总RNA提取方法的进展研究[J].甘肃农业,2006(8):226.
[16] 袁明珠, 温柔, 刘吉升, 等.几种植物材料中总 RNA的提取[J]. 分子植物育种, 2005, 3(2):285-292.
[17] 李宏, 王新力. 植物组织RNA提取的难点和对策[J].生物技术通报, 1999, 15(1):36-39.