植物液泡膜H+-Pyrophosphatase基因功能研究进展
2015-08-16张少英王晓娇
刘 雪,张少英,王晓娇
(内蒙古农业大学农学院,呼和浩特010019)
液泡膜质子焦磷酸酶(H+-pyrophosphatase,H+-PPase,EC3.6.1.1)是一种区别于 H+-ATPase(EC 3.6.1.3)的质子泵[1],是一类将质子转运与焦磷酸水解相耦联的焦磷酸酶.细胞的新陈代谢过程可产生大量的焦磷(diphosphate,PPi),细胞质中无焦磷酸酶(PPase),而在液泡膜上存在一种以PPi为水解底物的H+-PPase.H+-PPase利用PPi水解产生的能量,将H+由胞质泵入液泡中,与H+-ATPase共同执行质子泵的功能,如建立了跨液泡膜质子驱动力,催化各种矿质营养的主动运输[2],同时减少了PPi对细胞中生物大分子合成的影响.目前,已从多种植物中克隆获到液泡膜H+-PPase的cDNA,对其生理生化性质和功能也有了更深入了解.根据相关的研究方法,作者已经初步得到了AVP1超表达甜菜植株,并初步验证了转基因甜菜的抗旱性优于野生型.
本文主要介绍植物H+-PPase编码基因的家族及其相关功能,并对部分同源基因在不同植物上遗传转化体系的建立及其在植物细胞中超表达对干旱、盐等逆境胁迫的适应进行阐述.
1 液泡膜H+-PPase
1.1 液泡膜H+-PPase基因基本结构特征
液泡膜H+-PPase是一类与膜结合的不可溶酶类,广泛存在于植物中,少数存在于藻类、原生动物以及细菌中[3].1992 年,Sarafian 等[4]首次从拟南芥中筛选克隆出完整液泡膜H+-PPase基因AVP1(Arabidopsis vacuolar H+-pyrophosphatase,M81892).此后,相继从多种陆生植物中克隆出液泡膜H+-PPase完整的cDNA,如烟草、大麦、甜菜、南瓜、水稻、绿豆、野大麦、小麦、披碱草、盐地碱蓬、玉米[5]、陆地棉[6]、盐爪爪、盐芥、盐藻、百脉根[7]、截形苜蓿[8]、蓝桉[9]、小拟南芥[10]、梭梭[11]、费尔干猪毛菜[12]等(表 1).研究发现,大多数陆生植物液泡膜H+-PPase基因cDNA含有2 283~2 319个核苷酸,约编码761~773个氨基酸残基,蛋白结构相似,以二聚体存在[13].
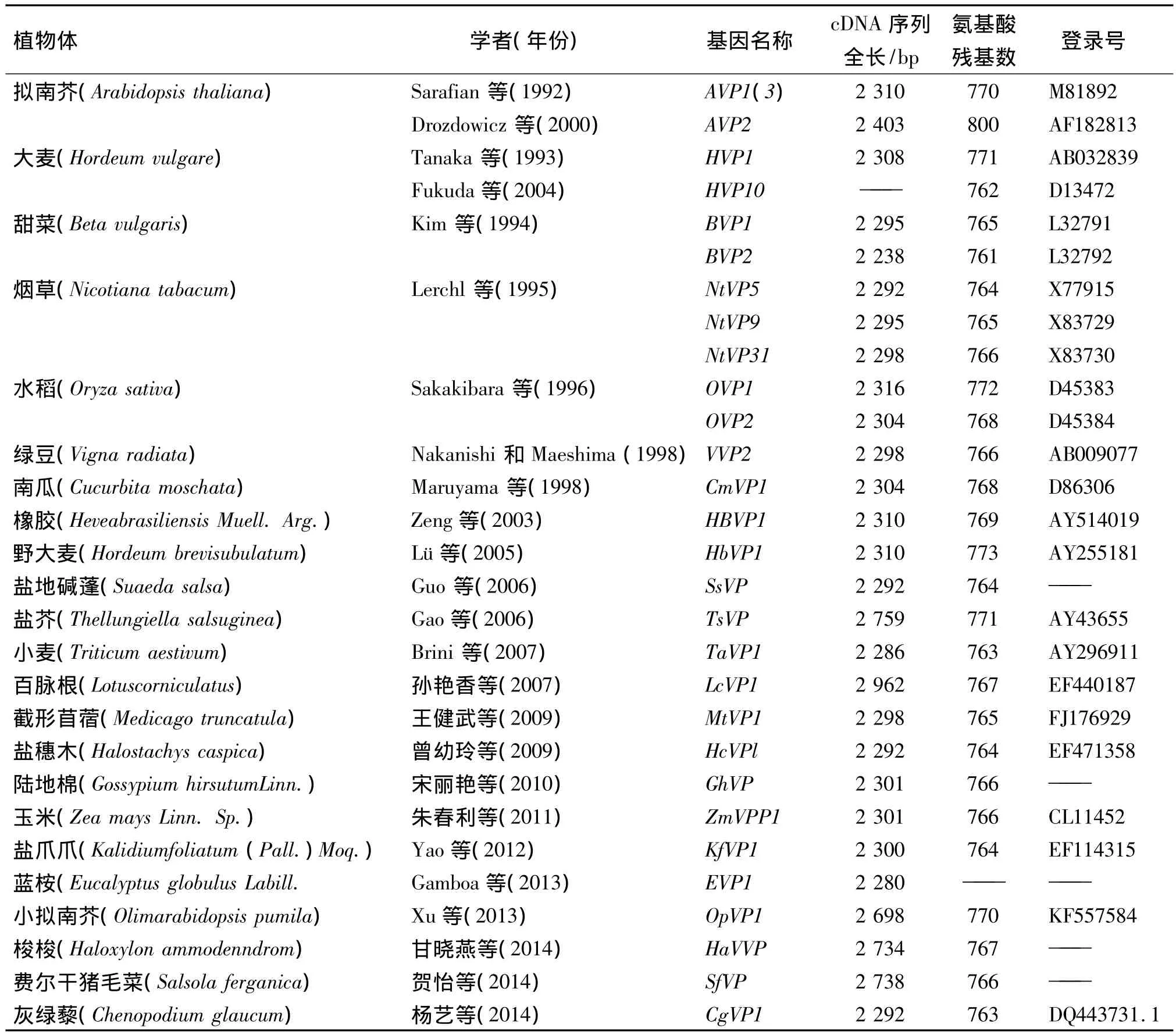
表1 已克隆的植物液泡膜H+-PPase cDNA文库Table 1 H+-PPase cDNA cloned from plants
对不同陆生植物拟南芥、烟草,大麦、甜菜、绿豆、水稻等具有的11个液泡膜H+-PPase氨基酸序列分析,发现序列高度同源性,达到86% ~96%[15].与之相比,陆生植物和藻类液泡膜H+-PPase氨基酸序列同源性较低.有些陆生植物中液泡膜H+-PPase具有多个同功酶,并在一些植物中克隆了编码液泡膜H+-PPase同源基因,如烟草中已经克隆出3个家族基因,水稻中有6个,大麦2个,甜菜中至少有2个[16].这些同源基因的开放阅读框架(ORF)高度保守,但非转录区的保守性很低[3].H+-PPase是一个多基因家族.
1.2 液泡膜H+-PPase的拓扑结构
Maeshima[3]在2000 年提出了液泡膜 H+-PPase的拓扑结构模型.在模型的一级结构中,液泡膜H+-PPase包括13个loops(a-m)(其中6个液泡环、7个胞质环),14个跨膜区域,同时具有3个高度保守区(CS1、CS2、CS3).CS1位于细胞质一侧亲水的 e环上,还存在与底物结合的部位(图1).对拟南芥、绿豆、轮藻、伞藻、光合细菌等5种生物的CS1、CS2、CS3序列比对发现,在CS1片段内有一段氨基酸序列,即DVGADLVGKVE(253~263)(图2下划线),具有高度保守特点.植物液泡膜H+-PPase序列中都含有CS1保守序列,因此,有学者猜想该位点可能是酶的催化位点[4].绿豆CS1序列的带电氨基酸残基 Asp-253、Glu-263和 Lys-261对液泡膜 H+-PPase活性的稳定性起到重要作用.同时发现CS2位于亲水的i环上,在拟南芥AVP1上,该序列的Glu-427被Gln替换后,导致依赖PPi的H+转运能力明显降低,说明CS2在质子转运中发挥作用.位于C末端的CS3包含12个带电氨基酸残基.分析绿豆液泡膜H+-PPase的CS3保守区,发现结构域中含有3个Glu残基,任何一个残基被替换都导致酶活性的丧失.在烟草、甜菜、大麦、水稻、南瓜中的氨基酸序列也同样具有保守性(图2).而液泡环和N 端不具有保守性[17].

图1 液泡膜H+-PPase的拓扑结构模式[3]Figure 1 Topologicalmodel of H+-PPase from mung bean[3]
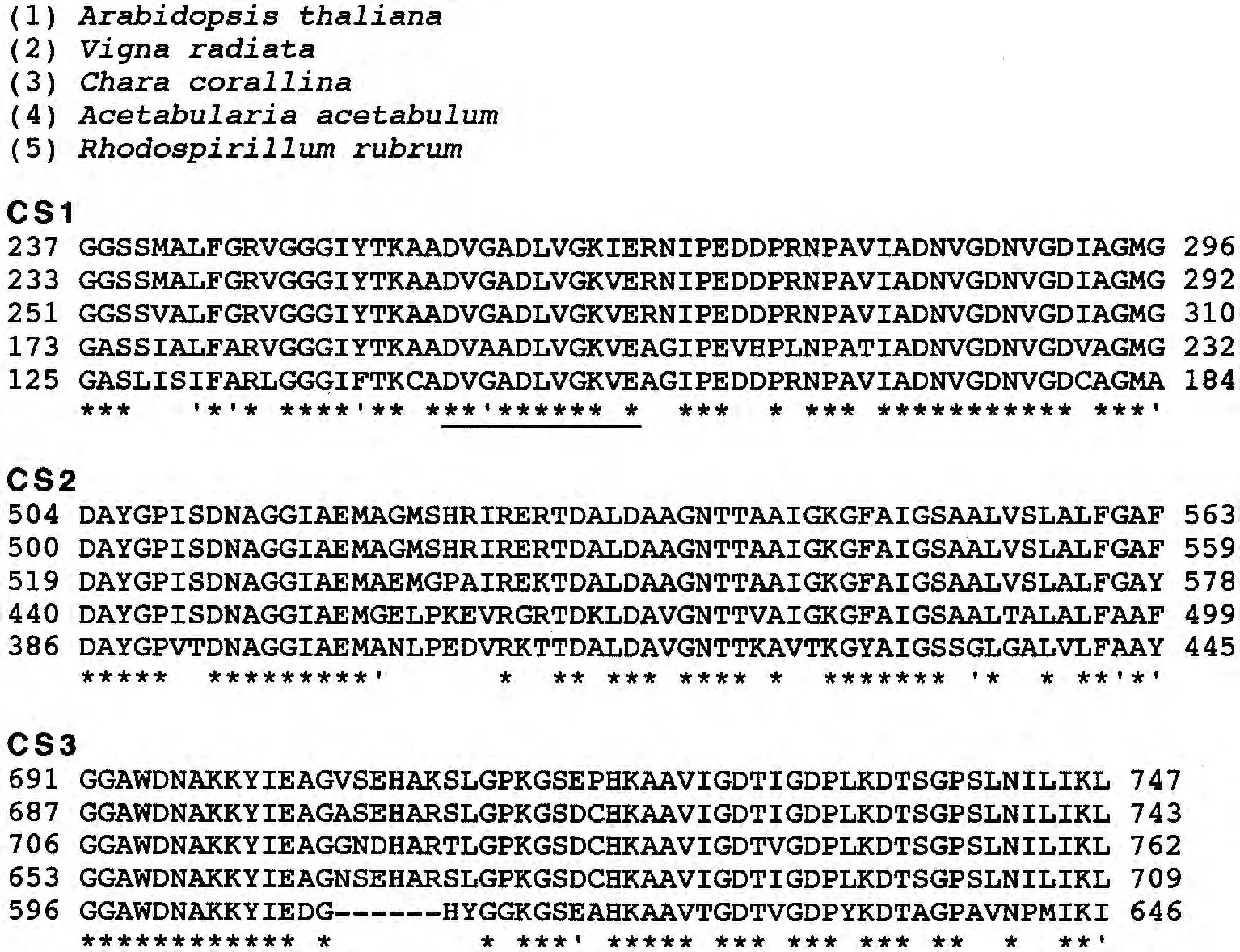
图2 2种植物和3种其他生物液泡膜H+-PPase的高度保守序列对比[3]Figure 2 Alignment of H+-PPase segments containing the highly conserved motif from two plants and three other organisms[3]
在液泡膜H+-PPase中,还包含H+-ATPase家族具有的保守结构域,例如在CS1中出现的DDPR和VGDN序列以及在CS3中出现的GDTIGD序列,表明CS3与CS1、CS2共同在H+-PPase酶的催化功能中起重要作用.保守结构域 DDPR、VGDN和GDTIGD可能共同构成V-PPase的催化核心区域[3].
1.3 液泡膜H+-PPase的生化性质
研究[18]发现,Mg2+对液泡膜 H+-PPase不仅具有激活作用,还能保护其免受热失活,是一个必要的辅助因子.Rea等[19]提出在植物细胞质中,Mg2+的浓度可能是控制H+-PPase活性的一个重要因素,Ca2+调节此酶的活性.在有些植物中,此酶的活性不同程度地受到 K+影响[20].Drozdowicz等[21]发现了一种不同于 AVP1的液泡膜 H+-PPase,并命名为AVP2,同样受到Mg2+的激活作用,但对K+不敏感,对Ca2+比较敏感,同时序列分析显示AVP1和AVP2的同源性很低,仅有36%.因此,学者依据系统分类,将植物体中存在的H+-PPase分为2种类型,分别是Ⅰ型和Ⅱ型,其中Ⅰ型是以AVP1为代表的K+激活型,对Ca2+的抑制敏感度低,主要定位在液泡膜上,而Ⅱ型是以AVP2为代表的 K+迟钝型,对Ca2+的抑制敏感度高,定位在高尔基体膜上[22],初步证实了液泡膜H+-PPase活性受到K+和Ca2+的影响.另外在有些植物中,还有其他离子对H+-PPase的活性有一定的作用.
Zhen等[23]提出氨基亚甲基二膦酸盐(Aminomethylene-bisphosphonate)是一种H+-PPase活性抑制剂,并且对绿豆的H+-PPase抑制常数很明显,约为1.8μmol/L.这种抑制剂不仅作用于所有的植物H+-PPase和光合细菌的PPi合酶,还作用于鼠类肝脏细胞和酵母菌中的V-ATP酶、细胞质可溶性焦磷酸酶等.Gordon-Weeks等[24]提出在双膦酸盐碳链上的氮原子可以提高V-ATPase的抑制效果.
2 液泡膜H+-PPase的功能
2.1 质子泵功能
在植物生长过程中,大分子物质如RNA、蛋白质、糖类、脂类等的生物合成过程都会产生大量的PPi,高浓度PPi会抑制植物的正常代谢,影响植物的生长发育.液泡膜H+-ATPase和H+-PPase均能够水解PPi,产生的能量催化H+从胞质跨膜转运到液泡中.同时泵入液泡的大量H+形成跨膜电化学梯度,一方面,为各种溶质分子跨液泡膜主动运输提供驱动力[2],维持细胞离子平衡和渗透平衡,调节植物体的pH值,减少对植物的伤害;另一方面,可使液泡酸化和细胞质碱化,有利于细胞中各种生理生化反应的进行[14].
2.2 影响植物生长发育
Li等[25]发现拟南芥超表达AVP1使植物器官形成初期的细胞分裂加快、增生加快、根系发达、生长素转运蛋白数目增加;而avp1缺失突变体子叶畸形,其地上部和根发育均受到抑制,大多数植株的花芽分化和生殖器官的形成受到影响,导致不能有性结实,生长素分布发生变化,生长素运输效率降低.Feriani等[26]分离到一个子叶生长有缺陷的拟南芥突变体fugu5,与突变体 avp1相似,对液泡膜H+-PPase与植物生长素调节器官之间的关系进行了进一步的研究,发现avp1突变体生长受到抑制是对高浓度生长激素的应答反应,证明植物液泡膜H+-PPase对植物生长激素没有控制运输的作用.液泡膜H+-PPase和生长激素的运输的关系还有待进一步研究.
在缺乏AVP1基因的拟南芥植株体内中积累了大量的PPi,导致植株糖异生过程无法正常进行,在种子萌发后不能正常生长[27].将AVP1超表达烟草,植株的叶片大小以及质量明显提高,说明植物中液泡膜H+-PPase对植物生长发育有重要作用.
2.3 增强植物抗逆性
为了减轻盐分过高对植物造成生理干旱,植物细胞主要依靠离子区域化的方法,通过液泡膜Na+/H+逆向转运蛋白将细胞质中过多的Na+和Cl-区隔在液泡中,以此来减轻其对细胞质的毒害作用[28].在离子区域化过程中,液泡膜质子泵(H+-ATPase和H+-PPase)为液泡膜Na+/H+逆向转运蛋白提供区隔Na+和Cl-的驱动力.由此认为提高液泡膜质子泵基因的表达,可以增大H+的跨膜梯度,为Na+/H+交换提供更大的驱动力,使过多的Na+区域化,从而使植物细胞的耐盐性和抗旱性增强.与液泡膜H+-ATPase相比,液泡膜H+-PPase的结构简单,只是一条由单一基因编码的多肽链组成,更容易实现超表达[29].
Gaxiola等[29]用拟南芥液泡膜 H+-PPase基因AVP1过量表达编码液泡膜H+-PPase蛋白,提高转基因植物对盐碱及干旱的耐受性.为了验证此基因在不同物种中的作用.Gao等[30]发现在转基因烟草中表达AVP1同源基因,可以提高转基因植物根的发育,并增强植物耐盐性.Lv等[31]研究棉花中AVP1同源基因表达时发现,转基因棉花根的发育以及对盐的耐受力均有提高;该基因的表达可以提高棉花对干旱的耐受力.胡有贞等[32]通过农杆菌浸染花序的方法将灰绿藜液泡膜H+-PPase基因(CgVP1)导入拟南芥,能显著提高其耐盐能力.在2011年,Pasapula等[33]再次证实了在 200 mmol/L NaCl水培或土培条件下,转AVP1基因棉花比野生型植株对干旱和盐胁迫具有更强的耐受性.2012年Yao等从盐生植物盐爪爪中得到的KfVP1,2013年Gamboa等[9]从蓝桉中分离出的EVP1等,实验结果都表明了液泡膜H+-PPase在植物响应逆境胁迫(干旱和盐胁迫)中起到重要作用.
2.4 参与蔗糖的生物合成
Lerchl等[34]发现,植物体内的蔗糖合成酶和尿苷二磷酸葡萄糖焦磷酸化酶共同作用,将蔗糖转化为葡萄糖和己糖磷酸盐.植物液泡膜H+-PPase清除此过程中产生的大量PPi.在缺乏磷素的条件下,转H+-PPase基因玉米的根系比野生型植株更发达[35].
3 液泡膜H+-PPase基因的遗传转化
有关H+-PPase基因在植物中的遗传转化方面的研究才十几年的时间,但取得了很大的进展.目前研究主要集中在拟南芥AVP1的遗传转化方面.
Gaxiola等[29]在2001年首次将 AVP1基因转入拟南芥中,结果发现,在250 mmol/L NaCl的条件下,超表达AVP1植株能正常生长,叶面积和鲜质量显著增加,其抗盐性增强,同时转基因植株幼苗中AVP1蛋白水平显著高于野生型.此后,该家族基因常被用于植物耐盐抗旱能力的改造.2005年,Park等[36]将AVP1基因转入番茄中,结果显示转基因植株的根系生长较快且发达,生物量增加显著,其抗旱性也增强.2006年,Zhao等[37]将盐地碱蓬中的Na+/H+逆向转运蛋白基因SsNHX1和拟南芥中的AVP1基因同时转入水稻中,共同超表达对水稻耐盐性效果好于单基因超表达.Brini等[38]发现小麦H+-PPase基因TVP1在拟南芥中超表达可以增强其耐盐性和抗旱性.同时,Yang等[39]的研究结果表明,AVP1基因在水稻、拟南芥、烟草中的超表达都促进了转基因植株根系吸收K+和释放有机酸,使其在低磷条件下可以吸收更多的磷,促使其更好的生长.在2008年,Lv和Li等分别证明了盐芥H+-PPase基因 TsVP1 在棉花[31]和玉米[40]中超表达后提高了转基因植株的耐盐性和抗旱性.
将 AVP1 基因转入紫花苜蓿[41]、百脉根[42]、甜菜[43]、多花黑麦草[44]、匍匐翦股颖[45]等,实现超表达,转基因植株比野生型植株具有较强的抗旱性和耐盐性.Xu等[10]将小拟南芥H+-PPase基因OpVP转入烟草中,转基因植株同样表现出较高的耐盐性.该家族基因不仅可以改善受体植物的抗旱、耐盐性,还改变了其形态结构,根系生长能力增强、叶面积增大、籽粒产量增加和棉花纤维产量提高等.本课题组已经获得转AVP1基因的甜菜株系,在甜菜中过量表达对甜菜磷素吸收和提高抗旱耐盐性具有积极作用.相关机能正在探讨中.
除了植物中的H+-PPase基因能提高转基因植株的抗旱性和耐盐性,D'yakova等[46]报道了光合细菌H+-PPase基因在烟草中超表达也可以提高其耐盐性.
研究表明液泡膜H+-PPase在植物的耐盐抗旱性中起重要作用.液泡膜H+-PPase基因的超表达可以明显提高转基因植株的耐盐抗旱性,将H+-PPase基因转入植物中,可以获得耐盐性和抗旱性较强的转基因植物新品种,该基因的广泛利用为增强植物抗性、提高作物产量提供新的思路和途径,具有应用前景.
[1]赵利辉,刘友良.液泡膜H+-PPase及其对逆境胁迫的反应[J].植物生理学通讯,1999,35(6):441-446.Zhao L H,Liu Y L.Tonoplast H+-pyrophosphatase and its response to stresses[J].Plant Physiology Journal,1999,35(6):441-446.
[2]Lin SM,Tsai JY,Hsiao CD,etal.Crystal structure of amembrane-embedded H+-translocating pyrophosphatase[J].Nature,2012,484(7394):399-403.
[3]Maeshima M.Vacuolar H+-pyrophosphatase[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2000,1465(1):37-51.
[4]朱昀,李朝炜,魏景芳.植物液泡膜质子转运焦磷酸酶研究进展[J].河北师范大学学报:自然科学版,2013,37(6):639-643.Zhu Y,Li ZW,Wei J F.Advances of the research on vacuolar H+-pyrophosphatase in plants[J].Journal of Hebei Normal University:Natural Science,2013,37(6):639-643.
[5]朱春利,张登峰,刘颖慧,等.玉米液泡膜焦磷酸酶基因ZmVPP1的克隆及逆境下的表达分析[J].植物遗传资源学报,2011,12(1):107-112.Zhu C L,Zhang D F,Liu Y H,et al.Cloning and expression analysis of ZmVPP1 under stresses in Maize(Zeamays L.)[J].Journal of Plant Genetic Resources,2011,12(1):107-112.
[6]宋丽艳.陆地棉耐盐相关基GhVP的克隆与分析[J].棉花学报,2010,22(3):285-288.Song L Y.Isolation and analysis of salt tolerance related gene(GhVP)from Gossypium hirsutum L.[J].Cotton Science,2010,22(3):285-288.
[7]孙艳香,王勇.百脉根液泡膜 H+-PPase基因cDNA克隆与分析[J].植物生理学通讯,2007,43(4):657-663.Sun Y X,Wang Y.Cloning and analysis of cDNA encoding a tonoplast H+-PPase from Lotus corniculatus L.[J].Plant Physiology Journal,2007,43(4):657-663.
[8]王建武,沈裕虎,王海庆,等.截形苜蓿液泡膜 H+-PPase基因克隆与序列分析[J].西北植物学报,2009,29(3):0435-0442.Wang JW,Shen Y H,Wang H Q.Cloning and characterization of a vacuolar H+-PPase gene from Medicago truncatula[J].Acta Botanica Boreali-Occidentalia Sinica,2009,29(3):435-442.
[9]Gamboa M C,Baltierra F,Leon G,et al.Drought and salt tolerance enhancement of transgenic Arabidops is by overexpression of the vacuolar pyrophosphatase 1(EVP1)gene from Eucalyptus globulus[J].Plant Physiology and Biochemistry,2013,73:99-105.
[10]Xu F,Zhao Y X,Wei F,et al.Cloning of a vacuolar H+-pryophosphatase gene from emphemeral plant Olimarabidopsis pumila whose overexpression improve salt tolerance in tobacco[J].African Journal of Biotechnology,2013,12(49):6817-6825.
[11]甘晓燕,巩檑,宋玉霞,等.梭梭液泡膜焦磷酸酶HaVVP基因克隆及序列分析[J].西北农业学报,2014,23(11):198-203.Gan X Y,Gong L,Song Y X,et al.Cloning and sequence analysis of a cDNA encoding vacuolar H+-PPase gene from Haloxylon ammodendron[J].Acta Agriculturae Boreali-Occidentalia Sinica,2014,23(11):198-203.
[12]贺怡,钱雯婕,李鸿彬.费尔干猪毛菜液泡膜氢离子焦磷酸酶基因SfVP的克隆、序列分析及表达[J].石河子大学学报:自然科学版,2014,32(3):319-324.He Y,Qian W J,LiH B.Cloning and expression analysis of vacuolar H+-PPase gene SfVP from Salsola ferganica[J].Journal of Shihezi University:Natural Science,2014,32(3):319-324.
[13]Baltscheffsky M,Nadanaciva S,Schultz A.A pyrophosphate synthase gene:Molecular cloning and sequencing of the cDNA encoding the inorganic pyrophosphate synthase from Rhodospirillum rubrum[J].Biochimica et Biophysica Acta(BBA)-Bioenergetics,1998,1364(3):301-306.
[14]包爱科,王锁民.超表达植物 H+-PPase基因提高紫花苜蓿的抗逆性[C/OL]∥第三届中国苜蓿发展大会论文集,2010:227-236.http:∥www.doc88.com/p-239796062523.html.Bao A K,Wang S M.Overexpression of H+-pyrophosphatase enhanced tolerance of transgenic Medicago sativa L.[C/OL]∥The third China national alfalfa industry development conference,2010:227-236.http:∥www.doc88.com/p-239796062523.html.
[15]Nakanishi Y,Maeshima M.Molecular cloning of vacuolar H+-pyrophosphatase and its developmental expression in growing hypocotyl of mung bean[J].Plant Physiology,1998,116(2):589-597.
[16]Wang Y Z,Xu H B,Ma ZQ,et al.Expression and responses to dehydration and salinity stresses of V-PPase genemembers in wheat[J].Genetics,2009,36:711-720.
[17]McIntosh M T,Vaidya A B.Vacuolar type H+-pumping pyrophosphatases of parasitic protozoa[J].International Journal for Parasitology,2002,32(1):1-14.
[18]Gordon-Weeks R,Steele S H,Leigh R A.The role of magnesium,pyrophosphate,and their complexes as substrates and activators of the vacuolar H+-pumping inorganic pyrophosphatase(studies using ligand protection from covalent inhibitors)[J].Plant Physiology,1996,111(1):195-202.
[19]Baykov A A,Bakuleva N P,Rea P A.Steady-state kinetics of substrate hydrolysis by vacuolar H+-pyrophosphatase[J].European Journal of Biochemistry,1993,217(2):755-762.
[20]Pugliarello M C,Rasi-Caldogno F,De Michelis M I,et al.The tonoplast H+-pyrophosphatase of radish seedlings:Biochemical characteristics[J].Physiologia Plantarum,1991,83(3):339-345.
[21]Drozdowicz Y M,Kissinger JC,Rea P A.AVP2,a Sequence divergent K+insensitive H+translocating inor—ganic pyrophosphatase from Arabidopsis[J].Plant Physiology,2000,123:353-362.
[22]Serrano A,Pérez-Castiñeira JR,Baltscheffsky M,et al.H+-PPases:Yesterday,today and tomorrow[J].IUBMB Life,2007,59(2):76-83.
[23]Zhen R G,Baykov A A,Bakuleva N P,et al.Aminomethylene diphosphonate:A potent type-specific inhibitor of both plant and phototrophic bacterial H+-pyrophosphatases[J].Plant Physiology,1994,104(1):153-159.
[24]Gordon-Weeks R,Parmar S,Davies T,et al.Structural aspects of the effectiveness ofbisphosphonates as competitive inhibitors of the plant vacuolar proton-pumping pyrophosphatase[J].Biochemical Journal,1999,337:373-377.
[25]Li J,Yang H,Peer W A,et al.Arabidopsis H+-PPase AVP1 regulates auxin-mediated organ development[J].Science,2005,310(5745):121-125.
[26]Ferjani A,Segami S,HoriguchiG,et al.Keep an eye on PPi:The vacuolar-type H+-pyrophosphatase regulates postgerminative development in Arabidopsis[J].The Plant Cell Online,2011,23(8):2895-2908.
[27]Arif A,Zafar Y,Arif M,et al.Improved growth,drought tolerance,and ultrastructural evidence of increased turgidity in tobacco plants overexpressing Arabidopsis Vacuolar Pyrophosphatase(AVP1)[J].Molecular Biotechnology,2013,54(2):379-392.
[28]Niu X,Bressan R A,Hasegawa PM,et al.Ion homeostasis in NaCl stress environments[J].Plant Physiology,1995,109(3):735-742.
[29]Gaxiola R A,Li J,Undurraga S,etal.Drought-and salttolerant plants result from overexpression of the AVP1 H+-pump[J].Proceedings of the National Academy of Sciences of the United States of the United States of A-merica,2001,98(20):11444-11449.
[30]Gao F,Gao Q,Duan X G,et al.Cloning of an H+-PPase gene from Thellungiella halophila and its heterologous expression to improve tobacco salt tolerance[J].Journal of Experimental Botany,2006,57(12):3259-3270.
[31]Lv S,Zhang K,Gao Q,etal.Overexpression of an H+-PPase gene from Thellungiella halophila in cotton enhances salt tolerance and improves growth and photosynthetic performance[J].Plantand Cell Physiology,2008,49(8):1150-1164.
[32]胡有贞,王瑜,张富春.灰绿藜液泡膜焦磷酸酶基因(CgVP1)过表达提高拟南芥的耐盐性[J].植物生理学通讯,2009(5):449-454.Hu Y Z,Wang Y,Zhang F C.Overexpression of Chenopodium glaucum tonoplast pyrophosphatase(CgVP1)improves salt tolerance in Arabidopsis thaliana[J].Plant Physiology Journal,2009(5):449-454.
[33]Pasapula V,Shen G,Kuppu S,et al.Expression of an Arabidopsis vacuolar H+-pyrophosphatase gene(AVP1)in cotton improves drought-and salt tolerance and increases fibre yield in the field conditions[J].Plant Biotechnology Journal,2011,9(1):88-99.
[34]Lerchl J,Geigenberger P,Stitt M,et al.Impaired photoassi milate partitioning caused by phloem-specific removal of pyrophosphate can be complemented by a phloemspecific cytosolic yeast-derived invertase in transgenic plants[J].The Plant Cell,1995,7(3):259-270.
[35]Pei L,Wang J,Li K,et al.Overexpression of Thellungiella halophila H+-pyrophosphatase gene improves low phosphate tolerance in maize[J].PLoS One,2012,7(8):e43501.
[36]Park S,Li J,Pittman JK,et al.Up-regulation of a H+-pyrophosphatase(H+-PPase)as a strategy to engineer drought-resistant crop plants[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(52):18830-18835.
[37]Zhao F Y,Zhang X J,Li P H,et al.Co-expression of the Suaeda salsa SsNHX1 and Arabidopsis AVP1 confer greater salt tolerance to transgenic rice than the single SsNHX1[J].Molecular Breeding,2006,17(4):341-353.
[38]Brini F,Hanin M,Mezghani I,et al.Overexpression of wheat Na+/H+antiporter TNHX1 and H+-pyrophosphatase TVP1 improve salt-and drought-stress tolerance in Arabidopsis thaliana plants[J].Journal of Experimental Botany,2007,58(2):301-308.
[39]Yang H,Knapp J,Koirala P,etal.Enhanced phosphorus nutrition in monocots and dicots over-expressing a phosphorus-responsive type I H+-pyrophosphatase[J].Plant Biotechnology Journal,2007,5(6):735-745.
[40]Li B,Wei A,Song C,et al.Heterologous expression of the TsVP gene improves the drought resistance of maize[J].Plant Biotechnology Journal,2008,6(2):146-159.
[41]包爱科.拟南芥液泡膜 H+-焦磷酸酶基因AVP1改良紫花苜蓿 (Medicago sativaL)抗逆性的研究[D].兰州:兰州大学,2009.Bao A K.Improved the stress tolerance in Alfalfa through introducing an Tonoplast H+-pyrophosphatase Gene AVP1 from Arabidopsis Thaliana[D].Lanzhou:Lanzhou University,2009.
[42]程星,王燕雯,包爱科,等.超表达AVP1基因提高转基因百脉根的耐盐性和抗旱性[J].植物生理学通讯,2010(8):808-816.Cheng X,Wang Y W,Bao A K,et al.Overexpression of AVP1 enhanced salt and drought tolerance of transgenic Lotus corniculatus L.[J].Plant Physiology Journal,2010(8):808-816.
[43]王晓娇,孙亚卿,张少英,等.农杆菌介导 AVP1基因转化甜菜[J].分子植物育种,2011,9(3):370-375.Wang X J,Sun Y Q,Zhang S Y,et al.Agrobacteriummediated transformation of sugar beet with vacuolar H+-PPase(AVP1)gene[J].Molecular Plant Breeding,2011,9(3):370-375.
[44]刘占彬.农杆菌介导的AVP1基因转化多花黑麦草的初步研究[D].北京:中国农业科学院,2009.Liu Z B.Study on Italian Ryegrass Transformation of AVP1 Gene Mediated by Agrobacterium Tumefaciens[D].Beijing:Chinese Academy of Agricultural Sciences,2009.
[45]吴琼.农杆菌介导rd29A启动子驱动AVP1基因转化匍匐翦股颖的研究[D].杭州:浙江大学,2007.Wu Q.Study on transformation of creeping bentgrasswith AVP1 gene driven by rd29A promoter[D].Hangzhou:Zhejiang University,2007.
[46]D’yakova E V,Rakitin A L,Kamionskaya A M,et al.A study of the effect of expression of the gene encoding the membrane H+-pyrophosphatase of Rhodospirillum rubrum on salt resistance of transgenic tobacco plants[J].Doklady Biological Sciences,2006,409(1):346-348.
