环介导等温扩增技术检测福氏志贺菌的实验研究
2015-07-31彭丁晋
彭丁晋
环介导等温扩增技术检测福氏志贺菌的实验研究
彭丁晋
目的 了解并建立福氏志贺菌的快速、特异的环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)检测方法,探讨快速、简便、有效的消化道传播性病原体的临床诊断、饮水检测和环境卫生监测等检测手段。方法 对福氏志贺菌进行细菌培养,然后使用聚合酶链反应(polymerase chain reaction,PCR)和LAMP技术设计4条特异性引物,以及使用克隆等分子生物学方法进行DNA提取,然后对PCR方法与LAMP方法进行对比分析。结果LAMP扩增具有非常高的特异性,几乎不会产生非特异性扩增;与PCR方法相比,LAMP检测限更低,仅为5个拷贝;LAMP在等温条件下扩增,不会因温度改变而造成时间的损失,在1h内可将靶序列扩增至109~1010倍,并且不需要模板的热变性。结论 LAMP技术具有特异敏感简单的特点,不需要特殊的仪器,在65℃时1h即可完成反应,同时检测结果可直接通过肉眼或加入荧光染料即可判断。
环介导等温扩增技术;福氏志贺菌;聚合酶链反应;检测;实验研究
志贺菌属是主要的肠道病原菌之一,在伯杰手册(1984)中分为4个群(种):痢疾志贺菌、福氏志贺菌、鲍氏志贺菌和宋氏志贺菌。志贺菌感染引起的细菌性痢疾是我国主要的肠道传染病之一,是世界上,尤其是发展中国家重要的公共卫生问题。为此,为了探寻相关疾病诊断、食品卫生监测及传染病防控等的方便,本研究对我国比较常见的福氏志贺菌进行实验研究,探讨了快速、简便、有效的消化道传播性病原体的临床诊断、饮水检测和环境卫生监测等检测手段,具体报道如下。
1 资料与方法
1.1 一般资料 菌种包括:弓形虫(Toxoplasma gondii)、肠出血型大肠杆菌(Enterohehemorrhagic Escherichia coli) O157:H7、福氏志贺菌、霍乱弧菌(V.cholera)、副溶血性弧菌(V. parahaemolyticus)、轮状病毒(Rotavirus)G3型及Norwalk病毒(Norovirus)GII型。
1.2 试剂与仪器 实验设备包括:电子分析天平、低温冰箱、常规显微镜、荧光显微镜、CO2培养箱、聚合酶链反应仪、电泳仪等。培养基包括:营养琼脂,营养肉汤,LB琼脂平板。试剂包括:FTA缓冲液及Filter,TE缓冲液,TAE缓冲液,琼脂糖凝胶,PCR反应试剂,Bst DNA聚合酶,引物,24∶1的氯仿异戊醇,25∶24∶1的酚氯仿异戊醇,70%的乙醇,异丙醇,浓度为5mol/L的氯化钠,10%的十二烷基硫酸钠(sodium dodecyl sulfate,sodium salt,SDS),氨水,石油醚,无水乙醇,氯仿,裂解液,限制性核酸内切酶等。
1.3 方法 所有方法流程为:相关病原体待扩增靶基因的选取→利用环介导等温扩增(loop-mediated isothermal amplification,LAMP),专用引物软件设计4条常规引物→相关病原体的准备及基因组DNA的提取→LAMP扩增反应条件的优化和建立→LAMP法与PCR比较(包括酶切鉴定和测序鉴定)→数据统计分析。菌种培养方法:使用平板划线法在营养琼脂平板培养基中将储存好的福氏志贺菌进行单菌落分离,然后将其放进37℃的恒温环境中培养进行12h的倒置培养。然后再将单菌落样品与3mL液体培养基进行接种,并放在37℃的恒温环境中培养12h。然后再将培养好的样品与120mL相同的液体培养基进行接种,并放在37℃的恒温环境中培养12h,然后在4℃环境中保存备用。
福氏志贺菌基因组提取方法:先在1.5mL的离心管中放入
1mL培养液离心1min,离心率为11000转/min。然后去掉上清液。然后使用灭菌纯水对菌体进行清洗,进而沉淀,反复2次。然后加入裂解液50μL,并在37℃的恒定环境中放置10min。然后再加三蒸水100μL进行悬浮,并进行煮沸,持续10min,然后使用离心试管离心1min,离心率为11000转/min,再去上清液以备用。
引物制定和测试方法为:(1)目的基因的选取,登陆Genbank查询目的基因序列,利用LAMP专用软件设计4条特异性引物;(2)相关病原体的准备和基因组DNA的提取,并用PCR鉴定;(3)LAMP扩增反应条件的优化和建立;(4)LAMP与PCR的敏感性和特异性的比较;(5)酶切鉴定LAMP产物;(6)测序鉴定LAMP产物。
2 结果
2.1 LAMP检测方法的建立 采用设计的针对ipaH基因的LAMP引物对福氏志贺菌标准菌株ATCC 12022DNA模板进行扩增,电泳结果显示在凝胶上出现典型的LAMP反应梯形电泳条带,阴性对照无条带,表明扩增结果为阳性,结果真实可信。肉眼观察反应管,发现阳性反应管中液体出现少量混浊,离心可见白色沉淀,而阴性对照管中无变化。分别加入1μL荧光染料1000×SYBR GREEN I,发现阳性反应管中液体变绿色,而阴性对照管呈现橙色。见图1~图3。
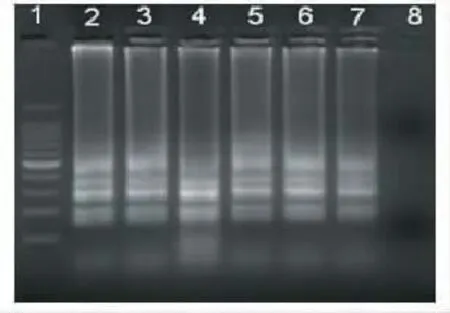
图1 志贺菌LAMP检测电泳结果
图2 志贺菌LAMP检测浊度结果
图3 志贺菌LAMP 检测荧光染料分析结果
2.2 特异性 采用优化的LAMP反应体系扩增,同时对所有收集到的验证菌株开展LAMP引物特异性验证,部分验证结果见图4。结果显示目标菌均可被检出,其它非目标菌均未见扩增,表明所设计引物特异性强,反应体系适宜。
2.3 灵敏度 经平板计数法算出志贺菌原始菌浓度为6.1×106cfu/mL,比较目标菌的LAMP和PCR检测灵敏度,结果见图5。LAMP和PCR检测灵敏度分别为:6.1×101cfu/ mL和6.1×102cfu/mL,LAMP比PCR灵敏度高1个数量级。
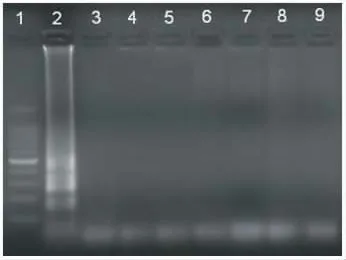
图4 志贺菌LAMP 特异性验证结果
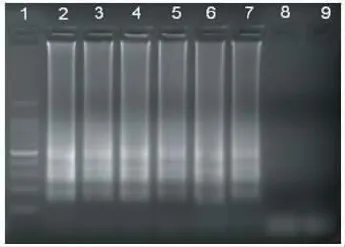

图5 志贺菌LAMP和PCR灵敏度结果
3 讨论
在我国以福氏引起的菌痢较为多见。目前,我国福氏志贺菌的诊断仍主要依靠传统的检测方法,已不能满足疾病早期检测的需要[1-2]。近年来,不断发展的免疫荧光技术、酶联免疫技术、放射免疫技术等免疫学方法已逐步应用于病原体的检测,但仍存在操作繁琐、敏感性偏低等问题[3]。各式PCR方法敏感、准确、快速,可替代病原学检测,但需要昂贵的仪器设备、较高检测费用以及对检测人员较高的技术要求而使其不能用于病原体现场快速检测和基层普及应用。因此,建立特异、便捷的检测方法对病原体的早期诊断和疾病控制都具有非常重要的意义[4-5]。LAMP技术是一种新型等温核酸扩增方法,针对靶基因的6个位点设计4条LAMP引物,利用一种具有链置换活性的DNA聚合酶(Bst DNA聚合酶),在恒温条件(65℃左右)保温约60min,即可完成核酸扩增反应,反应速度还可通过设计2条环引物使其增加1/2~1/3,由于LAMP引物的设计针对靶基因的位点比PCR多,故比PCR特异性更强,另外LAMP反应能产生大量的副产物-焦磷酸镁离子,在反应管中形成白色混浊,结果可通过肉眼或者浊度计对扩增副产物焦磷酸镁沉淀的浊度进行判定;也可用结合双链DNA的荧光染料SYBR Green I染色,在紫外灯下或日光下通过肉眼进行判定,如果含有扩增产物,反应混合物变绿;反之,则保持 SYBR Green I 的橙色不变。通过逆转录酶,还可进行RT-LAMP而完成针对RNA的扩增。该技术具有不需要PCR仪、肉眼可判断结果及反应时间短等优点,目前已有成功用于病原体检测的报道[6-7]。
从本研究来看,LAMP技术具有以下4个优点:(1)特异性强:4条引物对靶序列的6个特异序列区的识别,保证了LAMP扩增的高度特异性,几乎不会产生非特异性扩增。(2)敏感性高:与PCR相比,其检测限更低,仅为5个拷贝。(3)等温高效:LAMP在等温条件下扩增,不会因温度改变而造成时间的损失,在1h内可将靶序列扩增至109~1010倍,且不需要模板的热变性。(4)操作简便:反应不需PCR仪和特殊试剂;产物检测不需繁琐的电泳,肉眼即可判定。通过逆转录酶,LAMP还能进行RNA高效扩增。总之,该技术具有特异、敏感、不需要PCR仪、肉眼可判断结果及反应时间短等优点。
从检测的敏感度和准确度来讲,其对DNA模板的纯度的依赖非常大,同时模板上DNA的量也是影响检测敏感度和准确度的重要因素。本研究使用了FTA滤膜,使得在测量菌悬液的浓度时,测量的数值可以高达62cfu/mL,远远高于文献报道的最高值1062cfu/ mL[7]。虽然普通裂解法跟FTA提取法一样,都具有操作容易、检测时间短的优点。但是,普通热裂解容易导致模板出错,从而可能延迟时间。而传统的试剂盒法、饱和酚法、热裂解法的检测时间都比较长,而FTA法则兼具操作简单和检测时间短的优点,遂为实验室广泛采用的方法。而在实际的检测过程中,由于检测品都含有大量的淀粉、脂肪、金属离子、胶原蛋白及相关的蛋白质,因此会影响致病菌检测的灵敏度。而使用FTA滤膜,则可以完全避免其影响,其对DNA的吸附完全可以抵消上述因素的影响,故而其灵敏度比较高,同时操作也比较简单,比较利于现实的食品安全检测。
在实验过程中,靶基因的选择是保证实验检测特异度的关键。一般来讲都是选择检测特异性比较好的保守的基因作为靶基因,并以此设计好相应的引物,这是保证本实验高特异性的关键步骤。对于福氏志贺菌的研究,研究者对于引物的选择差异比较大,因此也决定了研究结果的天差万别[8-9]。但总体来讲,选择引物的原则是:选择基因的保守区,同时优先选择发夹型的结构,经过严格的NCBI比对,对那些碱基互补良好,Tm值比较适中,而且G+C%的含量比较符合的基因进行优先考虑。唯有如此,才能真正保证现实检测的特异度。可见,引物的选择是决定LAMP法能否成果的关键。在整个检测过程中,扩增温度的优化、体系的配置以及引物浓度的配置都是非常重要的。通过本实验结果来看,最佳的扩增温度为65℃。LAMP法操作简单、特异度高,使用PCR法其测试的成本非常高,而且操作不易,敏感度和特异度不能与LAMP法相比较。但是,LAMP法也有其缺点,主要是因为LAMP法的反应体系不太稳定,因此需要进行扩增4个引物,其与酶共同进行反应测试才可以得到比较好的结果[10]。因此,对于LAMP法的研究还需要持续,对不同的反应体系进行测试,以酶切反应的结果进行校准,从而达到优化体系的目的。虽然LAMP法有这一缺点,但由于其操作简单、时间短的优点,因此临床开发的价值非常大。
而且,本研究建立了人乳福氏志贺菌的快速、特异的LAMP检测方法,优化反应条件研制出相应病原体的现场快速检测试剂盒。相信这样的试剂盒开发,将会有非常的实际应用价值。总而言之,LAMP技术具有特异敏感简单的特点,不需要特殊的仪器,在65℃时1h即可完成反应,同时检测结果可直接通过肉眼或加入荧光染料即可判断,非常值得进行技术推广。
[1] 刘秀梅,陈艳,王晓英,等.1992~2001年食源性疾病暴发资料分析一国家食源性疾病监测网[J].卫生研究,2004,33(6):725-727.
[2] 张明先,牛丽,吕漫影.一起由福氏志贺氏菌引起的食物中毒调查[J].中国饮食卫生与健康,2004,2(2):45-46.
[3] 徐宜为.免疫检测技术[M].北京:科学出版社,1991:18-205.
[4] Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63.
[5] Nagamine K,Hase T,Notomi T.Accelerated reaction by loop-mediated isothermal amplification using loop primers[J].Mol Cell Probes,2002,16(3):223-229.
[6] Iwamoto T,Sonobe T,Hayashi K.Loop-mediated isothermal amplification for direct detection of mycobacterium tubercuLosis complex,M.avium,and M.intracelluLare in sputum samples[J].J Clin Microbio1,2003,41(6):2616-2622.
[7] Kuboki N,Inoue N,Sakurai T,et al.Loop-mediated isothermal amplification for detection of African trypanosomes[J].J Clin Microbio1,2003,41(12):5517-5524.
[8] Song T,Toma C,Nakasone N,et al.Sensitive and rapid detection of Shigella and enteroinvasive Escherichia coli by a loop-mediated isothermal amplification method[J].FEMS Microbiol Lett,2005,243(1):259-263.
[9] 杨秋林,张如胜,伍和平,等.环介导等温扩增技术检测卡氏肺孢子虫的研究[J].中华微生物学和免疫学杂志,2008,28(6):565-567.
[10] 杨秋林,许丽芳,沈元琼,等.环介导等温扩增技术检测恶性疟原虫的研究[J].中国人兽共患病学报,2008,24(11):1045-1046.
Objective To study on LAMP detection of Shigella flexner and investigate the fast, simple, effective gastrointestinal borne pathogens of clinical diagnosis, drinking water testing and environmental health monitoring and other detection methods. Methods Shigella flexneri were cultured, and then used the PCR and LAMP technology to design 4 primers, and the use of cloning and other molecular biology methods for DNA extraction, and then the PCR method and LAMP method were compared and analyzed.Results LAMP amplification had very high specificity, there was almost no nonspecific amplification; compared with the PCR method, the detection limit of LAMP was lower, only 5 copies; LAMP amplification under isothermal conditions, no time loss caused by temperature change, within the 1h target sequence could be amplified to 109-1010 times. Conclusion LAMP technology has the characteristics of specific sensitive simple, does not require special equipment, to complete the 1h reaction at 65℃, and the detection results can be directly by the naked eye or adding fluorescent dye can be judged.
LAMP; Shigella flexneri; CPR; Detection; Experimental study
10.3969/j.issn.1009-4393.2015.5.001
湖南省教育厅课题 (11C1163)
湖南 422000 邵阳医学高等专科学校微生物教研室(彭丁晋)
