高铁酸盐的制备及其在水和废水处理中的应用
2015-07-19刘文芳赵颖蔡亚君李晓光李曹乐唐军
刘文芳,赵颖 ,蔡亚君,李晓光,李曹乐,唐军
1.武汉纺织大学环境工程学院,湖北 武汉 430073
2.中国环境科学研究院,北京 100012
3.广东省浩蓝环保水污染治理院士工作站,广东 广州 510630
近年来,一种绿色、无机、多功能强氧化剂高铁酸盐受到国内外普遍关注。高铁酸盐已广泛应用于纺织、漂白、消毒、电池电极等方面。高铁酸盐以铁的六价形态存在,高铁酸钾是其主要化合物。其与高锰酸钾具有相似的化学结构,与传统的氧化剂(O3、Cl2、H2O2、KMnO4)相比,高铁酸盐具有更高的氧化还原电位[1],其用于水处理具有以下几方面的优势:1)还原产物是无任何毒副作用的三价铁氢氧化物,不会对水体造成二次污染;2)同时具有氧化、吸附、絮凝、杀菌、消毒等多功能性质;3)应用范围广,在整个pH 范围内均具有良好效果;4)氧化速度快且降解速率均匀;5)操作方便且杀菌力强。因此,高铁酸盐是集氧化、杀菌、消毒、吸附、絮凝及助凝为一体,安全无任何毒副作用的多功能高效水处理药剂,在水处理应用领域中具有重要的研究开发和应用前景。
基于高铁酸盐的基本性质、合成及分析方法,以及目前人们对高铁酸盐在环境污染控制中的认识,笔者综述了高铁酸盐的发展现状及其在水与废水处理中的应用,以期为高铁酸盐大规模运用于水与废水处理领域提供借鉴。
1 高铁酸盐的合成及分析方法
1.1 高铁酸盐的合成
高铁酸盐的合成方法主要有干式氧化法、湿式氧化法和电化学氧化法3 种。
1.1.1 干式氧化法
干式氧化法又称固相熔融法,是指在苛性碱的存在下,将具有氧化性或高温下可分解成为具有氧化性物质的化合物与铁屑或含铁化合物充分混合进行高温熔融制备高铁酸盐的方法。比较典型的是Y.K.Kiselev 等[2]提出的在O2气流保护下,温度控制在350 ~370 ℃,锻烧Fe2O3和K2O2的混合物,制备得到K2FeO4晶体。由于该法在制备高铁酸盐的过程中会放出大量的热,升温速度过快,反应过程中有发生爆炸的危险,因此该制备方法实际应用的较少。近年来,L.Ninane 等[3]提出了一种新的干法工艺,目的在于提高高铁酸盐的产量,以满足高铁酸盐广泛应用于实际水处理中的需要。在该工艺中,以硫酸亚铁、氢氧化钾、次氯酸钙(或氯)3 种化学试剂为原料,由于其主要原料硫酸亚铁来源于二氧化钛生产过程中产生的废物,因此可降低高铁酸盐的生产成本。
1.1.2 湿式氧化法
湿式氧化法又称次氯酸盐氧化法,该法最早是在1948年由J.M.Schreyer[4]提出的,其制备方法为先将三价铁盐溶于浓碱液制备氢氧化铁,然后用次氯酸盐将氢氧化铁氧化制得高铁酸盐。1951年,G.W.Thompson 等[5]在此基础上改进了制备与纯化过程,选用硝酸铁为铁源,依次采用苯、乙醇、乙醚对粗产品进行洗涤。此后,对湿式氧化法的改进主要是从提高高铁酸盐产率、减小有机溶剂洗涤过程中对人体健康和环境造成损害的角度进行。尽管采用湿式氧化法合成高铁酸盐可使纯度达到99%以上,但其中存在的碱金属氢氧化物、氯化物和三氧化二铁等杂质仍然会促进高铁酸盐纯产品的分解。Y. D.Perfiliev 等[6]将臭氧通入Fe(OH)-4 溶液中制备高铁酸盐可改善这一现状。其形成过程表示为:
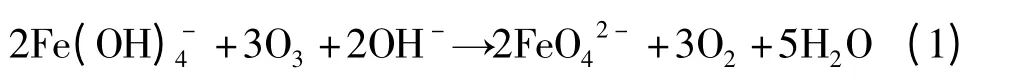
1.1.3 电化学氧化法
目前应用最为普遍的电化学氧化法是间接电合成法。其原理是在浓的强碱性溶液中,以铁电极或惰性金属(如Pt 等)作为阳极,通入直流电电解含铁溶液来制备高铁酸盐溶液,然后再与其相应的碱或盐发生复分解反应来制备高铁酸盐固体。其电极反应过程如下:
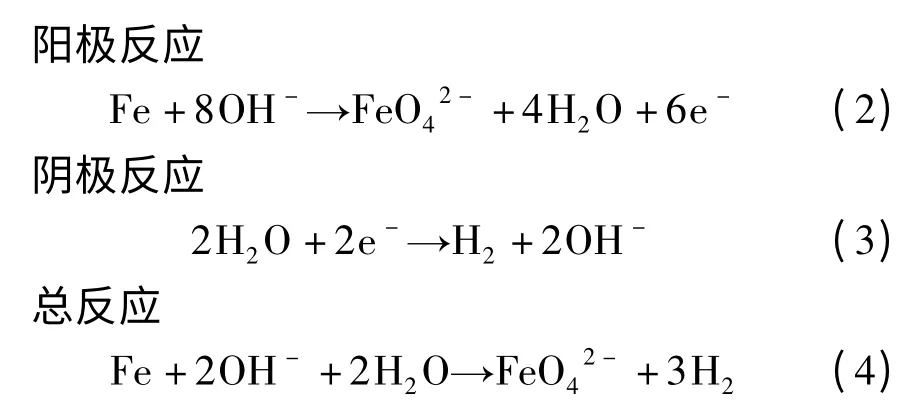
大量研究[7-10]表明,传统的电化学氧化法生产高铁酸盐产率受电流强度、阳极组成、溶液温度影响较大,最近,已有学者[11]研究在碱性条件下将硼掺杂金刚石电极应用于高铁酸盐的合成中,电解过程主要分2 步:1)开始2 h,用不锈钢作为电极,在130 A/m2、30 ℃条件下进行电解;2)之后2 h,以硼掺杂的金刚石为电极,在相同条件下进行电解。研究表明,第一阶段的电氧化不受电荷消耗的影响,第二阶段中由于硼掺杂金刚石的应用,电极变质和钝化的现象不易发生。基于高铁酸盐的高生产成本和低稳定性,为了将其更广泛地应用于实际废水处理中,原位电化学合成[12-13]应运而生,该生产方式不仅省略高铁酸盐的运输,降低生产成本,而且提高了高铁酸盐的产率及实际应用中的稳定性。
1.2 高铁酸盐的分析方法
高铁酸盐的分析方法主要为滴定法和分光光度法2 种。
1.2.1 滴定法
滴定法是高铁酸盐的传统分析方法,主要为砷酸盐滴定法、亚铬酸盐滴定法、循环伏安法、EDTA滴定法。砷酸盐滴定法[14]是在碱性条件下,用过量的亚砷酸盐标准溶液将高铁酸盐溶液还原为三水合氢氧化铁,再用铈酸盐或溴酸盐标准溶液滴定剩余的亚砷酸盐溶液。由于高铁酸盐稀溶液易分解生成三价铁化合物,而过多的Fe(Ⅲ)化合物对滴定终点变色会产生干扰作用,因此砷酸盐滴定法不适合高铁酸盐稀溶液的分析。亚铬酸盐滴定法[15]的反应机理与砷酸盐滴定法相似,是在亚铬酸盐的强碱性溶液中,利用高铁酸盐将亚铬酸盐氧化为铬酸盐,再将生成的铬酸盐进行酸化变为重铬酸盐,最后用硫酸亚铁铵进行标定。该法滴定终点变色明显,实用性较高。循环伏安法[16]是基于铁电极在碱性高铁酸盐溶液中测得的循环伏安曲线,通过高铁酸根在曲线上对应的还原峰的峰电流密度直接得到高铁酸盐溶液的浓度。与其他方法相比,高灵敏度是循环伏安法的显著特点。EDTA 滴定法[17]是在分光光度法基础上衍生出的新滴定法,该法是利用络合滴定的原理,其具有操作简单、方便、实用性高的特点。
1.2.2 分光光度法
分光光度法是基于定量分析滴定法发展起来的一种现代分析方法,主要为紫外-可见光谱法[18]、ABTS 显色法[19]、显色法[20]。紫外- 可见光谱法具有操作简便的优点,一般用于较稳定的pH 条件下,由于在波长(λ)为510 nm 处高铁酸盐的吸光系数比较低(ε 为1 150 L/(mol·cm)),故其应用范围比较有限。ABTS 显色法用于pH 为4.3 的酸性缓冲液条件下,高铁酸盐与无色试剂ABTS 反应,生成呈绿色的稳定性较强的自由基ABTS·+,它在λ 为415 nm 处具有明显的吸收峰,该方法检测限较低(0.03 ~35 μmol/L),适于对低浓度的高铁酸盐溶液的分析与监测。显色法可在较宽的pH(5.5 ~9.0)范围内用于高铁酸盐的定量分析,该法是向pH为9.0,浓度为6.9 ~75.9 μmol/L的高铁酸盐溶液中添加过量的NaI,生成的在λ 为351 nm 处具有明显吸收峰,且吸光值与高铁酸盐浓度呈良好线性关系;然而,该法存在的局限性是,当溶液中存在有机物时的吸收光谱会受影响,此时应扣除有机物的吸光值。表1 为3 种分光光度分析法特点的比较[20]。

表1 分光光度法检测高铁酸盐浓度的比较[20]Table 1 Comparison of spectrosphotometric method to determine concentration of Fe(Ⅵ)in solution
2 高铁酸盐在水和废水处理中的应用
2.1 除藻
近年来,由于氮磷污染的影响,水体富营养化日益严重,水体中大量的藻类会给饮用水处理带来诸多问题,严重影响饮用水的安全。运用高锰酸钾、氯等氧化剂进行水处理均存在水体二次污染的问题。高铁酸盐作为环境友好水处理剂具有明显优势。
Ma J.等[21]进行了高铁酸盐预氧化絮凝除绿藻类的效果和机理研究,结果表明,高铁酸盐预氧化对Al2(SO4)3·18H2O絮凝除藻具有明显的促进作用,能在减小絮凝剂投加量的同时提高去除效率。机理在于高铁酸盐的强氧化性可导致藻细胞破裂,胞内物质释放到水体中易形成生物高聚物助凝剂,同时高铁酸盐的还原产物Fe(OH)3亦具有良好的助凝作用,从而起到对Al2(SO4)3·18H2O 絮凝除藻的促进作用。苑宝玲等[22]对高铁酸盐氧化絮凝去除水中藻类(以颤藻和小球藻为例)的机制进行了研究,通过观察投加高铁酸盐前后藻类光合作用和呼吸作用变化的综合结果来判断杀菌效果。通过测定Zeta电位考察高铁的强化絮凝作用,结果发现,高铁酸盐的强氧化性对藻类呼吸作用和生长方式均有较大影响,同时少量高铁酸盐的投加可明显影响藻类细胞表面的电动电势,强化对藻类的絮凝效果。刘立明等[23]对絮凝剂PAC 单独絮凝及高铁酸盐预氧化协同絮凝剂PAC 去除水中铜绿微囊藻及其毒素进行了对比研究,结果表明,采用高铁酸盐预氧化的效果明显优于单独使用PAC 混凝剂的效果。当8 mg/L高铁酸钾和8 ~16 mg/L 的PAC 联合作用时,不仅絮凝沉降藻细胞,水体中的微囊藻毒素(MC-LR)也同时被高铁酸盐氧化去除了。刘伟等[24]针对水中有机物浓度和种类变化影响藻类的混凝去除效果,研究了高铁酸盐预氧化除藻工艺对水中溶解性有机物的影响规律,结果显示,高铁酸盐的预氧化作用不仅提高了藻类的去除效率,而且能有效去除水中溶解性有机物。马晓雁等[25]模拟高藻期碱性水源水,采用聚合氯化铁(PFC)单独絮凝、高铁酸钾及高锰酸钾与PFC 联用3 种方法对水中以颤藻为代表的藻类及微量嗅味污染物(二甲基三硫醚)进行同步控制研究,也得到了类似的结果,即预氧化絮凝技术明显优于单独混凝(除藻率最高为90.6%)技术,与高锰酸钾相比,高铁酸盐具有氧化时间短且可同时高效除嗅的特点。
2.2 杀菌消毒
杀菌消毒是饮用水中必不可少的一道工序,加氯技术是目前应用最普遍的消毒措施,基于氯化后水中产生的消毒副产物(DBPs)对人体健康存在潜在危害,已考虑用碘、溴、二氧化氯及臭氧等氧化剂来替代氯消毒,但研究表明,这些氧化剂会产生其他有毒副产物,仍然会在一定程度上对人类健康造成威胁。高铁酸盐在氧化消毒过程中产生的还原产物Fe(OH)3不仅具有较高的安全性,而且是一种良好的助凝剂。高铁酸盐在去除有害细菌和病毒的同时可有效去除水中的悬浮颗粒及重金属离子[26-27]。作为一种高效、安全的水处理药剂高铁酸盐被认为可替代氯作为消毒剂,因而,在饮用水杀菌消毒领域的应用具有广阔前景。
已有研究[28-30]表明,高铁酸盐对埃希氏大肠杆菌(E. coli)、F2 噬菌体病毒具有优越的抑菌灭活作用。在pH 为8.2 的条件下,投加6 mg/L 高铁酸盐可在7 min 内可杀死99%的大肠杆菌;在pH 为6.9的条件下,投加1 mg/L 高铁酸盐可在5.7 min 内灭活99%的F2 噬菌体。Yuan B.L.等[31]运用多功能药剂高铁酸盐研究对蓝藻微囊藻毒素(LR)的去除效果,结果表明,蓝藻微囊藻毒素的毒质易被高铁酸盐的氧化作用降解,毒素的去除效率主要受高铁酸盐的投加量、pH、反应时间3 个因素的影响。同时,高铁酸盐的还原产物Fe(OH)3对水体中的TOC 有絮凝作用,可絮凝去除水体中50%的TOC。Jiang J.Q.等[32]将高铁酸盐与次氯酸钠结合硫酸铁或硫酸铝对埃希氏大肠杆菌的去除效果进行了对比试验,结果发现,高铁酸盐能在较小剂量、较短反应时间及受溶液pH 影响较小的条件下达到与次氯酸钠氧化/硫酸铁或硫酸铝絮凝杀菌相同的去除效果。Hu L.H.等[33]对高铁酸盐导致MS2 噬菌体失活进行了研究,结果显示,在pH 为7.0,25 °C 条件下,投加1.23 mg/L 高铁酸盐可导致99.99%的MS2 噬菌体失活,证实了高铁酸盐对水体微生物污染具有良好的去除功能。
2.3 重金属离子的去除
重金属是水体中具有潜在危害的一类重要污染物,目前备受关注的主要有汞、砷、镉、铬、铅等,它们对生物体具有显著毒害作用,在水体中无法被微生物分解,且易在生物体内富集,通过生物放大作用危害人类健康。由于重金属离子在水体中的存在形态多样化且易转化,常规的混凝工艺对多数重金属离子的去除效果均不理想,而高铁酸盐的预氧化作用可促进后续的絮凝效果,从而提高对重金属的去除效率。
梁咏梅等[34]的研究表明,高铁酸盐的预氧化作用对于水中微量铅、镉的去除具有良好的促进效果,投加1 mg/L 高铁酸盐与单独使用硫酸铝混凝相比,可使原水中浓度为250 μg/L 的Pb 和50 μg/L 的Cd去除率提高20%左右;刘伟等[35]进行了高铁酸盐预氧化去除地表水中锰的试验,结果表明,单独硫酸铝混凝、沉淀对水中锰的去除没有明显作用,而高铁酸盐预氧化能显著提高锰去除率。苑志华等[36]对高铁酸盐去除重金属进行了模拟试验研究,结果表明,pH 对高铁酸盐去除Pb、Cd、Fe、Zn、Mn 和Cu 均有较大影响,在pH 为10,加药量为30 mg/L 时,去除率为56.9% ~94.4%;当pH 为8.3,加药量为30 mg/L 时,高铁酸钾能促使矿井水中超标的Pb、Cd 和Fe 达到GB 5749—2006《国家生活饮用水卫生标准》,同时对矿井水中未超标低浓度Mn 的去除率为53.7%。V.K.Sharma 等[37]用高铁酸盐对工业废水中氰化物、硫氰酸盐、铜(Ⅰ)氰化物进行去除研究发现,高铁酸盐能将毒性较强的氰化物转 化 为 无 毒 性 的 氰 酸 酯。J. Amita 等[38]用Fe(Ⅵ)、Fe(Ⅵ)/Fe(Ⅲ)氯盐、Fe(Ⅵ)/Al(Ⅲ)氯盐3 组水处理试剂对水体中砷的去除做了对比研究,结果表明,Fe(Ⅵ)/Al(Ⅲ)氯盐比其他2 组去除效率更高,在最佳pH 为6.5 的条件下,将水体中的总砷浓度由500 μg/L 降低至1.45 μg/L,满足饮用水标准(小于10 μg/L)。M. Lim 等[39]对高铁酸盐同时去除河水中重金属(Cu、Mn、Zn)和天然有机颗粒物(NOM)进行了研究,向浓度为0.1 mmol/L 的重金属溶液中,投加0.03 ~0.7 mmol/L(以Fe 计)的高铁酸盐时,Cu、Mn 和Zn 的去除率分别为28% ~99%、22% ~73%和18% ~100%,且重金属的去除率随着pH 的升高而呈递增趋势;而当水样中同时含有0.1 mmol/L 重金属和10 mg/L天然有机颗粒物时,投加相同剂量高铁酸盐时,高铁酸盐对重金属Cu、Zn、Mn 和天然有机颗粒物的去除效果更好,去除率分别为87% ~100%、31% ~81%、11% ~100%和33% ~86%。可见高铁酸盐对河水中的重金属亦具有较好的去除效率。
2.4 有机污染物及新兴微污染物的去除
饮用水中存在的大量有机物不仅对人体健康会产生巨大危害,同时有机物在水中起到分散剂的作用,阻碍颗粒间的结合,增加了水中胶体物质的稳定性,导致凝聚过程中混凝剂投加量的增加。高铁酸盐的预氧化能破坏有机物对胶体颗粒的保护,使胶体粒子脱稳,从而起到助凝的作用。同时,高铁酸盐在被还原的过程中能产生大量的正价态水解产物,它们同最终产物Fe(OH)3一起达到助凝、吸附共沉淀去除有机污染物的目的。因此高铁酸盐对饮用水中的有机污染物及新兴微污染物具有较好的去除效果。
大量研究[40-45]表明,高铁酸盐可有效降解水中不同类型的有机污染物,如醇类化合物、羧酸类化合物、酚类化合物、有机硫化合物、染料等,产生对水体无毒害作用的Fe(OH)3。近年来许多研究集中于高铁酸盐对新兴微污染物的去除效果及机理研究,如Lee Y.等[46]研究了几种强氧化剂(氯、溴、臭氧、羟基自由基、二氧化氯及高铁酸盐等)在处理含类固醇雌激素废水过程中对抑制雌激素(以17α-乙炔基雌二醇(EE2)为例)活性的效果,结果表明,在数分钟甚至数秒的时间内,高铁酸盐可有效去除水中的雌激素EE2。Lee Y.等[47]进行了Fe(Ⅵ)去除酚类化合物和酚类内分泌干扰物的氧化动力学研究,结果表明,在pH 为7 的条件下,高铁酸盐对3种特定的酚类内分泌干扰物(17α-乙炔基雌二醇、β-雌二醇、双酚A)的表观二阶常数为6.4 ×102~7.7 × 102L/(mol·s),取 代 酚 的 表 观 二 阶 常 数 为6.6 ~3 600 L/(mol·s),研究表明,高铁酸盐对存在于水体中的其他潜在的酚类内分泌干扰物具有良好的去除功能。Hu L.等[48]对Mn(Ⅶ)和Fe(Ⅵ)氧化去除水和废水中的微污染药物卡马西平进行了反应动力和机理研究,结果显示,二者对卡马西平的快速氧化均是以烯烃基亲电子攻击中央杂环的方式导致开环和产生一系列有机氧化产物。反应动力学遵循广义二阶速率定律。甲氧苄氨嘧啶(TMP)是地表水和市政污水中较常见的一种抗菌药剂,A. K.George 等[49]对高铁酸盐氧化去除TMP 的动力学、氧化产物及氧化产物的抗菌性进行了研究,结果表明,高铁酸盐氧化TMP 的路径是TMP 分子分裂成最终产物3,4,5-三甲氧基苯甲醛和2,4-二硝基化合物,且分裂产物的混合物不再具有抗菌性能。因此,高铁酸盐可用于城市二级污水处理出水中TMP 的去除。基于地表水和城市二级污水处理出水中存在磺酰胺类药物抗菌剂这种新型微污染物的现状,V. K. Sharma 等[50]对高铁酸盐氧化去除磺胺类药物(磺胺异恶唑、磺胺二甲嘧啶、磺胺甲、磺胺二甲氧嘧啶、磺胺甲恶唑等)进行了研究,结果表明,高铁酸盐对于去除水中磺胺类药物并降低其毒性具有实际的应用潜能。
3 展望
目前大量研究主要集中在将高铁酸盐用于实际水与废水处理中,包括对高铁酸盐合成工艺的改进以提高高铁酸盐的产率及稳定性;对将高铁酸盐用作水处理絮凝剂、消毒灭菌剂和氧化剂的研究已证实,高铁酸盐在去除水中的有害微污染物、重金属、悬浮颗粒物、天然及合成有机物、减少氯消毒副产物等方面具备显著优势。
将高铁酸盐用于处理新兴微污染物(如药物类、个人保健品及内分泌干扰物)的高级氧化工艺中,实现高铁酸盐的在线生产和应用以及将高铁酸盐技术用于大规模水处理领域等仍然是未来的发展方向。
基于高铁酸盐在推广应用中存在的上述问题,结合目前的相关研究成果,高铁酸盐在水和废水处理应用中亟需解决以下问题:进一步优化高铁酸盐原位合成技术,包括工艺、反应器系统等以提高高铁酸盐的产率;研究高铁酸盐投加点、投加方法、投加设施和混合体系对其在水处理中的性能影响;研究水质特点对高铁酸盐用作氧化剂和消毒剂发挥效能的影响;对高铁酸盐降解水中多种微污染物时产生的潜在副产物的毒性进行系统研究,以确保饮用水的安全性;进行高铁酸盐的大规模应用试验以证实其在实验室研究中获得的水处理性能,同时对高铁酸盐的经济适用性进行评价。
[1]JIANG J Q,LLOYD B. Progress in the development and use of ferrate(Ⅵ)salt as an oxidant and coagulant for water and wastewater treatment[J].Water Research,2002,36:1397-1408.
[2]KISELEV Y K,KOPELEV N S,ZAVYALOVA N A,et al. The preparation of alkali metal ferrate(Ⅵ)[J]. Russian Journal of Inorganic Chemistry,1989,34(9):1250-1253.
[3]NINANE L,KANARI N,CRIADO C,et al. ACS symposium series:new processes for alkali ferrate synthesis[M].Washington DC:American Chemical Society,2008:102-111.
[4]SEHREYER J M. Higher valence compounds of iron[D].Corvallis,Oregon:Oregon State College,1948.
[5]THOMPSON G W,OEKERMAN L T,SEHREYER J M.Preparation and purification of potassium ferrate (Ⅵ)[J].American Chemical Society,1951,73(3):1379-1381.
[6]PERFILIEV Y D,BENKO E M,PANKRATOV D A,et al.Formation of iron(Ⅵ)in ozonalysis of iron(Ⅲ)in alkaline solution[J].Inorganica Chimica Acta,2007,360:2789-2791.
[7]DENVIR A,PLETCHER D. Electrochemical generation of ferrate:2. Influence of anode composition[J].Journal of Applied Electrochemistry,1996,26:823-827.
[8]BOUZEK K,SCHMIDT M J,WRAGG A A. Influence of electrolyte hydrodynamics on current yield in ferrate (Ⅵ)production by anodic iron dissolution [J]. Collection of Czechoslovak Chemica Communications,2000,65:133-140.
[9]BOUZEK K,ROUSAR I,BERGMANN H,et al. The cyclic voltammetric study of ferrate(Ⅵ)production[J]. Journal of Electroanalytical Chemistry,1997,425:125-137.
[10]MACOVA Z,BOUZEK K,SHARMA V K,et al. Research progress in the electrochemical synthesis of ferrate(Ⅵ)[J].Electrochimica Acta,2009,54:2673-2683.
[11]CAÑIZARES P,ARCÍS M,SÁEZ C,et al. Electrochemical synthesis of ferrate using boron doped diamond anodes[J].Electrochemistry Communications,2007(9):2286-2290.
[12]LICHT S,YU X. Electrochemical alkaline Fe (Ⅵ) water purification and remediation[J]. Environmental Science &Technology,2005,39:8071-8076.
[13]JIANG J Q,STANFORD C,ALSHEYAB M.The online generation and application of ferrate(Ⅵ)for sewage treatment:a pilot scale trial[J]. Separation and Purification Technology,2009,68:227-231.
[14]SCHERYER J M,THOMPSON G W,OCKERMAN L T. Ferrate oxidimetry:oxidation of arsenite with potassium ferrate(Ⅵ)[J].Analytical Chemistry,1950,22(5):691-692.
[15]SEHERYER J M,THOMPSON G W,OCKERMAN L T.Oxidation of chromium(Ⅲ)with potassium ferrate(Ⅵ)[J]. Analytical Chemistry,1950,22(11):1426-1427.
[16]VENKATADRI A S,WAGNER W F,BAUER H H.Ferrate(Ⅵ)analysis by cyclic voltammetry[J]. Analytical Chemistry,1971,43(8):1115-1119.
[17]李党生,李桂敏.EDTA 滴定法测定[J].分析试验室,2004,24(8):80-81.
[18]RUSH J D,BIELSKI B H. Pulse radiolysis studies of alkaline iron(Ⅲ)and iron(Ⅵ)solutions:observation of transient iron complexes with intermediate oxidation states[J]. Journal of the American Chemical Society,1986,108:523-525.
[19]LEE Y,YOON J,GUNTEN U V. Spectrophotometeric determination of ferrate(Fe(Ⅵ))in water by ABTS[J]. Water Research,2005,25:1946-1953.
[20]LUO Z Y,STROUSE M,JIANG J Q,et al. Methodologies for the analytical determination of ferrate(Ⅵ)a review[J]. Journal of Environmental Science and Health,Part A:Toxic,2011,46:453-460.
[21]MA J,LIU W. Effectiveness and mechanism of potassium ferrate(Ⅵ)preoxidation for algae removal by coagulation[J].Water Research,2002,36:871-878.
[22]苑宝玲,曲久辉.高铁酸盐氧化絮凝去除藻类的机制[J]. 中国环境科学,2002,22(5):397-399.
[23]刘立明,李丽萍,黄应平. 高铁酸钾/PAC 氧化-混凝去除水体中铜绿微囊藻[J].生态科学,2013,32(6):686-691.
[24]刘伟,蔡国庆,李永民,等. 高铁酸盐预氧化除藻工艺对含藻水中溶解性有机物的影响[J]. 哈尔滨工业大学学报,2002,34(2):220-224.
[25]马晓雁,张泽华,王红宇,等. 高铁酸钾对水中藻类及其次生嗅味污染物二甲基三硫醚同步去除研究[J]. 环境科学,2013,34(5):1767-1772.
[26]JIANG J Q. Research progress in the use of ferrate(Ⅵ)for the environmental remediation[J]. Journal of Hazardous Materials,2007,146:617-623.
[27]YNGARD R,DAMRONGSIRI S,OSATHAPHAN K,et al.Ferrate(Ⅵ) oxidation of zinc-cyanide complex [J].Chemosphere,2007,69:729-735.
[28]MURMANN R K,ROBINSON P R.Experiments utilizing FeO42-for purifying water[J].Water Research,1974(8):543-547.
[29]GILBERT M B,WAITE T D,HARE C. Analytical notes:an investigation of the applicability of ferrate ion for disinfection[J].Journal American Water Works Association,1976,68:495-497.
[30]SCHINK T,WAITE T D. Inactivation of F2 virus with ferrate(Ⅵ)[J].Water Research,1980,14:1705-1717.
[31]YUAN B L,QU J H,FU M L. Removal of cyanobacterial microcystin-LR by ferrate oxidation-coagulation[J]. Toxicon,2002,40:1129-1134.
[32]JIANG J Q,WANG S,PANAGOULOPOULOS A. The role of potassium ferrate(Ⅵ)in the inactivation of Escherichia coli and in the reduction of COD for water remediation[J]. Desalination,2007,210:266-273.
[33]HU L H,MARTIN A P,THERESE S,et al. Inactivation of Bacteriophage MS2 with potassium ferrate (Ⅵ)[J].Environmental Science & Technology,2012,46:12079-12087.
[34]梁咏梅,刘伟,马军. pH 和腐殖酸对高铁酸盐去除水中铅镉的影响[J].哈尔滨工业大学学报,2003,35(5):545-548.
[35]刘伟,梁咏梅,马军.高铁酸盐预氧化强化去除地表水中锰的试验[J].哈尔滨工业大学学报,2005,37(2):180-182.
[36]苑志华,桂和荣,何文丽,等. 高铁酸钾去除重金属的模拟试验研究[J].水处理术,2009,35(5):67-71.
[37]SHARMA V K,YNGARD R A,CABELLI D E,et al.Ferrate(Ⅵ)and ferrate(Ⅴ)oxidation of cyanide,thiocyanate,and copper(Ⅰ)cyanide[J]. Radiation Physics and Chemistry,2008,77:761-767.
[38]JAIN A,SHARMA V K,MBUYA O S. Removal of arsenite by Fe(Ⅵ),Fe(Ⅵ)/Fe(Ⅲ),and Fe(Ⅵ)/Al(Ⅲ)salts:effect of pH and anions[J]. Journal of Hazardous Materials,2009,169:339-344.
[39]LIM M,KIM M-J.Effectiveness of potassium ferrate(K2FeO4)for simultaneous removal of heavy metals and natural organic matters from river water[J]. Water,Air and Soil Pollution,2010,211:313-322.
[40]WANG G,FENG L M. Experimental studies on application of potassium ferrate for 3-methylphenol removal from solution in laboratory[J]. Procedia Environmental Sciences,2013,18:486-492.
[41]NOORHASAN N,PATEL B,SHARMA V K. Ferrate (Ⅵ)oxidation of glycine and glycylglycine:kinetics and products[J].Water Research,2010,44:927-935.
[42]LI C,LI X Z,GRAHAM N,et al. The aqueous degradation of bisphenol A and steroid estrogens by ferrate[J].Water Research,2008,42:109-120.
[43]罗志勇,郑泽根,张胜涛.高铁酸盐氧化降解水中苯酚的动力学及机理研究[J].环境工程学报,2009,3(8):1375-1378.
[44]SHARMA V K,LUTHER G W Ⅲ,Millero F J. Mechanisms of oxidation of organosulfur compounds by ferrate (Ⅵ)[J].Chemosphere,2011,82:1083-1089.
[45]俞超,雷国元,姜成春.高铁酸盐对活性及分散染料的脱色研究[J].环境工程学报,2012,6(2):423-428.
[46]LEE Y,ESCHER B I,GUNTEN U V. Efficient removal of estrogenic activity during oxidative treatment of waters containing steroid Estrogens[J]. Environental Science Technology,2008,42(17):6333-6339.
[47]LEE Y,YOON J,GUNTEN U V. Kinetics of the oxidation of phenols and phenolic endocrine disruptors during water treatment with ferrate (Fe (Ⅵ))[J]. Environmental Science &Technology,2005,39:8978-8984.
[48]HU L,MARTIN H M,ARCE-BULTED O,et al. Oxidation of carbamazepine by Mn(Ⅶ)and Fe(Ⅵ):reaction kinetics and mechanism[J]. Environmental Science & Technology,2009,43:509-515.
[49]ANQUANDAH G A K ,SHARMA V K,ANDREW K D,et al.Oxidation of trimethoprim by ferrate(Ⅵ):kinetics,products,and antibacterial activity[J]. Environmental Science & Technology,2011,45:10575-10581.
[50]SHARMA V K,MISHRA S K,NESANAS N. Oxidation of sulfonamide antimicrobials by ferrate (Ⅵ)[J].Environmental Science & Technology,2006,40:7222-7227.○
