单宁酸在不同pH缓冲液条件下的含量变化
2015-06-30徐国发郑仕萍张建博等
徐国发 郑仕萍 张建博等
摘要:目的研究和分析单宁酸在不同pH的磷酸盐缓冲液中水解后的含量变化。方法采用在常温下观察单宁酸在不同pH的磷酸盐缓冲液(pH分别为2、3、4、5、6)中的水解情况,应用反相高效液相色谱仪测定单宁酸及其水解产物没食子酸含量,并比较和分析单宁样品液水解前后单宁酸和没食子酸含量变化。结果单宁酸随着pH值的上升,其含量呈逐渐下降的趋势,没食子酸的含量呈现逐渐上升的趋势。结论单宁酸及其水解产物没食子酸在不同pH条件下的含量变化反映了酸碱度对单宁酸水解反应的影响,本实验研究可为单宁酸在中药提取加工、养护、储存等方面的应用提供一定参考。
关键词:单宁酸;水解反应;没食子酸 pH;磷酸盐缓冲液
中图分类号:R284文献标志码:A文章编号:1007-2349(2015)06-0088-03
单宁酸(Tannic acid)是一种存在于多种天然药用植物的多元酚类化合物,具有很强的生物和药理活性,是具有重要开发价值的天然产物[1]。分子式C76H52O46,能溶于乙醇、水、丙酮,几乎不溶于苯、乙醚、石油醚、氯仿等[2]。,是没食子酸酯及其衍生物与葡萄糖或多酚通过酯键相连形成的化合物,遇酸、碱、酶能够水解,水解时能生成双没食子酸酯,双没食子酸酯能进一步水解成没食子酸和葡萄糖等小分子化合物[3-5]。单宁酸存在于多种植物的树皮和果实中,如中国五棓子、塔拉果荚、石坚石榴、漆树叶、黄护、金缕梅树、柿子、君迁子、葡萄、李子、梨、山核桃、橘子、桃子、山楂、茶叶等。单宁酸在医学上能用于收敛、止血、抗菌消炎、止泻、驱虫、抗多种病原体感染,对化学诱变的皮肤、肺、前胃肿瘤有很好的抑制作用,能与细胞外或组织外的钙离子络合.可抵抗平滑肌钙诱导的收缩,发挥降血压作用[6],能够阻碍鸟氨酸脱羧酶的诱导和过氧化物的产生,提高老鼠体内的抗氧化和抗癌效果[7],对HIV-RT有一定抑制活性[8],还具有抗突变、抗脂质过氧化、改善肝肾功能、降脂等作用[9]。食品领域中能作酒类和饮料的澄清剂、稳定剂以及食品添加剂中的辅色、调味、赋形等[10-12],此外单宁酸在制革、日化、冶金、染料、电子及轻工等领域中也应用广泛。
没食子酸(Gallic acid)也是一种多酚类弱酸性化合物。化学式为C7H6O5,化学命名为 3,4,5-三羟基苯甲酸[13]。通常以糖苷键或酯键的形式与多元醇结合成水解单宁存在于植物体和果实中,能溶于热水、乙醇、乙醚、甘油和丙酮,难溶于冷水,不溶于苯和氯仿。在碱性和中性条件下较不稳定,而对强酸(1mol/L)、强光、高温较稳定,在pH为2~6的磷酸盐缓冲液条件下能保持相对稳定[14]。没食子酸对肝脏、肾脏、心血管有较强的亲和力,具有抗突变、抗炎、抗氧化、抑菌、降血糖、心血管保护等生物学效应,其中对肿瘤、多种致癌、促癌物有突出的抵抗作用[15-20]。
单宁酸和没食子酸作为一种在医药等领域都具有重要作用的多酚类鞣质,为合理地利用单宁酸等多酚类鞣质,本实验根据单宁酸的化学性质及没食子酸的稳定性,观察单宁酸在不同pH缓冲溶液中水解后含量及其产物没食子酸的含量变化情况。
1实验材料与仪器
1.1实验药品单宁酸样品(购自成都迈斯克公司);单宁酸对照品(购自云南省药检所);没食子酸对照品(购于昆明中检所);
1.2仪器与试剂Agilent1200型高效液相色谱仪(美国安捷伦公司);分析天平;电子天平;精密pH测定仪计(0.01pH);HH-S数显恒温水浴锅;移液管;烧杯;玻璃棒;容量瓶;0.45um微孔滤膜;1mL注射器;甲醇(色谱纯);磷酸(分析纯);磷酸氢二钠(分析纯);丙酮(分析纯);纯化水;
2实验方法
2.1磷酸盐缓冲液的配制A液:取磷酸16.6 mL,加纯化水至1000 mL,摇匀。B液:称取磷酸氢二钠71.63 g,加纯化水使溶解成1000 mL。取上述A液72.5 mL与B液27.5 mL混合配制,摇匀,即得pH=2.00的缓冲液。以pH=2的缓冲液为基本底液,再用纯化水将其稀释成pH为2、3、4、5、6的缓冲液。
2.2对照品溶液的制备取没食子酸对照品适量,于分析天平上精密称定,加50%甲醇溶解配制定容成每1 mL含25 μg的溶液,即得;取单宁酸对照品适量,于分析天平上精密称定,用乙醇:水:丙酮(69.9%:29.8%:0.3%)溶解定容成每1 mL含30 μg的溶液,即得。
2.3供试品溶液的制备取单宁酸样品适量,精密称定样品0.00500 g,以乙醇:水:丙酮(69.9%:29.8%:0.3%)溶解,配制定容成每1 mL含20 μg的溶液25 mL。取移液管分别吸取制备好的单宁酸样品溶液1 mL,放入固定体积的不同pH的磷酸盐缓冲液中,超声使其溶解和混匀,以恒温水浴锅控制水浴环境温度在25±0.5℃,让单宁酸样品溶液在恒温条件下充分水解1 h,对水解后的样品液用微孔滤膜(0.45 um)进行过滤后,即得供试品溶液。
2.4色谱条件
2.4.1单宁酸色谱条件色谱柱ZoRBAX SB-C18柱(4.6×250 mm,5 um);流动相:甲醇-水(80:20);柱温:室温;检测波长:275 nm;流速:0.5 mL/min;进样量:2 uL[21]。
2.4.2没食子酸色谱条件色谱柱ZoRBAX SB-C18柱(4.6×250 mm,5 um);流动相:甲醇和0.2%磷酸(5:95);柱温:25℃;检测波长:273 nm;流速:1 mL/min;进样量:10 uL。
2.5标准曲线的绘制
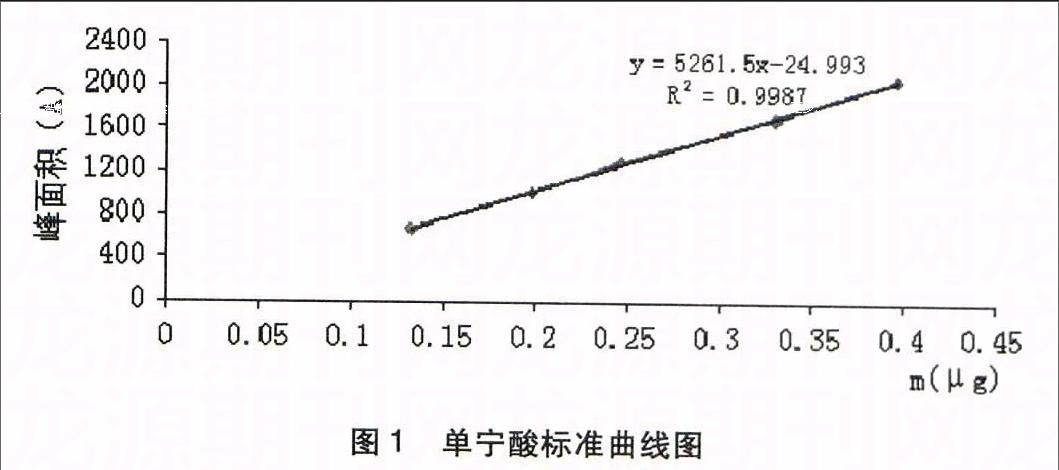
2.5.1单宁酸标准曲线的绘制于分析天平上精密称定定量的单宁酸对照品,以乙醇:水:丙酮(69.9%:29.8%:0.3%)溶解定容配制成每1 mL含31μg的溶液,按上述单宁酸色谱条件分别取1、3、5、7、9ul不同体积进样,以单宁酸的峰面积(Y)对标准品的质量(X)进行线性回归,得回归方程Y=5261.5X-24.993,R2=0.9987,结果表明:单宁酸峰面积值与质量有良好的线性关系,线性范围为0.132-0.396 ug。
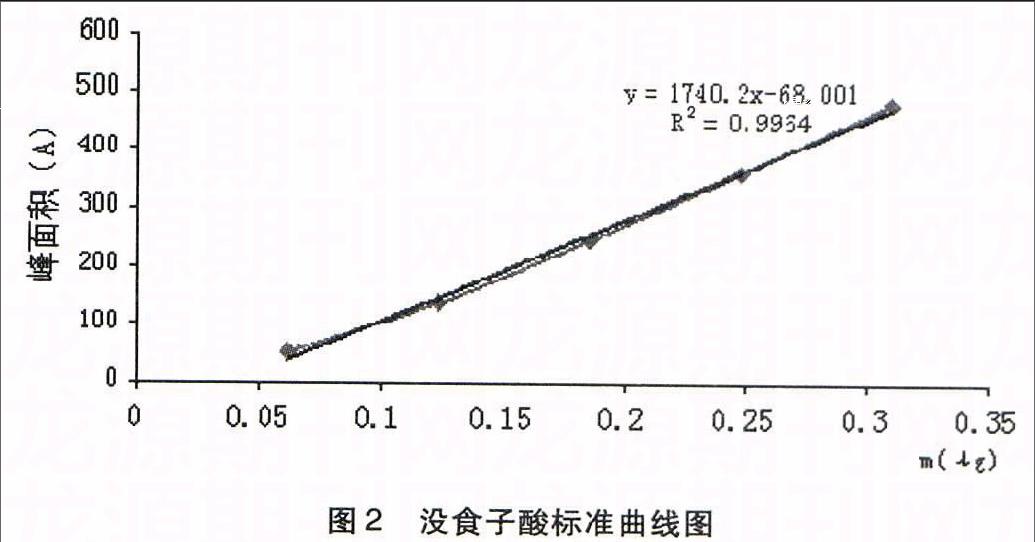
2.5.2没食子酸标准曲线的绘制取没食子酸对照品适量,于分析天平上精密称定,加50%甲醇溶解配制定容成每1 mL含33μg的溶液,按上述色谱条件分别进样4、6、8、10、12 μL,以没食子酸的峰面积(Y)对标准品质量(X)进线性回归,得方程Y=1740.2x-68.001,R2=0.9964,结果表明:没食子酸峰面积值与质量有良好的线性关系,线性范围为0.062-0.31 ug。
2.6单宁酸和没食子酸的含量测定分别取2.3项下方法制备的供试品溶液,按2.4色谱条件分别测定单宁酸、没食子酸在不同pH的磷酸盐缓冲液条件下的含量,用外标法进行计算。
3实验结果与分析
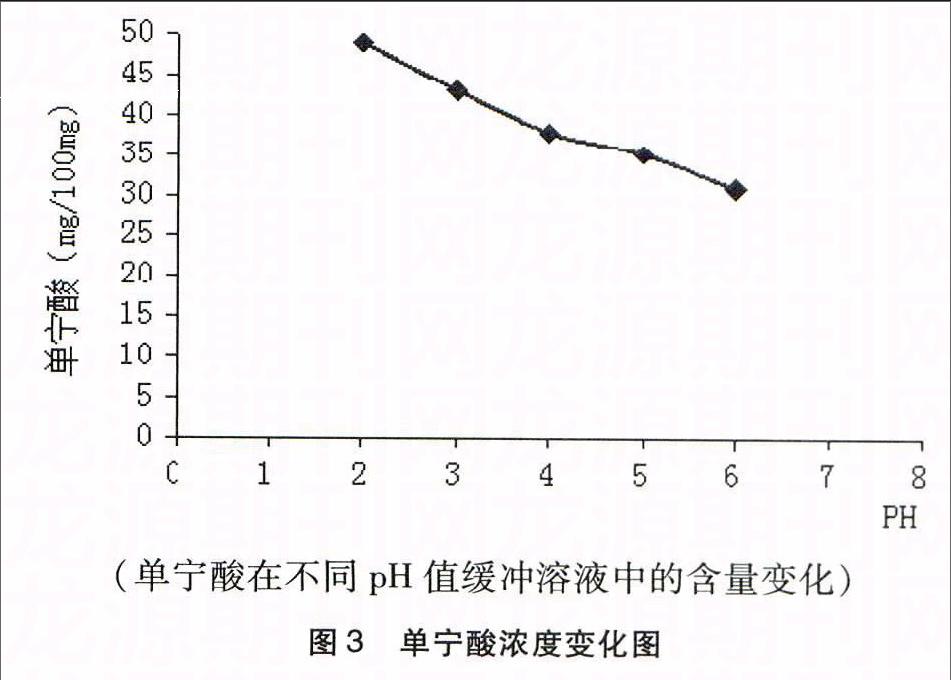
3.1从图中可以看出,在pH2~6的范围内,随着pH值的增大,单宁酸含量逐渐减少(见图3),没食子酸含量逐渐增加(见图4)。据此表明单宁在接近中性环境中更易水解产生没食子酸。
3.2从表1中的数据中可以看出,当pH 2~4的范围内,单宁酸含量下降速度快,pH 5~6时单宁酸含量下降速度慢,而没食子酸含量在pH 2~4范围内上升慢,在pH 5~6时含量上升快,说明在pH 2~4范围极大部分的单宁并未转化为没食子酸,其有可能产生1,2,3,4,6-五-O-没食子酰-β-D-葡萄糖(β-PGG)、双没食子酸酯、双没食子酸等其它的多酚化合物。说明pH2~4在不利于单宁酸酯键断裂产生没食子酸。
3.3通过实验数据分析单宁酸和没食子酸的含量变化,可以初步认为在温和的pH条件下更有利于单宁的酯键或苷键断裂产生没食子酸。
4结论
单宁酸和没食子酸存在于多种药用植物中,具有很强的药学活性,在医药等领域有广阔开发利用的前景。通过实验测定和分析单宁酸及其产物没食子酸在不同pH条件下的含量变化情况,让我们进一步认识了单宁酸和没食子酸的化学稳定性,此实验可为进一步了解和研究单宁酸及多酚化合物理化性质提供一定参考,也为医药及相关领域对单宁酸的合理利用提供一定的参考。
参考文献:
[1]吴双成.单宁酸在表面处理中的应用[J].表面技术,2000(2):36-37.
[2]石闪闪,何国庆.单宁酸及其应用研究进展[J].食品工业科技,2012(4):410-416.
[3]马志红,陆忠兵,石碧;单宁酸的化学性质及应用[J].天然产物研究与开发,2003(1):88-89.
[4]陈笳鸿.我国没食子单宁化学利用现状与展望[J].林产化学与工业,2000,20(2):71-82.
[5]傅长明,黄科林,王则奋,王犇,张雪,慕朝师,孙果宋.植物单宁的性质及应用[J].企业科技与发展,2010(22):57-60.
[6]Akira N,Takashi S,Uptake and recovery of Gold by immobilized persimmon tannin[J].Journal of Chemical Technology and Biotechnology,1993,57:321-326.
[7]Gali H U,Perchellet E M,et al Antitumor-promoting effects of gallotanins extracted from various sources in mouse skin in vivo[J].Chemical Abstrats,1994,120(110):46.
[8]良武,吴在篙,陈笳鸿等单宁在抗艾滋病研究中的应用.林产化工通,1998,32(2):11-15.
[9]魏海峰.单宁酸对实验性糖尿病大鼠肾脏病变的改善作用及其机制的研究[D].长春:吉林大学,2010:24-28.
[10]胡鹏刚,刘强.高纯食品鞣酸在啤酒中的应用[J].酿酒科技,2004(3):61.
[11]黄国柱.用单宁酸预防黄酒非生物混浊的研究[J].酿酒科技,2002(5):67-68.
[12]刘一健,孙剑锋,王颉.葡萄酒酚类物质的研究进展[J].中国酿造,2009(8):8.
[13]柯发敏,张开莲.没食子酸的研究进展[J].泸州医学院学报,2011,34(4):440-442.
[14]吴雪钗,于波涛,侯艾林,胡婷婷,陆国庆.没食子酸稳定性研究[J].西南国防医药,2006,16(5):484-485.
[15]BertelliAA,GiovanniniL,StradiR,el a1.Plasma.urine and tissueleve18 of rtans—and cisresveratmL(3,4,5一trihydmxystilbene)after short—term or Prolonged administration of red wine to rats[J].Int JTissue React,1996(18):67-71.
[16]Mazza G.Anthecyanins in grapes and grape products[J].Crit Rev Food Sei Nutr,1995(35):34-371.
[17]Marco Vinicio Ramirez—Maresl,Sonia Chandra,Elvira Consalez de Mejia.In vitro chemopreventive activity of Camellia sinensis,llex paraguariensis and Ardisia compressa tea extracts and selected polypHenoh[J].Mutation Research,2004(554):53-65.
[18]Latha R,Daisy P,Insulin-secretagogue,antihyperlipidemic and other protective effects of gallic acid isolated from Terminalia bellerica Roxb.in streptozotocin-induced diabetic rats[J].Chem-Biol Interact,2011,189:112-118.
[19]刘国卿,王秋娟,杨宏健,等.野葡萄成分没食子酸的药理研究[J].南京药学院学报,1983,22(2):43-47.
[20]高雅,李骅,王四旺,等.没食子酸的药理作用及其药物代谢动力学研究进展[J].西北药学杂志,2014,29(4):435-438.
[21]郭佳莉,李国清,蔡英卿,刘燕兰.高效液相色谱法测定余甘子中单宁酸的含量[J].光谱实验室.2007,24(5):911-913.
(收稿日期:2015-03-23)
