动物iPS 细胞研究进展
2015-06-11方月琴朱少晖汤俊梅陆豪杰
方月琴,朱少晖,汤俊梅,陆豪杰
(江苏苏州健雄职业技术学院生物与化学工程系,江苏苏州215411)
诱导性多能干细胞(induced pluripotent stem cells,iPS细胞)技术是通过外源性导入特定的转录因子,将已分化的细胞重编程回归到胚胎细胞状态。Takahashi K 等[1]通过大量试验,在多种转录因子中 筛 选 得 出Sox2、Klf4、Oct4 和c-Myc(简 称SKOM)这4种转录因子,成功将小鼠皮肤成纤维细胞重编程回到类似胚胎干细胞(embryonic stem cell,ES细胞)的一种细胞类型,称为iPS细胞。iPS细胞具有自我更新能力和分化潜能,其功能与ES细胞类似,因此无需制造胚胎,理论上从任何组织的成体细胞都可制造出具有干细胞功能的细胞,在科研工作中避免了胚胎研究所面临的伦理学问题,成为生命科学领域的一次巨大革命[2]。经过多年的快速发展,iPS细胞技术在各个相关领域都取得了重大进展,本文将从iPS细胞技术制备动物细胞系和动物个体两方面,关注该技术的研究进展。
1 iPS细胞技术建立动物细胞系
1.1 啮齿类动物
1.1.1 小鼠 Takahashi K 等[1]利用逆转录病毒载体pMXs携带SKOM 4种转录因子,通过PLATE细胞制备高滴度病毒颗粒,感染小鼠皮肤成纤维细胞,经过3 周左右的培养出现拥有正常核型、与ES细胞有同样细胞表面标记,且具有能够向3个胚层发育潜能的iPS细胞。这项技术引起了科学界的轰动,引发热议[2]。然而利用病毒载体为媒介进行感染虽然具有高效稳定表达、较高的转化效率等优点,但是逆转录病毒会插入靶细胞基因组中,增加了外源性基因的导入机会,甚至激活原宿主染色体上的癌基因,可能会在后续的长期试验中出现不可预知的现象[3]。鉴于此,很多科研团队开始寻求无病毒的基因导入方法。最早制备无病毒小鼠iPS细胞的是Okita K 团 队[4],在 小 鼠 胚 胎 成 纤 维 细 胞(mouse embryonic fibroblast cells,MEF)中转染2种质粒,其中一种携带Oct3/4、Sox2 和Klf4 的cDNA 序列,另一种携带c-Myc的cDNA 序列。所获得的iPS细胞移植到免疫缺陷小鼠体内长出三胚层畸胎瘤,表明了iPS细胞的多能性。但是与病毒感染方法相比,该方法iPS细胞生成效率降低约100倍(经典病毒感染获得iPS 效率为0.1%左右[1])。为提高试验成功率与工作效率,Keisuke K 等[5]采用一个载体同时表达SKOM 基因,并与piggyBac转座子基因介导相结合,高效制备了无病毒小鼠iPS细胞;获得iPS细胞后,又成功将先前导入的转录因子基因从iPS细胞中移除。这一过程就保证了所获得的iPS细胞基因组与初始细胞是完全一致的。同时,平均转化效率达2.5%,相比经典方法提高了25倍。此外,小分子化合物的发现与引入大大提高了iPS细胞的制备效率,还能在制备过程中避免引入遗传物质,提高iPS细胞的安全性[6]。
作为最常用的模式动物,小鼠被选作iPS 细胞系建立的第一种动物,并在之后iPS细胞技术的发展里程碑中功不可没。经过将近10年的发展,iPS细胞技术取得了长足的发展,为应用于生物医学、动物学等领域的研究奠定了坚实的科研基础。
1.1.2 大鼠 小鼠和人iPS细胞早在2006年就已获得,Li W 等[7]在重编程过程中引入化学因子,大鼠iPS细胞系才真正建立。该小组通过逆转录病毒载体将4种因子转染入大鼠肝上皮细胞,在MEF饲养层细胞上,利用传统的小鼠ES 细胞培养基培养10d后,能够获得碱性磷酸酶阳性、类似小鼠ES细胞的克隆,传代后细胞迅速分化,失去ES 细胞形态,说明传统的小鼠ES 细胞培养条件可能不足以维持大鼠iPS细胞的多能状态。试验发现,在ES细胞培养基中添加一些试验证明可抑制分化、支持ES细胞自我更新的小分子物质,包括PD0325901,CHIR99021和A-83-01,可获得大鼠iPS细胞;并经试验证明具有向3个胚层分化的潜能。
随后其他研究团队也成功获得了大鼠iPS 细胞[8]。相对于小鼠,大鼠更适合于生理学和行为学的研究,因此大鼠iPS细胞系的建立为这些方向的研究扩大了科研基础,并为其他啮齿类动物提供了试验对照与参考。
1.2 非人类的灵长类动物
继小鼠iPS细胞系的成功建立,邓宏魁教授实验室于2008 年率先报道建立了恒河猴iPS 细胞系[9]。首先利用逆转录病毒载体pMX 携带4种转录因子,制备病毒悬液;将病毒悬液浓缩30倍,感染成年雄性恒河猴的耳部皮肤来源成纤维细胞,6d后成纤维细胞出现初步的形态改变,再将其转移至MEF细胞上,并将培养液改为ES 细胞培养基,经26d~29d后出现ES细胞样克隆。经分子与蛋白水平检测,该iPS细胞与猴ES细胞具有同样的基因表达,并在体内、体外试验中表现出向3个胚层分化的潜能。狨猴[10]、黑猩猩[11]等灵长类动物都建立了相应的iPS 细胞系。作为与人类最接近的模式动物,大部分人类疾病可建立恒河猴疾病模型;而灵长类动物iPS细胞的成功制备,对于人类疾病的发生机理与治疗研究具有深远的意义,并可作为人类进化研究的工具[12];同时对于其他珍稀物种,如金丝猴的保护也提供了新思路。
1.3 有蹄类动物
迄今为止,已获得小鼠、大鼠、猴和人类4种ES细胞系;而所有有蹄类家畜的ES细胞系尚未建立。但是家畜,如猪的体型和器官与人类相似,可作为研究人类疾病的良好模型及器官移植的来源,因此建立家畜ES细胞或iPS细胞系有重要的应用价值。
Wu Z等[13]完成了猪iPS细胞系的建立。该小组首先采用携带4种转录因子的逆转录病毒载体制备相应的病毒感染猪成体细胞,但是以失败告终。之后采用慢病毒方法,选择一含多西环素药物诱导基因的慢病毒载体,并在载体中克隆入6种转录因子(SKOM,Nanog 和Lin28),在多西环素存在时,这6种基因得以表达。收集表达转录因子的慢病毒载体感染丹麦长白猪耳朵成纤维细胞或骨髓细胞,2 d后将细胞转移至MEF,3d 时换成ES 细胞培养基。转染7d后开始出现类似人ES细胞;13d克隆变大,并有明显边界。试验表明,猪iPS 细胞与人ES细胞有相似的形态与表达标记。与此同时,Esteban M A 等[14]建立了西藏小型猪的iPS细胞系,试验采用逆转录病毒载体携带4种人或小鼠的转录因子,感染猪胚胎成纤维细胞8d~10d后,均出现类似人ES细胞克隆。与其他报道不同的是,培养细胞温度设置为39 ℃,即猪的生理体温,这可能影响iPS细胞生成效率。相比于其他动物来源iPS细胞,猪iPS细胞具有正常核型,表达高水平的ES细胞标记,可分化成含3个胚层的畸胎瘤,可以说更接近于人ES细胞的特点。迄今为止,已有多个团队成功获得猪iPS细胞[15]。此后,研究者相继制备了马[16]、牛[17]等的iPS细胞。而北非白犀牛iPS细胞系的建立[18],也为濒临灭绝珍稀动物的保存和生物多样性的保护提供了新方法。除以上动物,鸡[19]、蝙蝠[20]等的iPS细胞也已建立,说明该技术可广泛适用于多种物种,为其他动物iPS细胞建系提供了借鉴,并为珍稀动物物种保护,以及当前非常困难的转基因大动物模型的建立,提供了宝贵的实验室基础与科研新思路。然而,虽然早在2007 年已证实iPS细胞能够嵌合到生殖嵴[21],说明其具有一定的多能性,但是iPS细胞一直未能通过四倍体补偿试验,即鉴定多能性细胞发育能力的黄金标准[22]。因此,如何将成功建立的动物iPS细胞系转化成相应的动物个体,是一项更为复杂的挑战。迄今iPS细胞来源的小鼠、大鼠和猪已制备成功。
2 制备iPS细胞来源动物个体
iPS细胞与ES细胞一样具有自我更新和分化能力,并规避了转基因所面临的伦理学问题;此外,在转基因动物研究中,将iPS细胞技术与动物转基因技术相结合,可大大简化转基因动物的制备过程。比如,作为转基因的靶细胞,通过转基因技术将外源基因导入iPS细胞;或是利用iPS 细胞作为核供体细胞,同适当的受体细胞融合后直接获得转基因动物。也可以针对iPS细胞进行基因打靶或基因敲除等遗传修饰,从而根据人的意愿实现iPS细胞内基因改造,然后将其注入囊胚腔获得嵌合体后代,以高效、定向地制备转基因动物。目前利用iPS细胞获得成体小鼠、大鼠和猪即是通过这些方法。
2.1 iPS细胞来源成体小鼠
Zhao X Y 等[23-24]报 道 获 得 了iPS 细 胞 来 源 的成体小鼠,这是世界上首例完全由iPS细胞制备的活体小鼠,证实了完全重编程的iPS细胞具有与ES细胞同样的发育全能性。iPS细胞来源成体小鼠制备过程分为两个阶段。第一阶段是制备小鼠iPS细胞。Zhao X Y 等[23]在制备iPS细胞过程中,首先通过2次感染提高感染效率,并在之后的培养液中利用Knockout血清替代物(Knockout serum replacement,KOSR)取代FBS以提高小鼠胚胎的建系效率及加速iPS细胞形成进程,并分别在第14天、第20天和第36天提取克隆。经分析,所获得的iPS细胞能够表达多能性标记,如Oct4、Nanog及SSEA1,具有正常的染色体核型;将iPS细胞注射入裸鼠后对产生的畸胎瘤进行组织学检测,发现能够产生完整的3个胚层。之后是第二阶段,利用四倍体补偿试验培育小鼠。先将选中的iPS细胞注射到小鼠四倍体囊胚,观察胚胎发育到期情况,最终第14天挑取的iPS细胞获得了37只到期小鼠;而第20天和第36天挑取的iPS细胞很难获得小鼠。该试验所获得的iPS细胞四倍体补偿小鼠已经通过繁殖获得了上百只子代及第3代,并存活超过57周。以上试验证明iPS细胞可被完全重编程,能够分化为躯体的各种组织细胞,具有与ES细胞同样的全能性,为iPS细胞技术的应用提供了理论基础。
另一方面,重编程过程中原癌基因c 大肠杆Myc因子的存在会很大程度上增加iPS细胞嵌合小鼠肿瘤发生几率。研究发现,可只引进Oct4、Sox2和Klf4 制备iPS 细胞,只是其生成效率会有所降低[25]。为验证三因子iPS 细胞是否同样具有全能性,Kang L 等[26]制备了小鼠三因子iPS细胞,之后利用四倍体补偿方式也获得了活体小鼠,从而证实不存在c-Myc因子的情况下所获得的iPS细胞仍具有同样的分化潜能,为iPS细胞技术的安全应用进一步奠定了基础。
2.2 iPS细胞来源转基因大鼠
Li W 等[7]报道建立大鼠iPS细胞系时,就已获得大鼠iPS细胞来源的嵌合体大鼠,但尚未检测出其生殖能力。之后,Hamanaka S 等[27]通过逆转录病毒载体介导,在Wistar(WI)大鼠和DA 大鼠胚胎成纤维胞内导入3种小鼠转录因子(Oct3/4,Klf4和Sox2),转染1d后在培养基中加入大鼠白血病抑制因子(leukemia inhibitory factor,LIF),第7天在培养基中加入小分子物质(PD0325901,CHIR99021或SU5402),第10天时可出现类似ES细胞的大鼠iPS细胞克隆,并已传代超过25代。之后将其注入WI/WI大鼠囊胚中,最终WI来源iPS细胞获得了具有遗传性能的嵌合体大鼠(图1),图1中riPS为大鼠iPS细胞;Microinjection 为显微注射;WI×WI rat blastocytes为WI大鼠和WI大鼠囊胚;Transfer为移植;Foster mother为代孕妈妈;Chimeric rat为嵌合体大鼠;male为雄性;wt-female WI rat为野生型的 雌 性WI 大 鼠;Transgenic rats from germline transmission为通过生殖系遗传获得的转基因大鼠。Jiang M G 等[28]在iPS细胞制备过程中除LIF和小分子物质之外,还加入Vc和KOSR 以提高iPS细胞生成效率,并将大鼠品系扩展到DA,SD 和F344大鼠,也获得了大鼠iPS细胞及具有遗传能力的iPS细胞来源转基因大鼠。
除了iPS细胞来源大鼠和小鼠之外,大鼠-小鼠种间嵌合体也成功获得,比如将大鼠iPS细胞注入小鼠囊胚内,在小鼠体内长出大鼠胰腺组织[29]。这可应用于临床医学,如在猪等动物体内生长目的器官,之后再移植给患者,为器官移植提供了选择;还标志着将iPS细胞技术与转基因动物技术相结合,打破物种界限,克服种间繁殖障碍,从而获得用传统方法无法得到的新性状,为新品种培育等转基因动物研究提供了试验基础。
2.3 iPS细胞来源猪
继iPS细胞来源小鼠、大鼠的成功获得,科学家将目光转移至iPS克隆猪,因为猪的解剖、生理与遗传等方面与人具有高度的相似性。Fan N N 等[30]获得了iPS细胞来源小猪,分别用慢病毒转染和逆转录病毒方法转染10周大小丹麦长白猪的耳皮肤成纤维细胞和骨髓细胞,以及猪胚胎成纤维细胞,制备了6株iPS细胞株。直接将这些iPS细胞株作为核移植的供体细胞,利用传统的克隆方法或者手工克隆方法,克隆至代孕母猪体内,虽有部分母猪得以怀孕,但是最终都未能成功分娩得到活小猪。分析原因可能是这些外来转录因子未能得以沉默,阻碍了胚胎的顺利发育。研究人员采用了两种方法,将iPS细胞分化4d~6d,使细胞退出快速的细胞周期,再作为核转移的供体细胞;将核转移细胞处以0.5mmol/L浓度Scriptaid,这是一种人工合成低毒性的组蛋白去乙酰化酶抑制剂,可提高克隆胚胎的发育能力。经过以上两种处理,发现核移植后体外发育囊胚率由原来的5%提高到20%左右。随后经分化处理的细胞利用传统的克隆方法转移至代孕母猪体内,经114d怀孕获得1头小猪;而经Scriptaid处理的细胞,利用手工克隆方法转移,经110d怀孕得到4头小猪。但是这些小猪出生后生存时间均较短,前者出生后36d被发现患脑脊髓炎而死亡;经Scriptaid处理得到的4头小猪,其中1头刚出生即死亡,另3头分别仅存活了4、14、36d(图2),图2中piPS为猪诱导性多能干细胞,TC 为传统克隆法,HMC为手工克隆法,Surrogated mother为代孕母猪。大量研究表明核移植过程中可能存在一些因素会造成克隆动物的死亡,由此揭示要获得健康的iPS克隆猪要求更优化的核移植操作,以及在代孕母体内移植更多数量的胚胎。通过iPS细胞技术获得健康克隆猪还有很长的路要走。
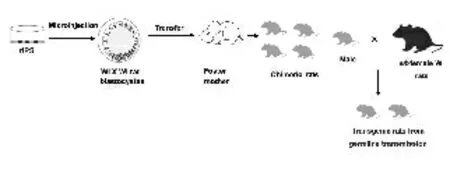
图1 iPS细胞技术制备转基因大鼠Fig.1 Scheme depicting the generation of transgenic rats from iPS cell lines
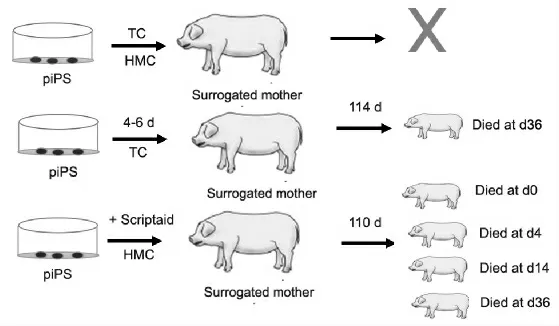
图2 iPS细胞技术制备活体猪Fig.2 Scheme depicting the generation of viable pigs from iPS cell lines
在过去的10年内,iPS细胞技术得到了前所未有的发展与深入研究,在生命科学相关领域取得了许多重大突破。目前,多种动物来源iPS细胞已制备成功,包括啮齿类、灵长类、有蹄类等动物,这对于人类疾病的发生机理与治疗、人类进化研究等具有深远的意义。并且iPS细胞来源的小鼠、大鼠和猪也成功获得,可以说在转基因动物育种上,iPS细胞技术具有潜在的应用前景,很可能替代传统的体细胞核移植,克服大动物难以获得胚胎干细胞系的难题;同时又合理规避了当前在转基因动物研究过程中存在的伦理学问题,为转基因研究开创了更为广阔的天地。但是该技术总体来说仍处于起步阶段,尚有许多问题亟待解决,如何同时提高iPS细胞的安全性和制备效率,如何提高iPS细胞来源动物的成功率和成活率等。随着研究的不断深入,这些问题都会得到解决,并将进一步促进动物转基因技术的发展。
[1] Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[2] Diecke S,Jung S M,Lee J,et al.Recent technological updates and clinical applications of induced pluripotent stem cells[J].Korean J Untern Med,2014,29(5):547-557.
[3] Knight S,Collins M,Takeuchi Y.Insertional mutagenesis by retroviral vectors:current concepts and methods of analysis[J].Curr Gene Ther,2013,13(3):211-227.
[4] Okita K,Nakagawa M,Hyenjong H,et al.Generation of mouse induced pluripotent stem cells without viral vectors[J].Science,2008,322(5903):949-953.
[5] Keisuke K,Katherine N,Agnieszka P,et al.Virus free induction of pluripotency and subsequent excision of reprogramming factors[J].Nature,2009,458(7239):771-775.
[6] Higuchi A,Ling Q D,Kumar S S,et al.Generation of pluripotent stem cells without the use of genetic material[J].Lab Invest,2015,95(1):26-42.
[7] Li W,Wei W,Zhu S,et al.Generation of rat and human induced pluripotent stem cells by combining genetic reprogramming and chemical inhibitors[J].Cell Stem Cell,2009,4(1):16-19.
[8] Takenaka-Ninagawa N,Kawabata Y,Watanabe S,et al.Generation of rat-induced pluripotent stem cells from a new model of metabolic syndrome[J].PLoS One,2014,9(8):e104462.
[9] Liu H,Zhu F,Yong J,et al.Generation of induced pluripotent stem cells from adult rhesus monkey fibroblasts[J].Cell Stem Cell,2008,3(6):587-590.
[10] Debowski K,Warthemann R,Lentes J,et al.Non-viral generation of marmoset monkey iPS cells by a six-factor-in-onevector approach[J].PLoS One,2015,10(3):e0118424.
[11] Fujie Y,Fusaki N,Katayama T,et al.New type of Sendai virus vector provides transgene-free iPS cells derived from chimpanzee blood[J].PLoS One,2014,9(12):e113052.
[12] Wunderlich S,Kircher M,Vieth B,et al.Primate iPS cells as tools for evolutionary analyses[J].Stem Cell Res,2014,12(3):622-629.
[13] Wu Z,Chen J,Ren J,et al.Generation of pig-induced pluripotent stem cells with a drug-inducible system[J].J Mol Cell Biol,2009,1(1):46-54.
[14] Esteban M A,Xu J,Yang J,et al.Generation of induced pluripotent stem cell lines from Tibetan miniature pig[J].J Biol Chem,2009,284(26):17634-17640.
[15] West F D,Uhl E W,Liu Y,et al.Brief report:chimeric pigs produced from induced pluripotent stem cells demostrate germline transmission and no evidence of tumor formation in young pigs[J].Stem Cells,2011,29(10):1640-1643.
[16] Nagy K,Sung H K,Zhang P,et al.Induced pluripotent stem cell lines derived from equine fibroblasts[J].Stem Cell Rev,2011,7(3):693-702.
[17] Hu P F,Guan W J,Li X C,et al.Construction of recombinant proteins for reprogramming of endangered Luxi cattle fibroblast cells[J].Mol Biol Rep,2012,39(6):7175-7182.
[18] Ben-Nun I F,Montague S C,Houck M L,et al.Induced pluripotent stem cells from highly endangered species[J].Nat Meth,2011,8(10):8298-8231.
[19] Intarapat S,Stern C D.Chick stem cells:Current progress and future prospects[J].Stem Cell Res,2013,11(3):1378-1392.
[20] Mo X,Li N,Wu S.Generation and characterization of batinduced pluripotent stem cells[J].Theriogenology,2014,82(2):283-293.
[21] Okita K,Ichisaka T,Yamanaka S.Generation of germlinecompetent induced pluripotent stem cells[J].Nature,2007,448(7151):313-317.
[22] Jaenisch R,Young R.Stem cells,the molecular circuitry of pluripotency and nuclear reprogramming[J].Cell,2008,132(4):567-582.
[23] Zhao X Y,Li W,Lv Z,et al.iPS cells produce viable mice through tetraploid complementation[J].Nature,2009,461(7260):86-90.
[24] Kang L,Wang J,Zhang Y,et al.iPS cells can support fullterm development of tetraploid blastocyte-complemented embryos[J].Cell Stem Cell,2009,5(2):135-138.
[25] Nakagawa M,Koyanagi M,Tanabe K,et al.Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts[J].Nat Biotechnol,2008,26(1):101-106.
[26] Kang L,Wu T,Tao Y,et al.Viable mice produced from three-factor induced pluripotent stem(iPS)cells through tetraploid complementation[J].Cell Res,2011,21(3):546-549.
[27] Hamanaka S,Yamaguchi T,Kobayashi T,et al.Generation of germline-competent rat induced pluripotent stem cells[J].PLoS One,2011,6(7):e22008.
[28] Jiang M G,Li T D,Feng C J,et al.Generation of transgenic rats through induced pluripotent stem cells[J].J Biol Chem,2013,288(38):27150-27158.
[29] Kobayashi T,Yamaguchi T,Hamanaka S,et al.Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells[J].Cell,2010,142(5):787-799.
[30] Fan N N,Chen J J,Shang Z C,et al.Piglets cloned from induced pluripotent stem cells[J].Cell Res,2013,23(1):162-166.
