他莫昔芬对糖尿病大鼠心肌CD147糖基化与MMPs的影响*
2015-06-09王艺璇高云涛崔龙彪茹凝玉张海军余志斌
王艺璇, 高云涛, 崔龙彪, 茹凝玉, 张海军, 焦 博, 余志斌
(第四军医大学航空航天医学教育部重点实验室, 第四军医大学航空航天生理学教研室, 西安 710032)
他莫昔芬对糖尿病大鼠心肌CD147糖基化与MMPs的影响*
王艺璇+, 高云涛+, 崔龙彪, 茹凝玉, 张海军, 焦 博, 余志斌△
(第四军医大学航空航天医学教育部重点实验室, 第四军医大学航空航天生理学教研室, 西安 710032)
目的:阐明糖尿病性心肌病的形成机制。方法:将40只大鼠分为对照组和对照+他莫昔芬组(n=8)、糖尿病组与糖尿病+他莫昔芬组(n=12)。采用链脲佐菌素诱导的糖尿病大鼠模型,观测心肌CD147表达与糖基化程度的变化,以及对基质金属蛋白酶(MMPs)表达与活性的影响,同时观测他莫昔芬(tamoxifen)的作用。结果:在成功建立糖尿病大鼠模型基础上,观测到分布于心肌细胞膜的CD147,在糖尿病大鼠心肌表达与糖基化程度明显增高。糖尿病大鼠心肌MMP-2蛋白表达增加,MMP-2与MMP-9活性均明显增加。他莫昔芬对糖尿病大鼠心肌CD147的表达与糖基化均有抑制作用,且对糖基化的抑制明显强于对表达的作用。心肌CD147糖基化程度与MMPs的活性呈正相关。他莫昔芬对对照组与糖尿病大鼠心肌MMP-2与MMP-9的活性均具有抑制作用。结论:糖尿病大鼠心肌CD147表达特别是糖基化程度增加,导致MMPs活性增加,加速心肌病理性重塑而诱发心肌病。而他莫昔芬通过抑制心肌CD147糖基化的增加,进而抑制MMPs活性,减缓心肌的病理性重塑,对糖尿病心肌产生保护作用。
糖尿病性心肌病;他莫昔芬;CD147;糖基化;基质金属蛋白酶
近年来糖尿病特别是2型糖尿病发病率呈现快速增长的趋势,仅我国20岁以上人群中男性和女性糖尿病的患病率分别达10.6%和8.8%,总体患病率已达9.7%,糖尿病前期的患病率高达15.5%。据此患病率推算我国总糖尿病患病人数超过9 200万,糖尿病前期人数达1.48亿以上[1]。糖尿病已经成为继肿瘤、心脑血管疾病之后威胁人类健康的第三大非传染性疾病。在缺乏高血压与冠脉血管事件的前提下,糖尿病患者出现左心室肥厚与舒张功能损伤,呈现心力衰竭综合征,被称为糖尿病性心肌病(diabetic cardiomyopathy)[2]。关于形成糖尿病性心肌病的病理生理学机制,虽然涉及心肌细胞信号转导通路改变、代谢与线粒体功能改变、结构与信号蛋白的翻译后修饰改变、细胞内稳态变化以及基因调控改变等多个方面,但确切的机制并未完全阐明[3]。阐明糖尿病性心肌病的病理生理学机制,不仅为临床防治提供理论依据,而且为药物治疗提供新靶点。糖尿病性心肌病早期呈现心肌硬度增加,从而导致心脏舒张功能受损。有研究发现糖尿病大鼠心肌基质金属蛋白酶(matrix metalloproteinase, MMP)2表达与活性降低,可能是心肌纤维化程度增加的原因[4]。在糖尿病心肌,何种因素可影响MMPs的表达与活性呢?心肌细胞的乳酸与丙酮酸代谢活跃,所以,心肌细胞膜上具有丰富的单羧酸转运体表达,CD147为协助单羧酸转运体装配于细胞膜的重要分子。CD147常被称为细胞外基质金属蛋白酶诱导因子。大量研究表明,CD147可诱导MMP-1、MMP-2、MMP-3、MMP-9和MMP-11的分泌[5]。
为了观察糖尿病大鼠心肌CD147表达与糖基化程度的变化和这种变化对MMP-2与MMP-9的影响,以及选择性雌激素受体调节剂他莫昔芬的保护作用,本实验旨在为糖尿病心肌病的防治提供有价值的实验数据。
1 材料与方法
1.1 糖尿病大鼠模型的制备
SD大鼠40只(雌雄不拘)由第四军医大学实验动物中心提供,体重200~250 g,由专人单笼饲养,室内湿度 50%左右,温度保持在25℃左右,明暗周期12 h∶12 h,自由饮水和进食。适应性喂养1 周后进行分组饲养。随机分为四组:对照组(CON)、对照+他莫昔芬组(CON+Tam)、糖尿病组(Dia)、糖尿病+他莫昔芬组(Dia+Tam),前两组每组8只大鼠,后两组每组12只大鼠;各组取建模成功的大鼠6只进行数据分析。糖尿病大鼠模型的制备参照Talpur N 等方法并加以改进[6],采用高脂饲料联合小剂量单次腹腔注射链脲佐菌素(streptozotocin, STZ),制备具有胰岛素抵抗的糖尿病动物模型。饲料配制:普通饲料为第四军医大学实验动物中心配制的常规饲料,总热量为13.53 kJ/g 。高脂饲料于喂养前一周临时配制,总热量为18.71 kJ/g。分组处理:(1)CON组:普通饲料喂养4周后,腹腔注射枸橼酸-枸橼酸钠缓冲液作对照,继续普通饲料喂养,并每日蒸馏水灌胃;(2)CON+Tam组:普通饲料喂养4 周后,腹腔注射枸橼酸-枸橼酸钠缓冲液作对照,继续普通饲料喂养,并每日他莫昔芬(2 mg/kg)灌胃;(3)Dia组:高脂饲料喂养4 周后,腹腔注射STZ(25 mg/kg体重),继续高脂饲料喂养,并每日蒸馏水灌胃;(4)Dia+Tam组:高脂饲料喂养4 周后,腹腔注射STZ(25 mg/kg),继续高脂饲料喂养,并每日他莫昔芬(2 mg/kg)灌胃。4 周后取各组动物尾静脉血监测血糖水平,以2 次随机血糖≥16.7 mmol/L作为糖尿病模型成功的标志。
1.2 Western blot检测CD147与MMP蛋白的表达
按照本实验室已建立的方法进行[7],主要步骤如下:戊巴比妥钠(40 mg/kg)经腹腔注射麻醉大鼠,迅速摘取心脏。称取30 mg左心室组织,加入600 μl匀浆缓冲液(50 mmol/L Tris-HCl,pH 7.40,0.1% TritonX-100, 1 mmol/L EDTA, 50 mmol/L NaF, 10 mmol/L β-磷酸甘油,5 mmol/L 焦磷酸钠,0.2 mmol/L Na3VO4,200 μmol/L PMSF),制备匀浆。两份体积匀浆液加入1份体积的3×上样缓冲液(30 mmol/L Tris-HCl,pH 6.8,6% SDS,0.3% 溴酚蓝,30%甘油,3% β-巯基乙醇)。采用SDS-不连续聚丙烯酰胺凝胶电泳(SDS-PAGE)系统(美国Bio-Rad公司MINI-PROTEIN垂直电泳槽)分离心肌蛋白,10%的Laemmli分离胶及4%积层胶。于20 mA下行恒流电泳,结束电泳取出凝胶,置于转膜缓冲液(48 mmol/L Tris-base,39 mmol/L Glycine,0.037% SDS,20%甲醇)中浸泡15 min,行半干式转膜(20 V,15 min)。转膜完毕取出PVDF膜放入封闭缓冲液(1% BSA+TBS)中室温摇动30 min。将一抗按比例[anti-CD147(Abcam),1∶1 000;anti-MMP-2(Abcam), 1∶1 000;anti-GAPDH(Sigma), 1∶2 000]用稀释液(0.1%BSA+TBS)稀释,4℃摇动过夜。一抗孵育结束后,将PVDF膜用弱洗缓冲液(0.1%Tween-20+PBS)清洗3次,每次10 min,然后用TBS(20 mmol/L Tris-HCl,pH 7.4,137 mmol/L NaCl,2.7 mmol/L KCl)清洗2次,每次5 min。耦联红色荧光的抗兔二抗及耦联绿色荧光的抗鼠二抗按比例(1∶10 000)用稀释液(0.1%BSA+0.1%Tween-20+PBS)稀释,PVDF膜用弱洗缓冲液清洗3次,每次10 min,PBS(137 mmol/L NaCl,2.7 mmol/L KCl,8.1 mmol/L Na2HPO4,1.47 mmol/L KH2PO4)清洗2次,每次5 min。使用Odyssey红外扫描仪(Li-Cor, USA),选择合适的激发波长(anti-rabbit, 700 nm; anti-mouse, 800 nm)对PVDF膜进行扫描。利用Image软件对图像密度进行分析,选择目标条带,测定条带光密度,并用Origin 8软件对蛋白进行半定量分析。GAPDH蛋白条带作为内参照,表明各道上样量基本相同。目标蛋白条带光密度除以GAPDH蛋白条带光密度即为该目标蛋白的相对表达水平。
1.3 明胶酶谱电泳测量MMPs相对活性
称取一定量的心脏组织,在冰上按1 mg∶5 μl的比例加入匀浆缓冲液(80 mmol/L KCl,20 mmol/L Tris-HCl,5 mmol/L EGTA,pH 7.6)。聚丙烯酰胺凝胶电泳中的分离胶加入明胶,明胶最终浓度为1 mg/ml(0.1%)。采用8%的Laemmli分离胶(含有明胶)及4%积层胶。每道上样孔加样约20 μg蛋白质样品,直接上样,蛋白不经加热处理。在80 V恒压下在冰上进行电泳,30 min后,当样品进入分离胶后,将电压调至120 V,当溴酚蓝刚从凝胶底部跑出时结束电泳,取出凝胶。在溶液(50 mmol/L Tris-HCl,100 mmol/L NaCl, 2.5% Triton X-100, pH 7.6)中洗两次(摇床上不断摇动),每次30 min,在双蒸水中洗3次,共15 min。之后加入明胶孵育缓冲液(50 mmol/L Tris-HCl,10 mmol/L CaCl2,1 mmol/L ZnCl2和0.02% NaN3),37℃孵育过夜。0.5%考马斯亮蓝染液染色30 min后,用脱色液(10%甲醇和5%乙酸)脱色,直到蓝色背景上出现白色条带,拍照与半定量分析MMPs的相对活性。
1.4 免疫荧光组织化学染色观测CD147在心肌细胞的分布特征
各组动物腹腔注射戊巴比妥钠麻醉,经腹主动脉依次逆行灌注20 ml生理盐水和50 ml 4%多聚甲醛PBS液(pH 7.4)。摘取心脏,4%多聚甲醛继续固定12 h,再置入30%蔗糖PBS溶液(pH 7.4)中,4℃保存。待心脏沉底后切10 μm厚冰冻切片,丙酮固定15 min,PBS液清洗切片3次,每次5 min。用含1% BSA的PBS液封闭1 h。每张片子加入1∶50稀释的一抗(anti-CD147)液100 μl,置于湿盒4℃过夜。用PBS液洗去一抗后,加入1∶400稀释的荧光二抗100 μl(4℃),室温避光放置1 h后,用PBS液洗去二抗,每次5 min共三次。再加入100 μl的Hoechst33258衬染细胞核(1∶100)。用PBS液清洗切片后,甘油封片,在激光共聚焦显微镜(confocal,OLYMPUS FV1000)60倍水镜下观察,所有图片扫描拍摄参数保持一致。
1.5 PHA荧光染料染色观测心肌细胞CD147糖基化程度
在冰冻切片上滴加用PBS按10 μg/ml稀释的植物凝集素PHA-L(Life Technologies),室温孵育15 min,PBS洗涤3次。Hoechst33258衬染细胞核(1∶100),PBS洗涤3次后,用荧光封片剂封片(0.01 mol/L PBS、2.5%DABCO、50%甘油)。激光共聚焦扫描显微镜60倍水镜成像,并采集图像。采用Image J软件对图像进行荧光强度定量分析[7]。
1.6 图像分析与数据统计
2 结果
2.1 糖尿病大鼠模型
对照组(CON)与对照加他莫昔芬处理组(CON+Tam)血糖保持在正常水平,糖尿病组(Dia)与糖尿病加他莫昔芬处理组(Dia+Tam)血糖均呈非常显著性升高(P<0.01),表明成功建立糖尿病模型。选用初始体重无显著差别的大鼠随机分成四组,四周后,与同步对照组(CON)相比,Dia病组大鼠体重呈非常显著降低(P<0.01);与CON+Tam组相比,Dia+Tam组大鼠体重亦呈显著性降低(P<0.01),但高于Dia组(P<0.05)。Dia组与Dia+Tam组大鼠心脏重量均低于CON组与CON+Tam组(P<0.05),但心脏重量与体重的比值却明显增大,这并非是心脏肥厚,而是体重降低的结果(表1)。
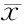

GroupBodyweight(g)Heartweight(mg)Heartweight/BodyweightBloodglucose(mmol/L)CON400.8±12.41444.3±29.33.3±0.15.3±0.3CON+Tam466.0±7.81264.9±44.63.0±0.15.7±0.3Dia1184.4±13.2**904.0±55.7*4.3±0.1*24.1±1.3**Dia+Tam211.6±16.0##782.8±57.8*3.7±0.1#26.0±1.9**
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsCON+Tam
2.2 心肌CD147表达水平与糖基化程度的变化
蛋白印迹结果表明:CON组与CON+Tam组心肌CD147表达未发生明显改变。Dia组心肌CD147表达明显增加(P<0.01),Dia+Tam组心肌CD147表达与CON组之间无显著性差别。与Dia组相比,Dia+Tam组心肌CD147表达受到显著抑制(P<0.01,图1,表2)。

Fig. 1 Expression of CD147 in left ventricular myocardium from the control (CON), control with tamoxifen treatment (CON+Tam), diabetes (Dia) and diabetes with tamoxifen treatment (Dia+Tam) rats
免疫荧光组织化学显示CD147分布于心肌细胞膜,CON组与CON+Tam组的表达水平较低;Dia组心肌细胞膜上CD147表达明显增加(P<0.01),他莫昔芬可显著性抑制CD147的表达并使之恢复对照水平(P<0.01,图2,表2,图2见彩图页Ⅰ)。
PHA-L可将糖基化CD147染为红色荧光,CON组与CON+Tam组心肌细胞红色荧光分布于细胞膜;在相同实验条件下,与CON组相比,CON+Tam组红色荧光呈显著性减弱(P<0.05)。Dia组则明显增强(P<0.01),可见横纹,表明横管中可能亦有CD147分布;相反,他莫昔芬处理后(Dia+Tam组),荧光强度明显降低(P<0.01,图3,表2,图3见彩图页Ⅰ)。


GroupRelativeCD147expressionRelativeCD147fluorescenceintensityRelativeglycosylatedCD147CON0.163±0.0121.000±0.0601.009±0.135CON+Tam0.157±0.0140.870±0.0620.627±0.047*Dia0.276±0.023**1.789±0.031**1.569±0.076**Dia+Tam0.181±0.008##1.007±0.062##0.753±0.061##
**P<0.01vscontrol;##P<0.01vsdiabetes
2.3 心肌MMPs表达与活性的变化
CON组与CON+Tam组之间,心肌MMP-2蛋白表达未见明显改变。与CON组相比,Dia组心肌MMP-2蛋白表达水平明显增加;他莫昔芬处理后,MMP-2蛋白表达水平与CON组间无显著差别(图4,表3)。采用明胶酶谱法观测MMP-2与MMP-9的活性,CON组呈现MMP-2与MMP-9两条带。他莫昔芬处理对照组心肌MMP-2与MMP-9活性明显降低。Dia组MMP-2与MMP-9呈非常显著增加(P<0.01),他莫昔芬处理则明显抑制糖尿病大鼠心肌MMP-2与MMP-9的活性(图5,表3)。

Fig. 4 Representative Western blot indicate expression of MMP-2 in left ventricular myocardium from the control (CON), control with tamoxifen treatment (CON+Tam), diabetes (Dia), and diabetes with tamoxifen treatment (Dia+Tam) rats MMP: Matric metalloproteinase
与CON组相比,CON+Tam组心肌MMP-2蛋白表达呈显著性降低(P<0.05)。与CON组相比,Dia组心肌MMP-2蛋白表达水平呈显著性增加(P<0.05);他莫昔芬处理后,MMP-2蛋白表达水平与CON组间无显著差别,表明对MMP-2表达具有抑制作用(图4,表3)。采用明胶酶谱法观测MMP-2与MMP-9的活性,与CON组相比,CON+Tam组心肌MMP-2与MMP-9相对活性均呈显著性降低(P<0.05)。Dia组MMP-2与MMP-9相对活性呈显著或非常显著增加(P<0.05,P<0.01),他莫昔芬处理(Dia+Tam组)则明显抑制糖尿病大鼠心肌MMP-2与MMP-9的活性(P<0.05,P<0.01,图5,表3)。

Fig. 5 Representative zymography indicates MMP-2 and MMP-9 activity of left ventricular myocardium in the control (CON), control with tamoxifen treatment (CON+Tam), diabetes (Dia), and diabetes with tamoxifen treatment (Dia+Tam) rats MMP: Matric metalloproteinase
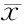

GroupRelativeMPP-2expressionRelativeMMP-2activityRelativeMMP-9activityCON0.477±0.0231.000±0.0831.000±0.037CON+Tam0.365±0.036*0.188±0.030*0.650±0.124*Dia0.562±0.032*1.634±0.116*3.920±0.020**Dia+Tam0.470±0.018#0.956±0.061#1.318±0.071##
MMP: Matric metalloproteinase
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsdiabetes
3 讨论
本实验在高脂饲料喂养大鼠基础上,采用单次STZ腹腔注射,成功建立糖尿病模型。糖尿病大鼠高血糖可激活心肌局部的血管紧张素合成系统,使心肌局部血管紧张素Ⅱ含量明显增高[8, 9]。高浓度血管紧张素Ⅱ可刺激心肌细胞合成CD147[10],另一方面,血管紧张素Ⅱ可激活心肌细胞内蛋白激酶C(PKC),PKC转位至高尔基体进而激活N-乙酰氨基葡萄糖转移酶V[11],而CD147分子的胞外段具有3个N-连接糖基化位点[12],在N-乙酰氨基葡萄糖转移酶V作用下加入聚乳糖形成不同程度的糖基化CD147分子[12]。低糖基化CD147的主要功能是协助单羧酸转运体装配。高糖基化的CD147则具有自我聚集和促进MMPs分泌的功能[13]。大量研究表明,CD147可诱导MMP-1、MMP-2、MMP-3、MMP-9和MMP-11的表达[5],因此,CD147为细胞外基质金属蛋白酶诱导因子。因MMP-2与MMP-9为明胶酶,便采用明胶酶谱法观测其活性,同时,两者亦具可降解间质胶原,对心肌间质重塑产生影响,故本实验观测这两种MMPs的表达与活性。糖尿病大鼠心肌MMP-2表达与活性均明显增加,因抗体原因,未能获得MMP-9的表达结果,但MMP-9的活性亦明显增加。这提示高糖基化CD147可诱导MMP-2与MMP-9活性增加,在糖尿病大鼠心肌间质重塑过程中发挥重要作用,可能成为诱发心力衰竭的机制之一。虽有研究报道糖尿病大鼠心肌MMP-2表达与活性降低[4],与本实验观测结果相反,可能是大鼠糖尿病的程度与观测时间不同而产生的影响,尚待深入的比较分析。
有大样本调查表明,糖尿病性心肌病存在明显的性别差异,女性糖尿病患者发生心肌病的发病率明显高于男性患者,其机制仍在调查之中[2]。本实验中采用他莫昔芬处理糖尿病大鼠,发现对心肌CD147表达与糖基化程度均有明显的抑制作用,另外,亦可抑制MMP-2与MMP-9的活性。进一步比较他莫昔芬的作用,可见对CD147糖基化程度的抑制作用明显强于对CD147表达的作用;心肌CD147糖基化程度与MMPs的活性呈明显的正相关关系。所以,CD147糖基化程度是影响糖尿病大鼠心肌间质重塑的重要因素。他莫昔芬为选择性雌激素受体调节剂,其实质是雌激素拮抗剂,能与雌二醇竞争性结合靶细胞内雌激素受体,从而阻断雌二醇的作用[14]。在心肌细胞中,他莫昔芬可抑制PKC活性[15],PKC经调节N-乙酰氨基葡萄糖转移酶V活性而减少高尔基体CD147糖基化程度。所以,在糖尿病大鼠心肌,他莫昔芬可能通过这条途径对心肌产生保护作用。但是,其深入的机制有待进一步验证。以上研究结果对糖尿病性心肌病的防治具有一定的参考价值,在糖尿病大鼠,可通过抑制雌激素受体,降低心肌CD147的表达与糖基化,并且降低MMP-2与MMP-2活性,从而减缓心肌病理性重塑,对糖尿病性心肌病具有一定的保护作用。
综上所述,本研究发现糖尿病大鼠心肌CD147表达与糖基化程度增加,进而诱导MMP-2与MMP-9活性升高,加速心肌病理性重塑,导致糖尿病性心肌病。他莫昔芬则可能通过抑制雌激素受体而抑制PKC活性,降低CD147糖基化程度而抑制MMP-2、MMP-9活性,对心肌产生保护作用。
[1] Yang W, Lu J, Weng J,etal. Prevalence of diabetes among men and women in China[J].NEnglJMed, 2010, 362(12): 1090-1101.
[2] Isfort M, Stevens SC, Schaffer S,etal. Metabolic dysfunction in diabetic cardiomyopathy[J].HeartFailRev, 2014, 19(1): 35-48.
[3] Bugger H, Abel ED. Molecular mechanisms of diabetic cardiomyopathy[J].Diabetologia, 2014, 57(4): 660-671.
[4] Van Linthout S, Seeland U, Riad A,etal. Reduced MMP-2 activity contributes to cardiac fibrosis in experimental diabetic cardiomyopathy[J].BasicResCardiol, 2008, 103(4): 319-327.
[5] Cao Z, Xiang J, Li C. Expression of extracellular matrix metalloproteinase inducer and enhancement of the production of matrix metalloproteinase-1 in tongue squamous cell carcinoma[J].IntJOralMaxillofacSurg, 2009, 38(8): 880-885.
[6] Talpur N, Echard B, Ingram C,etal. Effects of a novel formulation of essential oils on glucose-insulin metabolism in diabetic and hypertensive rats: a pilot study[J].DiabetesObesMetab, 2005, 7(2): 193-199.
[7] Yu ZB, Gao F, Feng HZ,etal. Differential regulation of myofilament protein isoforms underlying the contractility changes in skeletal muscle unloading[J].AmJPhysiolCellPhysiol, 2007, 292(3): C1192-1203.
[8] Kumar R, Yong QC, Thomas CM,etal. Intracardiac intracellular angiotensin system in diabetes[J].AmJPhysiolRegulIntegrCompPhysiol, 2012, 302(5): R510-R517.
[9] Fiordaliso F, Li B, Latini R,etal. Myocyte death in streptozotocin-induced diabetes in rats in angiotensin II-dependent[J].LabInvest, 2000, 80(4): 513-527.
[10]Aiello EA, De Giusti VC. Regulation of the cardiac sodium/bicarbonate cotransporter by angiotensin II: potential contribution to structural, ionic and electrophysiological myocardial remodelling[J].CurrCardiolRev, 2013, 9(1): 24-32.
[11]Guo HB, Shen ZH, Huang CX,etal. Modulation of the basal activity of phosphatidylinositol-3-kinase/proteinkinase B signaling pathway in human hepatocarcinoma cells[J].GlycoconjJ, 2000, 17(5): 315-322.
[12]Yu XL, Hu T, Du JM,etal. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion.[J].JBiolChem, 2008, 283(26): 18056-18065.
[13]Eyster CA, Higginson JD, Huebner R,etal. Discovery of new cargo proteins that enter cells through clathrin-independent endocytosis[J].Traffic, 2009, 10(5): 590-599.
[14]Lewis JS, Jordan VC. Selective estrogen receptor modulators (SERMs): mechanisms of anticarcinogenesis and drug resistance[J].MutatRes, 2005, 591(1-2): 247-263.
[15]Patel BM, Desai VJ. Beneficial role of tamoxifen in experimentally induced cardiac hypertrophy[J].PharmacolRep, 2014, 66(2): 264-272.
Effects of tamoxifen on CD147 glycosylation and MMPs in the diabetic rat myocardium
WANG Yi-xuan+, Gao Yun-tao+, CUI Long-biao, RU Ning-yu, ZHANG Hai-jun, JIAO Bo, YU Zhi-bin△
(Key Laboratory of Aerospace Medicine, Ministry of Education, Department of Aerospace Physiology, Fourth Military Medical University, Xi'an 710032, China)
Objective: Over the last few decades, diabetic cardiomyopathy has been identified as a significant contributor in cardiac morbidity. However, the mechanisms of diabetic cardiomyopathy have not been clarified. Methods: In the present study, a diabetic rat model was induced by the intraperitoneal injection of streptozotocin. The myocardial CD147 expression and extent of glycosylation, as well as thematrixmetalloproteinases(MMPs)expression and activity, were observed in the diabetic and synchronous rats. Results: The results showed that CD147 located on sarcolemma of cardiomyocytes. The myocardial CD147 expression and glycosylation were significantly increased in the diabetic rats as compared with the control. Expression of MMP-2 protein, MMP-2 and MMP-9 activity were also increased in left ventricular myocardium in the diabetic rats. Tamoxifen only inhibited the enhanced expression of myocardial CD147 in the diabetic rats, but not in synchronous control rats. Tamoxifen inhibited glycosylation of myocardial CD147 in both diabetic and control rats. The inhibition of tamoxifen on CD147 glycosylation was stronger than on the expression in the myocardium. The extent of myocardial CD147glycosylation was positively related toMMP-2 and MMP-9 activity. Tamoxifen induced an inhibition of myocardial MMP-2 and MMP-9 activity in the control and diabetic rats. Conclusion: These results indicate that myocardial CD147 expression,especially the extent of glycosylation, regulates MMP-2 and MMP-9 activity, then accelerates cardiac pathological remodeling inducing diabetic cardiomyopathy. Tamoxifen inhibits myocardial CD147 glycosylation and further depress the activity of MMPs. Therefore, tamoxifen may protect the diabetic rats against diabetic myocardium.
diabetic cardiomyopathy, tamoxifen, CD147, glycosylation, matrix metalloproteinase
国家自然科学基金资助课题(31071044)
2014-09-29 【修回日期】2014-10-31
R337.2
A
1000-6834(2015)01-001-05
10.13459/j.cnki.cjap.2015.01.001
△【通讯作者】Tel: 029-84774807; E-mail: yuzhib@fmmu.edu.cn;+: 共同第一作者
