非小细胞肺癌患者PIK3CA基因与其他致癌基因共突变
2015-06-01梁乃新刘雅昕李单青
梁乃新,刘雅昕,刘 磊,李单青
中国医学科学院 北京协和医学院 北京协和医院胸外科,北京100730
非小细胞肺癌患者PIK3CA基因与其他致癌基因共突变
梁乃新,刘雅昕,刘 磊,李单青
中国医学科学院 北京协和医学院 北京协和医院胸外科,北京100730
目的 研究中国非小细胞肺癌患者PIK3CA基因与其他致癌基因共突变现象及特点。方法 2009年9月至2012年4月全国25家医院病理证实为非小细胞肺癌并进行基因突变检测的患者纳入本研究。收集和分析9个基因位点数据,包括PIK3CA E9、PIK3CA E20、KRAS E2、KRAS E3、BRAF,以及EGFR E18、E19、E20、E21。结果 在纳入研究的5125例患者中,有161例 (3.14%)存在多个突变,其中77例存在PIK3CA突变,包括50例E9突变和27例E20突变。与PIK3CA共存的其他致癌基因突变位点包括KRAS E2(11例)、KRAS E3(1例)、BRAF(2例)、EGFR E18(4例)、EGFR E20(5例)、EGFR E21(28例)和EGFR E19缺失突变 (37例)。在存在PIK3CA共突变的病例中,E9与E20相比,更容易产生共突变现象;与EGFR E20相比,更易与EGFR E21的L858R型突变共存。在PIK3CA E20突变中,H1047R型突变较H1047L型更为常见。与PIK3CA共突变的KRAS突变经常出现在E2的G12位点。BRAF V600E突变也存在与PIK3CA共突变的倾向。结论 PIK3CA是中国非小细胞肺癌常见的共突变致癌基因,其E9与E20突变相互排斥,但均可与其他致癌基因同时存在。其在肺癌发生发展中的作用和对患者预后的意义有待进一步研究。
PIK3CA;致癌基因;突变;非小细胞肺癌
Med J PUMCH,2015,6(3):186-190
对特殊致癌基因突变的识别和定位已使非小细胞肺癌尤其是肺腺癌的治疗发生变革。在非小细胞肺癌治疗中最重要的进展就是发现了表皮生长因子受体 (epidermal growth factor receptor,EGFR)基因突变。EGFR基因突变率在不同的人群中差异极大,在亚裔不吸烟女性肺腺癌患者中约为70% ~80%[1]。19号外显子 (E19)缺失突变和21号外显子 (E21)L858R被认为是EGFR酪氨酸激酶抑制剂 (tyrosine kinase inhibitor,TKI)治疗的关键敏感因素[2-4]。然而,也有研究发现,在开始应用靶向治疗10~16个月以后,肿瘤均会出现不同程度的耐药和进展[5],这或许与除敏感突变以外的其他位点存在基因突变有关,如在 BRAF、KRAS和PIK3CA基因位点,已发现许多其他致癌基因突变。国外有研究描述了KRAS[6]、BRAF[7]和PIK3CA[8]共突变阳性非小细胞肺癌患者的部分临床特点。
磷脂酰肌醇激酶-3(phosphoinositide-3-kinase,PI3K)在非小细胞肺癌发展中起重要作用,可使AKT磷酸化而激活下游通路,促进肿瘤细胞的存活及扩增。PIK3CA编码PI3K的p110α亚基[9]。PIK3CA突变通常发生在E9(E542K、E545K、Q546K)和E20 (H1047R或H1047L),E9编码螺旋结合域,E20编码p110α的催化亚基。位于螺旋结合域的突变可干扰与p85的结合,从而激活PI3K;位于催化亚基的突变则通过增加激酶活性而影响信号传导[10]。PI3K活化突变被认为具有致癌性,也有研究表明这种突变的发生在鳞状细胞肺癌与肺腺癌中相当甚至前者更为常见[11-13]。PI3K及其下游通路已经引起充分的关注和研究[14-17],许多以PI3K及其下游通路突变位点为靶点的肺癌治疗药物正处于研发阶段[8,18-22]。然而,临床前数据表明不同亚型的PI3K突变会有不同的部分应答率 (partial response,PR)[23],单独抑制 PI3K/ AKT/mTOR通路还不足以应对EGFR-TKI耐药非小细胞肺癌[24]。例如,结合MEK和PI3K抑制剂或许是克服T790M突变相关肺癌靶向治疗耐药的方法之一[25],但MEK抑制剂或许并不是PI3K抑制剂的最佳共同用药[26-27]。
PIK3CA共突变已被发现并报道[11,28-29],但在基因突变率方面存在明显的种族差异。目前鲜见亚裔人口PIK3CA与其他致癌基因共存复杂突变的相关报道。北京协和医院胸外科正开展胸部肿瘤个体化综合诊断及治疗的转化医学研究。作为该研究的一部分,本研究回顾性分析了5125例非小细胞肺癌患者PIK3CA与其他致癌基因共突变情况,以总结其特点。
资料和方法
回顾性纳入2009年9月至2012年4月因参与胸部肿瘤个体化综合诊断及治疗的转化医学研究项目而行基因突变检测的来自全国25家医院的5125例非小细胞肺癌患者,收集并分析其PIK3CA E9、PIK3CA E20、KRAS E2、KRAS E3、BRAF、EGFR E18、EGFR E19、EGFR E20、EGFR E21共9个基因的相关数据。采用液相芯片技术评估位于EGFR、KRAS、BRAF、PIK3CA基因的突变,方法参照文献 [30]。通过能并行检测70个等位基因突变位点的Surplex-xTAG-70plex液相芯片技术平台来分析和研究这些样本的突变状态。本研究已通过北京协和医院伦理委员会审查。所有参与者均签署知情同意书。
结果
纳入研究的 5125例患者中,161例 (3.14%,95%CI,2.90%~3.38%)存在多个突变,其中77例(47.83%,95%CI,43.89%~51.77%)存在PIK3CA突变,包括 50例 E9突变 (25例 E545K、23例E542K、1例Q546K、1例E545K和E542K)和27例E20突变 (8例H1047L、19例H1047R)。E9突变比E20突变发生率更高 (P<0.005)。发生在E9的突变主要为E545K和E542K,这两种突变的出现频率差异并无统计学意义 (P>0.05)。而在E20突变中,H1047R的出现频率明显高于H1047L,差异有统计学意义 (P<0.05)。与PIK3CA突变共存的其他致癌基因突变位点包括KRAS E2(11例)、KRAS E3(1例)、BRAF(2例)、EGFR E18(4例)、EGFR E20(5例)、EGFR E21(28例)和EGFR E19缺失突变 (37例)。这些PIK3CA共突变病例占所有167例 PIK3CA突变的46.11%(95%CI,38.54%~53.68%),其中BRAF共突变病例占所有26例BRAF突变的7.69%(95%CI,2.43%~30.12%),EGFR共突变病例占所有1854例EGFR突变的3.99%(95%CI,3.10%~4.88%),KRAS共突变病例占所有429例KRAS突变的2.80%(95%CI,1.23%~4.37%)。PIK3CA E9和EGFR E19共突变的病例数量 (n=21)与PIK3CA E20和EGFR E19共突变病例数量 (n=16)差异无统计学意义(P>0.05)。然而,PIK3CA E9和EGFR E21(L858R)共突变的病例数量(n=19)与PIK3CA E20和EGFR E21(L858R)共突变病例数量 (n=7)差异却有统计学意义 (P<0.005)。2例BRAF突变与PIK3CA突变共存分别为BRAF V600E突变与PIK3CA E9(E542K)突变共存,以及BRAF V600E突变与PIK3CA E9(E545K)突变共存。此外,本研究还发现8例三突变和1例五突变病例 (表1)。
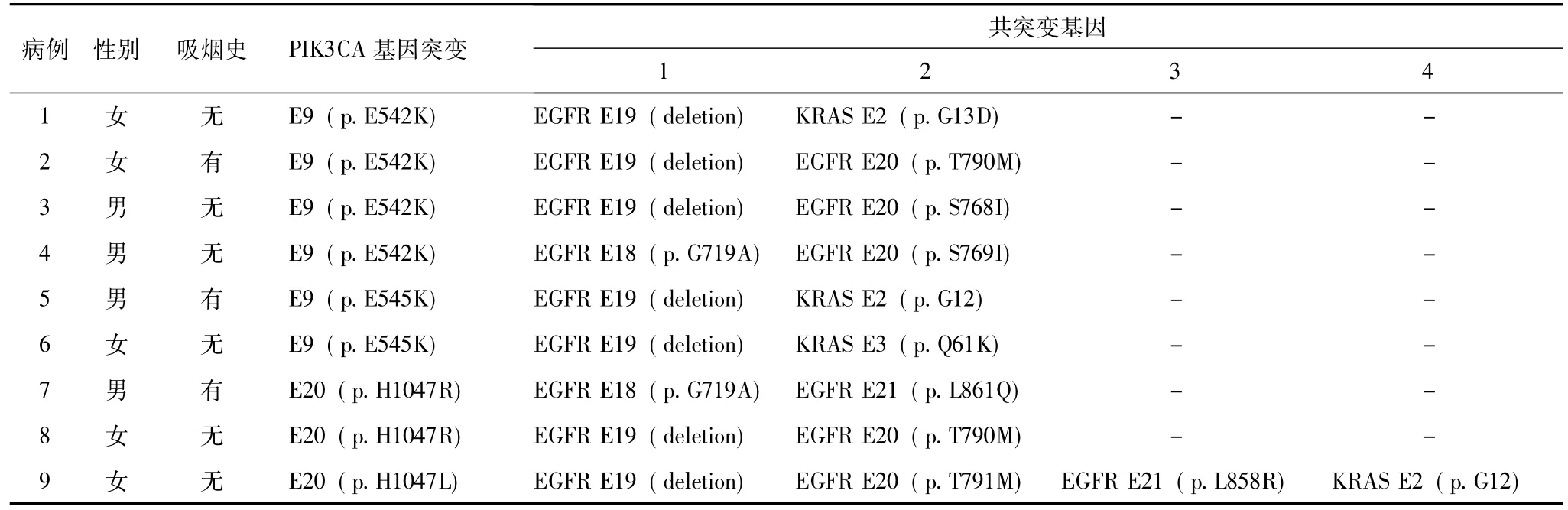
表1 9例非小细胞肺癌致癌基因三突变和五突变患者特征
讨论
非小细胞肺癌多突变病例总体发生率并不高(3.14%),但在肺癌的个性化治疗研究过程中,PI3K突变体却非常重要,不容忽视,因其几乎存在于一半的多突变病例中,本研究中47.83% (77/161)的多突变病例含PI3K突变。同时,167例含PIK3CA突变样本中,46.11% 都存在其他致癌基因突变。这是一个极高的概率,或许意味着PIK3CA基因突变更倾向于与其他致癌基因突变共同存在,并且该致癌基因突变与其他单独的致癌基因突变相比,可能具有较弱的独立致癌性。本研究发现在PIK3CA共突变病例中,E9比E20更为常见。发生在E9的两种主要突变为E545K(n=25)和E542K(n=23),其出现频率无明显差异。而在E20突变中,H1047R(n=19)的出现频率明显高于H1047L(n=8)。此外,本研究还发现2例罕见共突变样本,1例为Q546K与EGFR E19缺失突变共存,1例为E545K、E542K及EGFR E21 (L861Q)共突变。E545K、E542K以及EGFR L861Q均为少见突变,而其共同存在使得这一病例尤为罕见。
存在PIK3CA突变以及共突变的腺癌病例先前已有小样本研究报道[28-29,11,31],本研究通过大量数据分析,进一步发现,PIK3CA E9与PIK3CA E20突变之间互相排斥,并无共存病例,但却可以分别与KRAS (E2、E3)、BRAF和EGFR(E18、E19、E20、E21)共存。本研究还发现,与之前的报道[32]不同,EGFR突变与KRAS突变并非互相排斥 (表1)。但同时,本研究中并未观察到KRAS E2突变和E3突变同时存在的情况,提示KRAS E2突变和E3突变可能互相排斥。
EGFR E19缺失突变和EGFR E21(L858R)突变中有相当数量病例还同时存在PIK3CA突变,其中E19缺失突变37例,E21(L858R)突变26例。但是,它们分别仅占EGFR突变总数的2.00%和1.40%。这或许与亚裔人口EGFR E19和E21突变率较高现象有关。
KRAS突变与PIK3CA突变共存样本共有12例,包括G12A 1例,G12C 4例,G12D 3例,G12V 2例,G13D 1例,Q61K 1例。这些突变分布较分散,没有某种突变明显较多的现象,但突变多集中出现在KRAS E2 G12位点上。亚裔人口存在KRAS突变与PIK3CA突变共存现象的病例仅占所有 PIK3CA共突变病例的15.58%(16/77,95%CI,7.48% ~23.68%),而在高加索人种中该比例为62.5%(10/16),明显高于亚裔人口 (P<0.005)[28]。
BRAF突变在肺癌患者中极其少见;在本研究所有5125例样本中,仅发现26例。其中仅有2例BRAF突变与PIK3CA突变共存,均为BRAF V600E突变分别与PIK3CA E9(E542K)突变和PIK3CA E9(E545K)突变共存。
多种以包括PI3K在内的各种信号通路为靶点的药物正在研发中。众所周知,PIK3CA是一个药物研发和作用的重要靶点。近期的研究显示,在含PIK3CA突变患者中应用PI3K信号通路靶向制剂可使治疗反应率上升为无PIK3CA突变患者的7倍 (35%比5%)[33]。然而,也有研究发现,当同时存在KRAS突变时,应用PI3K信号通路靶向制剂对PIK3CA突变细胞系下游mTOR的抑制效果会被解除[34]。该研究结果提示,需要对肿瘤样本的基因分型进行综合检测,唯有这样,PIK3CA突变病例才能得到真正的个体化靶向治疗。
当然,本研究也存在一些不足。研究采用液相芯片技术检测突变,这一技术虽然高效,但却只能根据数据库及已发表文献所发现的突变,在特定的致癌基因中检测已知热点突变,而未进行全序列检测,因此,这种方法可能无法发现目前尚未被报道过的未知位点突变。本研究为回顾性分析,选择病理类型为鳞癌的患者,因考虑到EGFR敏感突变发生率较低,可能更倾向于拒绝基因突变检测;还有部分患者可能因为经济问题而拒绝检测。因此,鉴于同意进行突变检测的患者样本特点,研究可能会存在部分偏倚。本研究的另一不足是研究者无法明确PIK3CA突变和其他共突变的获得时间,即突变是原发还是继发,是否与先前的治疗有关。最后一个不足是尚未获得完整的临床随访数据,这也正是未来的研究方向。通过一段时间随访后,将继续完善如无进展生存期、总生存期等相关数据,从而为肺癌个体化综合治疗提供临床证据。
总之,PIK3CA突变在肺癌靶向治疗中的地位非常重要。在PIK3CA相关突变中,E9与E20的突变相互排斥,但其均可能与其他致癌基因突变同时存在,或许意味着PIK3CA基因突变更倾向于与其他致癌基因突变共同存在,并且与其他单独的致癌基因突变相比,可能仅是一个具有弱独立致癌性的致癌基因突变。在存在PIK3CA共突变的病例中,E9较E20更容易产生共突变现象,而与EGFR E20相比较,PIK3CA更易与EGFR E21 L858R型突变共存。在PIK3CA E20突变中,H1047R型突变较H1047L型更为常见。与PIK3CA共突变的KRAS突变常出现在E2的G12位点。另外BRAF V600E突变也存在与PIK3CA E9共突变的倾向。因此,建议对于个体化治疗,应进行多重位点的基因突变检测。同时,也应该寻求进一步证据来分析复杂多重突变对临床靶向治疗的影响。
[1]Fukuoka M,Wu YL,Thongprasert S,et al.Biomarker analyses and final overall survival results from a phase III,randomized,open-label,first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia(IPASS)[J].J Clin Oncol,2011,29:2866-2874.
[2]Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Engl J Med,2004,350:2129-2139.
[3]Paez JG,Janne PA,Lee JC,et al.EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J].Science,2004,304:1497-1500.
[4]Shigematsu H,Lin L,Takahashi T,et al.Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers[J].J Natl Cancer Inst,2005,97:339-346.
[5]Maemondo M,Inoue A,Kobayashi K,et al.Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J].N Engl J Med,2010,362:2380-2388.
[6]Martin P,Leighl NB,Tsao MS,et al.KRAS mutations as prognostic and predictive markers in non-small cell lung cancer[J].J Thorac Oncol,2013,8:530-542.
[7]Paik PK,Arcila ME,Fara M,et al.Clinical characteristics of patients with lung adenocarcinomas harboring BRAF mutations[J].J Clin Oncol,2011,29:2046-2051.
[8]Papadimitrakopoulou V.Development of PI3K/AKT/mTOR pathway inhibitors and their application in personalized therapy for non-small-cell lung cancer[J].J Thorac Oncol,2012,7:1315-1326.
[9]Samuels Y,Wang Z,Bardelli A,et al.High frequency of mutations of the PIK3CA gene in human cancers[J].Science,2004,304:554.
[10]Miled N,Yan Y,Hon WC,et al.Mechanism of two classes of cancer mutations in the phosphoinositide 3-kinase catalytic subunit[J].Science,2007,317:239-242.
[11]Yamamoto H,Shigematsu H,Nomura M,et al.PIK3CA mutations and copy number gains in human lung cancers[J].Cancer Res,2008,68:6913-6921.
[12]Kawano O,Sasaki H,Okuda K,et al.PIK3CA gene amplification in Japanese non-small cell lung cancer[J].Lung Cancer,2007,58:159-160.
[13]Drilon A,Rekhtman N,Ladanyi M,et al.Squamous-cell carcinomas of the lung:emerging biology,controversies,and the promise of targeted therapy[J].Lancet Oncol,2012,13:e418-e426.
[14]Engelman JA.Targeting PI3K signalling in cancer:opportunities,challenges and limitations[J].Nat Rev Cancer,2009,9:550-562.
[15]Courtney KD,Corcoran RB,Engelman JA.The PI3K pathway as drug target in human cancer[J].J Clin Oncol,2010,28:1075-1083.
[16]Liu P,Cheng H,Roberts TM,et al.Targeting the phosphoinositide 3-kinase pathway in cancer[J].Nat Rev Drug Discov,2009,8:627-644.
[17]Agoulnik IU,Hodgson MC,Bowden WA,et al.INPP4B: the new kid on the PI3K block[J].Oncotarget,2011,2: 321-328.
[18]Ihle NT,Paine-Murrieta G,Berggren MI,et al.The phosphatidylinositol-3-kinase inhibitor PX-866 overcomes resistance to the epidermal growth factor receptor inhibitor gefitinib in A-549 human non-small cell lung cancer xenografts[J].Mol Cancer Ther,2005,4:1349-1357.
[19]Bendell JC,Rodon J,Burris HA,et al.Phase I,dose-escalation study of BKM120,an oral pan-Class I PI3K inhibitor,in patients with advanced solid tumors[J].J Clin Oncol,2012,30:282-290.
[20]Ihle NT,Lemos R,Jr.,Wipf P,et al.Mutations in the phosphatidylinositol-3-kinase pathway predict for antitumor activity of the inhibitor PX-866 whereas oncogenic Ras is a dominant predictor for resistance[J].Cancer Res,2009,69:143-150.
[21]Reungwetwattana T,Weroha SJ,Molina JR.Oncogenic pathways,molecularly targeted therapies,and highlighted clinical trials in non-small-cell lung cancer(NSCLC) [J].Clin Lung Cancer,2012,13:252-266.
[22]Pal I,Mandal M.PI3K and Akt as molecular targets for cancer therapy:current clinical outcomes[J].Acta Pharmacol Sin,2012,33:1441-1458.
[23]Janku F,Wheler JJ,Naing A,et al.PIK3CA mutation H1047R is associated with response to PI3K/AKT/mTOR signaling pathway inhibitors in early-phase clinical trials[J].Cancer Res,2013,73:276-284.
[24]Gadgeel SM,Wozniak A.Preclinical rationale for PI3K/Akt/ mTOR pathway inhibitors as therapy for epidermal growth factor receptor inhibitor-resistant non-small-cell lung cancer[J].Clin Lung Cancer,2013,14:322-332.
[25]Faber AC,Wong KK,Engelman JA.Differences underlying EGFR and HER2 oncogene addiction[J].Cell Cycle,2010,9:851-852.
[26]Donev IS,Wang W,Yamada T,et al.Transient PI3K inhibition induces apoptosis and overcomes HGF-mediated resistance to EGFR-TKIs in EGFR mutant lung cancer[J].Clin Cancer Res,2011,17:2260-2269.
[27]Shimizu T,Tolcher AW,Papadopoulos KP,et al.The clinical effect of the dual-targeting strategy involving PI3K/AKT/mTOR and RAS/MEK/ERK pathways in patients with advanced cancer[J].Clin Cancer Res,2012,18:2316-2325.
[28]Chaft JE,Arcila ME,Paik PK,et al.Coexistence of PIK3CA and other oncogene mutations in lung adenocarcinoma-rationale for comprehensive mutation profiling[J].Mol Cancer Ther,2012,11:485-491.
[29]Endoh H,Yatabe Y,Kosaka T,et al.PTEN and PIK3CA expression is associated with prolonged survival after gefitinib treatment in EGFR-mutated lung cancer patients[J].J Thorac Oncol,2006,1:629-634.
[30]Li G,Luo X,He J,et al.A novel liquidchip platform for simultaneous detection of 70 alleles of DNA somatic mutations on EGFR,KRAS,BRAF and PIK3CA from formalin-fixed and paraffin-embedded slides containing tumor tissue[J].Clin Chem Lab Med,2011,49:191-195.
[31]Ludovini V,Bianconi F,Pistola L,et al.Phosphoinositide-3-kinase catalytic alpha and KRAS mutations are important predictors of resistance to therapy with epidermal growth factor receptor tyrosine kinase inhibitors in patients with advanced non-small cell lung cancer[J].J Thorac Oncol,2011,6: 707-715.
[32]Karachaliou N,Mayo C,Costa C,et al.KRAS mutations in lung cancer[J].Clin Lung Cancer,2013,14:205-214.
[33]Janku F,Tsimberidou AM,Garrido-Laguna I,et al.PIK3CA mutations in patients with advanced cancers treated with PI3K/AKT/mTOR axis inhibitors[J].Mol Cancer Ther,2011,10:558-565.
[34]Di Nicolantonio F,Arena S,Tabernero J,et al.Deregulation of the PI3K and KRAS signaling pathways in human cancer cells determines their response to everolimus[J].J Clin Invest,2010,120:2858-2866.
Co-mutation of PIK3CA and Other Oncogenes in Patients with Non-small Cell Lung Cancer
LIANG Nai-xin,LIU Ya-xin,LIU Lei,LI Shan-qing
Department of Thoracic Surgery,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100730,China
ObjectiveTo investigate the co-mutation of PIK3CA gene and other oncogenes in non-small cell lung cancer(NSCLC)patients in China.MethodsData were obtained from the patients with pathologically confirmed NSCLC and receiving gene mutation testing in 25 hospitals in China between September 2009 and April 2012.Nine genetic loci were tested and analyzed,including PIK3CA E9,PIK3CA E20,KRAS E2,KRAS E3,BRAF,and EGFR(E18,E19,E20,E21).ResultsA total of 5125 patients were included in this study,of which 161(3.14%)had multiple mutations,including 77 with mutations in PIK3CA,50 in E9 and the other 27 in E20.The other oncogene mutations coexisting with PIK3CA mutations included KRAS E2 (11 cases),KRAS E3(1 case),BRAF(2 cases),EGFR E18(4 cases),EGFR E20(5 cases),EGFR E21 (28 cases),and EGFR E19 deletions(37 cases).Among mutations in PIK3CA,E9 was more likely than E20 to have coexisting mutations,also more likely to coexist with EGFR E21 L858R than EGFR E20;whereasamong mutations in PIK3CA E20,H1047R was more common than H1047L.Mutations in KRAS coexisting with PIK3CA appeared mostly in E2 G12 locus.Mutations in BRAF V600E were also inclined to coexist with PIK3CA.ConclusionsPIK3CA might tend to appear concurrently with other oncogene mutations in Chinese NSCLC patients,while mutations in PIK3CA E9 and E20 are mutually exclusive.Further research is need to reveal the significance of coexistence of PIK3CA and other oncogene mutations in NSCLC and its impact on patient outcome.
PIK3CA;oncogene;mutation;non-small cell lung cancer
LI Shan-qing Tel:010-69152630,E-mail:lsq6768@sohu.com
R604;R34
A
1674-9081(2015)03-0186-05
10.3969/j.issn.1674-9081.2015.03.005
2015-02-07)
李单青 电话:010-69152630,E-mail:lsq6768@sohu.com
教育部科学技术研究重大项目 (311037),北京协和医院青年基金 (2010116)
