Smad3调控成釉细胞Amelotin启动子转录活性的研究
2015-05-18许针针王玉敏李东亮高玉光
许针针,张 莉,王玉敏,李东亮,高 艳,高玉光,
(山东 滨州 256603:1.滨州医学院附属医院口腔科;2.滨州医学院口腔医学院)
Smad蛋白家族作为细胞内的信号转导蛋白,在TGF-β超家族成员的信号转导中发挥重要作用。有研究显示,TGF-β/Smad3信号通路可通过Smad3与Amelotin启动子上的Smad3结合位点相互作用,进而调控成釉细胞Amelotin基因启动子的转录活性[1]。Smad3在釉质矿化过程中发挥着重要作用,Smad3(-/-)小鼠可出现釉质矿化缺陷[2]。釉质成熟蛋白(Amelotin,AMTN)是成熟期成釉细胞特异性表达的蛋白,该蛋白可影响釉质成熟[3]。因此,转录因子 Smad3和 Amelotin基因均与釉质发育有密切关系,研究Smad3和Amelotin启动子转录调控机制的关系已成为一个重要方向。
本研究通过构建不同长度Amelotin启动子荧光素酶报告基因载体,用双荧光素酶报告基因检测系统分析Smad3对Amelotin启动子转录活性的影响;同时在发现新的启动子功能性序列的基础上,进一步研究分析,确定Smad3与Amelotin的关系及其调控机制,以期为今后进一步研究牙体硬组织发育过程中相关基因的调控机制奠定基础。
1 材料和方法
1.1 主要试剂和仪器
Smad3抗体(Santa Cruz Biotechnology,美国);基因组DNA提取试剂盒(北京天根生化科技有限公司);PCR引物合成、EMSA探针合成、pMD18-T克隆载体、Taq plus酶、T4 DNA连接酶(TaKaRa,日本);质粒 pGL3-Basic、pGL3-Control、pRL40、限制性内切酶(KpnI、BglⅡ、MluI、XhoI)、TransFastTMTransfection Reagent、Dual-Luciferase® 双荧光素酶报告基因检测系统试剂盒(Promega,美国);E.coli DH5α菌株(本实验室保存);质粒小量抽提试剂盒、DNA胶回收试剂盒(上海生工);质粒提取试剂盒(Qiagen,德国);小鼠成釉细胞系(日本Akita大学医学院Sugiyama教授馈赠);HEK 293T细胞(ATCC,美国);DMEM培养基、胎牛血清(Hyclone,美国);胰蛋白酶(Gibco,美国);pcDNA3.1/myc-HisA(Invitrogen,美国);pcDNA3.1/Smad3-mychisA(Smad3)(本实验室构建并保存);Biotin 3'End DNA Labeling Kit、NE - PERTMNuclear and Cytoplasmic Extraction Reagents、LightShift Chemiluminescent EMSA Kit、Chemiluminescent Nucleic Acid Detection Module(Pierce,美国);ChemiScope series(上海勤翔科学仪器有限公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术研究所);Amersham Hybond-N+带正电荷尼龙膜(北京赛恩斯仪器有限公司)。
1.2 小鼠Amelotin基因启动子的克隆及Smad3对Amelotin启动子转录活性影响的观察
1.2.1 基因组DNA的提取
使用基因组DNA提取试剂盒从小鼠的成釉细胞中提取基因组DNA,操作步骤按照基因组DNA提取试剂盒的使用说明进行。
1.2.2 Amelotin 基因启动子的克隆
根据已知小鼠Amelotin基因序列设计引物(表1),以上述提取的成釉细胞DNA为模板,利用PCR仪扩增不同长度的Amelotin启动子片段。将PCR产物直接与克隆载体pMD18-T连接后,转入宿主菌E.coli DH5α中,并置于含有Amp的LB培养板上37℃倒置培养。分别取阳性菌落进行细菌的小量培养,并提取质粒DNA。所提取的质粒DNA经KpnI、BglⅡ酶切后,进行琼脂糖电泳以确定扩增产物,并分别命名为 T-M1、T-M2、T-M3、T -M4、T-M5、T-M6。利用带有相应 MluI、XhoI酶切位点的引物,并以与引物对应的T-M1、T-M2、T-M3、T-M4、T-M5、T-M6 为模板,进行 PCR 扩增。取扩增产物和荧光素酶表达载体pGL3-Basic,用限制性内切酶MluI、XhoI分别进行双酶切,并经纯化和回收后,在T4 DNA连接酶作用下16℃过夜;连接产物经进一步酶切后进行测序鉴定。鉴定正确后将不同长度Amelotin启动子片段与pGL3-Basic基因克隆所得到的重组荧光素酶报告基因载体分别命名为 M1、M2、M3、M4、M5、M6。

表1 用于克隆含不同长度Amelotin启动子的荧光素酶报告基因载体的引物
1.2.3 细胞培养和转染
小鼠成釉细胞(ALC)经常规复苏后接种于含有100 mL/L胎牛血清的DMEM培养基中,并在37℃、50 mL/L CO2、饱和湿度条件下进行培养和传代。取第3代小鼠成釉细胞铺板,常规培养至细胞长满孔底70% ~80%时,参照TransFastTMTransfection Reagent操作说明,以pRL40作为内参照,将相同剂量的 pcDNA3.1/myc-HisA、pcDNA3.1/Smad3-myc-HisA 分别与 M1、M2、M3、M4、M5、M6、pGL3-Basic共同转染成釉细胞(每组复3孔),继续培养32 h后进行双荧光素酶报告基因检测。
1.2.4 双荧光素酶报告基因检测Smad3对不同长度Amelotin基因启动子转录活性的影响
转染完成后,参照Dual-Luciferase®双荧光素酶报告基因检测系统试剂盒说明进行检测:每孔加入细胞裂解液PLB裂解细胞,待细胞裂解完全后,各取20 μL细胞裂解液转移至上样管中,分别加入100 μL LARⅡ并混匀后,置于荧光发光仪上检测萤火虫荧光素酶(Firefly luciferase)激发底物释放荧光的数值(U1);然后再分别加入 100 μL Stop&Glo试剂,混匀后检测样品中海肾荧光素酶(Renilla luciferase)激发底物释放荧光的数值(U2)。以每一样品所测得的数值U1与U2之比作为该报告基因的相对荧光素酶活性。实验重复3次,取平均值。
1.3 Smad3和Amelotin基因启动子特异性结合位点之间相互作用的观察
1.3.1 人和小鼠 Amelotin基因启动子片段(-160 ~ +196)的序列比对
利用软件 (http://blast.ncbi.nlm.nih.gov/Blast.cgi)对人和小鼠的Amelotin基因启动子序列(-160~+196)进行BLAST分析,观察人和小鼠两序列的同源性。生物信息软件分析,在序列(-140~-136)和(-83~-79)区域有潜在的Smad3结合位点,故针对这两个潜在结合位点设计探针。
1.3.2 细胞核蛋白的准备
HEK 293T细胞常规复苏后接种于含100 mL/L胎牛血清的 DMEM培养基中,并在37℃、50 mL/L CO2、饱和湿度条件下进行培养和传代。取第3代293T细胞铺板,常规培养至细胞长满孔底50%~60%时,按照磷酸钙转染的操作说明,将相同剂量的 pcDNA3.1/myc-HisA、pcDNA3.1/Smad3-myc-HisA分别以磷酸钙 -DNA沉淀的方式转染293T细胞。细胞转染后36 h,参照 NE-PERTMNuclear and Cytoplasmic Extraction Reagents操作说明提取细胞核蛋白,并以BCA蛋白浓度测定试剂盒测定核蛋白的浓度。然后将pcDNA3.1/Smad3-myc-HisA转染后提取的核蛋白分别命名为:NP-hisA、NI-Smad3。
1.3.3 EMSA 探针的准备
参照Biotin 3'End DNA Labeling Kit操作说明对野生型探针单链分别进行标记,并在使用前进行退火合成双链;然后将site1、site2两个位点相对应的野生型标记探针分别命名为:Probe-WT1、Probe-WT2。
1.3.4 观察 Smad3和Amelotin基因启动子特异性结合位点之间的结合
Smad3与Amelotin基因启动子特异性结合位点之间的结合反应严格按照LightShift Chemiluminescent EMSA Kit操作说明进行。实验过程如下:①将核蛋白 NP-hisA、NP-Smad3分别与探针Probe-WT1、Probe-WT2 进行结合反应,其反应体系于室温下孵育30 min后,用60 mL/L非变性胶在0.5x TBE缓冲液中冰上预电泳60 min,然后上样、电泳、转膜、交联;交联后的N+带正电荷尼龙膜按照Chemiluminescent Nucleic Acid Detection Module操作说明进行封闭反应,HRP标记、冲洗、平衡之后,将化学发光底物作用于尼龙膜上,并通过化学发光仪检测、分析结果;②在上述实验结果的基础上,再由核蛋白 NP-Smad3分别与探针Probe-WT2、野生型未标记探针、突变探针、anti-Smad3 antibody进行竞争实验和supershift实验,分为4组,组1为核蛋白NP-Smad3+探针Probe-WT2;组2为核蛋白NP-Smad3+突变探针+探针Probe-WT2;组3为核蛋白 NP-Smad3+野生型未标记探针+探针Probe-WT2;组4为核蛋白NPSmad3+anti-Smad3 antibody+ 探针 Probe-WT2。以上4组预先室温下孵育 30 min,加入探针Probe-WT2后再孵育30 min,非变性胶预电泳60 min;然后上样、电泳、转膜、交联;交联后的N+带正电荷尼龙膜按上述同样的方法处理、检测、分析结果。以上两个实验均重复3次。
1.4 Smad3过表达对野生型和突变型Amelotin基因启动子转录活性影响的观察
1.4.1 小鼠Amelotin基因启动子特征性序列定点突变体的构建
为将Amelotin基因启动子序列中(-160~-1)区域内GTCTG定点突变为CCCTG,利用突变引物,以质粒M5(-160~+196)为模板,按照TaKa-Ra MutanBEST Kit说明进行定点突变,构建突变质粒;然后对突变质粒进行双酶切(MluI酶、XhoI酶)和测序鉴定,鉴定正确后命名为MT-M5。
1.4.2 双荧光素酶报告基因检测Smad3过表达时野生型和突变型Amelotin基因启动子(-160~+196)的转录活性
pcDNA3.1/Smad3-myc-hisA 瞬时转染小鼠成釉细胞,并以质粒pcDNA3.1/myc-hisA作为阴性对照、pRL40作为内参照。实验分为6组(每组复3孔):组 1为 pGL3-Basic+200 ng pcDNA3.1/myc-hisA;组2 为 pGL3-Basic+200 ng pcDNA3.1/Smad3-myc-hisA;组3 为 WT-M5+200 ng pcDNA3.1/myc-hisA;组 4 为 WT-M5+200 ng pcDNA3.1/Smad3-myc-hisA;组 5 为 MT-M5+200 ng pcDNA3.1/myc-hisA;组 6 为 MT-M5+200 ng pcDNA3.1/Smad3-myc-hisA。转染完成后参照Dual-Luciferase®双荧光素酶报告基因进行检测,并以每一样品所测得的数值U1与U2之比作为该报告基因的相对荧光素酶活性。实验重复3次,取平均值。
1.5 统计学分析
2 结果
2.1 含不同长度Amelotin基因启动子片段的荧光素酶报告基因载体的构建及Smad3对Amelotin基因启动子转录活性的影响
通过PCR成功扩增了不同长度的Amelotin基因启动子片段,并通过基因克隆获得了重组的荧光素酶报告基因载体 M1、M2、M3、M4、M5、M6(图1a),测序显示启动子序列正确。
将重组的荧光素酶报告基因载体(M1、M2、M3、M4、M5、M6)、pGL3-Basic 分别与 pcDNA3.1、Smad3共同转染小鼠成釉细胞后,双荧光素酶报告基因检测显示:Smad3 过表达时,M1、M2、M3、M4、M5的相对荧光素酶活性与对照组(不转染Smad3)相比均显著增加(P<0.05),其中M5增加的幅度最大,约是对照组的2倍;M6与对照组相比,差异无统计学意义(P>0.05)(图1b)。
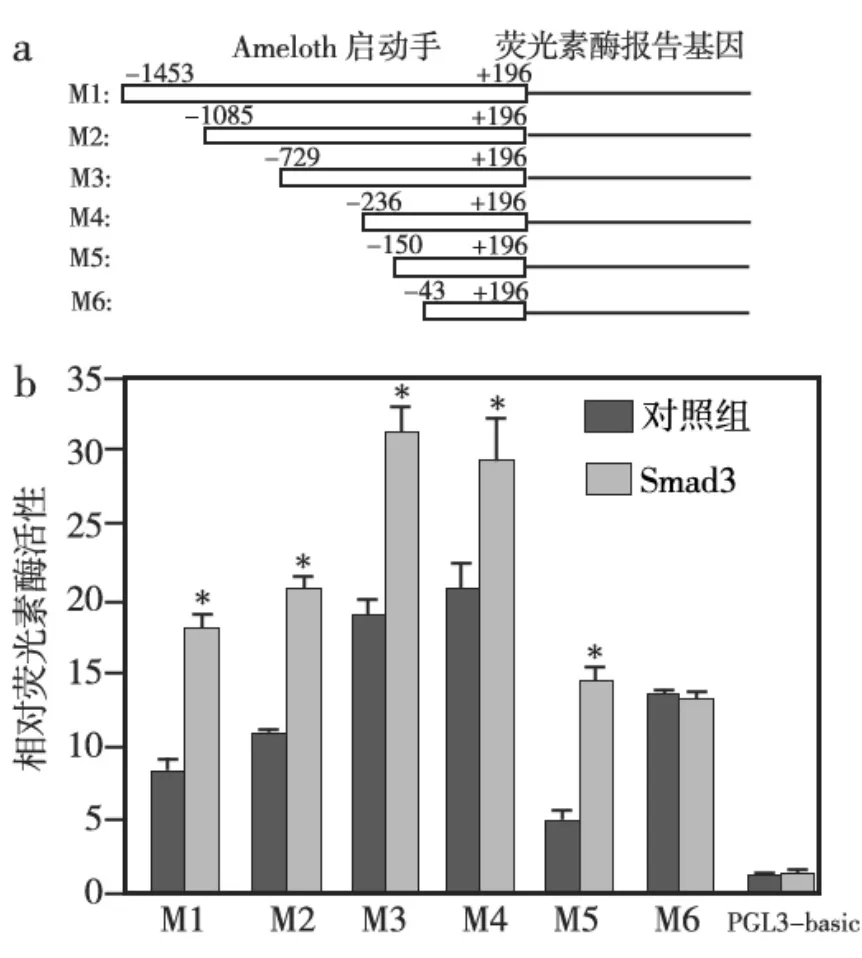
图1 Amelotin启动子的分析
2.2 Smad3和Amelotin基因启动子特异性结合位点之间的相互作用
首先,利用Blast软件分析人和小鼠Amelotin基因启动子序列(-160~+196),并发现这两个序列在(-160~-1)区域内具有很大的同源性(序列相似性达到40%以上)。在生物信息软件分析时发现,(-140~-136)和(-83~-79)区域有潜在的Smad3结合位点(site1、site2)(图2)。凝胶迁移实验结果显示:Smad3可与site2结合,并存在相互作用(图3,lane4);而与site1则无结合(图3,lane2)。在突变竞争中,可观察到核蛋白与DNA形成的复合物(图3,lane6),冷竞争中复合物消失(图3,lane7);在supershift实验中复合物的条带减弱(图3,lane8)。以上结果提示,Smad3与site2之间存在相互作用。

图2 人和小鼠的Amelotin启动子DNA序列(-160~+196)的Blast分析(*示两条基因序列中完全相同的核苷酸碱基)
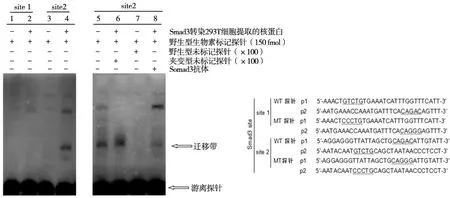
图3 观察Smad3和Amelotin启动子上Smad3结合位点1、2之间的相互作用
2.3 Smad3过表达对野生型和突变型Amelotin基因启动子转录活性的影响

图4 Smad3对Amelotin启动子转录活性的影响
所构建的定点突变的荧光素酶报告基因载体MT-M5经酶切、测序结果显示,在预期位点发生了突变(图 4a)。瞬时转染 pcDNA3.1/myc-hisA、pcDNA3.1/Smad3-myc-hisA及WT-M5、MT-M5后,双荧光素酶报告基因检测结果显示,与pcDNA3.1/myc-hisA比较,Smad3转染后,WT-M5比MT-M5的荧光素酶活性显著增加(P<0.05);特征性序列定点突变后,Smad3对Amelotin基因启动子(-160~+196)的转录活性的影响与对照组相比,差异无统计学意义(P>0.05)(图4b)。
3 讨论
Amelotin是最近发现的一种新的牙釉质蛋白基因,是成釉细胞特异性表达基因之一。有研究显示,在釉质分泌阶段,Amelotin基因表达不明显,随着釉质发育成熟,其表达量增加,提示该蛋白与釉质发育关系密切[4]。魏亚红等发现,随着釉质基质的分泌和成釉细胞发育的成熟,Amelotin的表达量增加,提示其在釉质发育后期发挥重要作用[5]。有学者认为,通过观察Amelotin基因过表达的转基因动物,可发现其釉质存在矿化缺陷[6]。另有研究显示,Smad3基因敲除的小鼠釉质也表现为矿化缺陷[2]。以上研究结果表明,转录因子Smad3和Amelotin均与釉质矿化有关。但对于Amelotin基因表达转录调控的具体分子机制目前尚不清楚。因此研究在釉质矿化过程中Amelotin的转录调控机制已成为一个重要的研究方向。有研究表明,在Amelotin基因启动子上存在多种转录因子的结合位点,并发现转录因子Runx2可与Amelotin基因启动子上相应的Runx2结合位点结合,进而调控Amelotin基因的表达[7];转录因子 Smad3 可与Amelotin基因启动子上相应的 Smad3结合位点(-1418~ -1415)与(-50~ -47)结合,进而调控Amelotin基因的表达[1]。在本实验中,首先,利用软件对Amelotin基因启动子序列进行全面分析,并构建了6个不同长度的Amelotin启动子的荧光素酶报告基因载体;其次,利用双荧光素酶报告基因检测系统检测了Smad3对Amelotin启动子转录活性的影响。结果显示,与对照组相比,Smad3均能不同程度的增强Amelotin基因启动子转录活性(与李盼等[1]的研究结果一致)外,同时还能使Amelotin基因启动子(荧光素酶报告基因载体M5)的相对荧光素酶活性显著增强(约是对照组的两倍)。提示,在Amelotin基因启动子区域(-160~-196)内可能存在新的Smad3的结合位点,Smad3可通过与之结合而调控Amelotin基因的转录表达。鉴于人和小鼠的牙齿发育过程相似,有学者推测两者的Amelotin基因上游的启动子序列存在同源部分[8]。因此,本实验用生物信息学软件对人和小鼠的Amelotin基因启动子序列(-160~-196)进行了同源性分析,并发现两条序列在(-160~-1)区域内确实存在很大的同源性;由此推测,其基因的调控区域也主要集中于此,这也是我们进一步研究的主要依据。在此研究的基础上,我们将Amelotin基因启动子序列(-160~-196)作为新发现的启动子功能性区域,就Smad3对Amelotin启动子(-160~-196)转录调控的影响做了进一步的分析。利用生物学工具对Amelotin启动子序列进行分析时发现,该启动子在(-140~-136)和(-83~-79)区域有潜在的Smad3结合位点GTCTG和CAGAC。凝胶迁移实验结果显示,Smad3和Amelotin启动子上特异性结合位点GTCTG之间存在相互作用,而与CAGAC之间未发现相互作用。最后,用基因定点突变技术将Smad3结合位点GTCTG突变为CCCTG,并构建突变型Amelotin基因启动子荧光素酶报告基因载体,然后利用双荧光素酶报告基因检测系统检测Smad3对Amelotin启动子转录活性的影响。结果显示:与对照组相比,Smad3能显著地增强野生型 Amelotin启动子的转录活性;与野生型Amelotin启动子转录活性相比,Smad3结合位点突变可明显抑制Amelotin启动子的转录活性。以上研究结果表明,Smad3可与Amelotin启动子区域(-140~-136)内特征性序列相结合,并进而调控Amelotin基因的表达。
本实验在已有研究的基础上,通过构建Amelotin基因不同长度启动子片段的荧光素酶报告基因载体,发现了Amelotin基因启动子新的功能性调控区域,不仅为进一步研究Amelotin基因启动子转录调控的分子机制奠定基础,而且对于研究Smad3与釉质疾病的关系具有潜在的指导意义。
[1]李盼,王玉敏,张莉,等.TGF-β1/Smad3信号通路调控小鼠成釉细胞Amelotin启动子转录活性的研究[J].牙体牙髓牙周病学杂志,2014,24(2):66-71.
[2]Yokozeki M,Afanador E,Nishi M,et al.Smad3 is required for enamel biomineralization[J].Biochem Biophys Res Commun,2003,305(3):684 -690.
[3]Moffatt P,Smith CE,St-Arnaud R,et al.Cloning of rat amelotin and localization of the protein to the basal lamina of maturation stage ameloblasts and junctional epithelium[J].Biochem J,2006,399(1):37 -46.
[4]Iwasaki K,Bajenova E,Somogyi-Ganss E,et al.Amelotin- - a novel secreted,ameloblast-specific protein[J].J Dent Res,2005,84(12):1127 -1132.
[5]魏亚红,孙岩,张娟娟,等.釉成熟蛋白和釉原蛋白基因在小鼠牙胚发育过程中的时空表达研究[J].牙体牙髓牙周病学杂志,2009,19(9):497-502.
[6]Lacruz RS,Nakayama Y,Holcroft J,et al.Targeted overexpression of amelotin disrupts the microstructure of dental enamel[J].PLoS One,2012,7(4):e35200.
[7]刘晓影,王玉敏,李伯翰,等.Runx2调控成釉细胞Amelotin基因表达的研究[J].牙体牙髓牙周病学杂志,2013,23(2):80-85.
[8]刘晓影,高志芹,韩婷婷,等.人牙釉质蛋白 Amelotin,Ameloblastin及Enamelin基因启动子的初步研究[J].潍坊医学院学报,2009,31(5):321-326.
