胆汁螺杆菌实时荧光定量PCR检测方法的建立
2015-05-11伍妙梨,袁文,饶丹等
胆汁螺杆菌实时荧光定量PCR检测方法的建立
伍妙梨,袁 文,饶 丹,王 静,朱余军,尹雪琴,黄 韧,郭鹏举
(广东省实验动物监测所,广东省实验动物重点实验室,广州 510663)
目的 建立快速、敏感、特异的胆汁螺杆菌(Helicobacter bilis,H.bilis)TaqMan探针实时荧光定量PCR检测方法,对胆汁螺杆菌进行定量检测。方法 PCR扩增H.bilis保守基因P17序列全长ORF435 bp,进行TA克隆,构建质粒标准品pMD-HBP17。通过对pMD-HBP17标准品的定量分析,优化反应体系,检测TaqMan探针实时荧光定量PCR方法的灵敏度、特异性及重复性;用所建立的qPCR方法检测77份临床样品,并与普通PCR的检测结果作比对。结果 所建立的qPCR检测方法,质粒DNA浓度在108~101拷贝之间表现出较好的线性和相关性,所得标准曲线的斜率为-3.46,相关系数为0.999,检测灵敏度达到20个拷贝,对77份临床样品的检出率为14.3%,较普通PCR(7.8%)的检出率高。结论 建立的H.bilis qPCR检测方法特异性好、敏感性高、稳定性强,可用于胆汁螺杆菌的定量及定性检测。
胆汁螺杆菌(H.bilis);荧光定量PCR(qPCR);TaqMan探针
啮齿动物螺杆菌(rodent helicobacter)是指寄居于啮齿动物消化道的一群螺杆菌属细菌的总称,目前从大鼠、小鼠、沙鼠等啮齿动物中已陆续分离到三十多种啮齿动物螺杆菌,其中重要的有胆汁螺杆菌 (Helicobacter bilis)、肝 螺 杆 菌 (Helicobacter hepatitis)、啮齿类螺杆菌(Helicobacter rodentium)等[1]。胆汁螺杆菌是啮齿类实验动物的重要致病菌之一,常呈隐性感染,其感染会严重影响实验动物的品质,而被国际实验动物理事会列为啮齿类实验动物必须排除的病原微生物[2]。传统的胆汁螺杆菌的检测方法主要包括分离培养法、PCR等。鉴于胆汁螺杆菌的生长条件苛刻,分离培养的成功率较低而不适用于临床鉴定;普通PCR技术通过对扩增后的产物进行电泳检测分析,虽然敏感性较高,但存在假阳性问题。实时荧光定量PCR(qPCR)通过实时检测荧光量的变化,获得不同样品达到一定荧光信号时所需的循环次数进而通过计算对模板进行准确定量,具有操作简单、结果直观、敏感性高、特异性强、重复性好等优点[3]。本研究旨在建立一种灵敏度高、特异性强、快速准确检测胆汁螺杆菌的TaqMan探针荧光定量PCR方法。
1 材料和方法
1.1 材料
1.1.1 菌种及临床样本
胆汁螺杆菌ATCC51630购自美国典型微生物菌种保藏中心(ATCC),大肠杆菌DH-5α菌株均由本实验室保存。临床样本为SD大鼠和野鼠的盲肠内容物,SD大鼠来源于2014年本实验室收到广东省送检的SD大鼠,背景调查表明该SD大鼠曾饲养于普通环境,共52只。野鼠为褐家鼠,捕获于广州市某实验动物养殖场附近,共25只。无菌采集活体大鼠和野鼠的盲肠内容物,样本采集在本实验室的屏障环境实验间【SYXK(粤)2012-0122】进行,-20℃保存。
1.1.2 试剂
细菌基因组DNA提取试剂盒、DNA纯化回收试剂盒均购自天根生化科技有限公司;Premix Ex TaqTM(Probe qPCR)、Premix Ex TaqTMVersion2.0、pMDTM19-T Vector等均购自TAKARA公司。
1.1.3 仪器
ABI7500荧光定量PCR仪,检测软件为SDS1.4版本。
1.1.4 引物及探针的设计合成
根据NCBI中胆汁螺杆菌P17基因序列的保守区域设计一对特异性qPCR引物(P17-F1、P17-R1)及探针(P17-probe),同时设计一对普通引物(P17-F2、P17-R2)扩增P17全长基因片段(表1)。引物及探针均由上海立菲生物技术有限公司合成。
1.2 方法
1.2.1 细菌基因组DNA的提取
按照细菌基因组DNA提取试剂盒的操作步骤提取胆汁螺杆菌的基因组DNA,并用紫外分光光度计检测所获得的DNA的纯度及浓度。
1.2.2 H.bilis P17基因全长ORF的PCR扩增
以抽提的基因组DNA为模板,进行PCR扩增,取2μL基因组DNA加入2μL引物(10μmol/L),25μL Premix Ex Taq,加灭菌蒸馏水到反应总体系为50μL。95℃预变性5 min后,95℃变性30 s,60℃退火30 s,72℃延伸1 min,循环扩增30次,72℃终延伸10 min,4℃保存。PCR产物用1.5%的琼脂糖凝胶电泳进行检测后用DNA纯化回收试剂盒回收,回收产物-20℃保存。
1.2.3 H.bilis P17质粒标准品的制备
将扩增的H.bilis P17基因片段PCR产物纯化后进行TA克隆插入pMD-19T载体,并转化DH5α感受态细胞,筛选阳性克隆,经 PCR鉴定后送invitrogen公司测序。将测序正确的阳性克隆增殖培养,提取重组质粒。通过紫外分光光度计测定质粒浓度,并根据公式:C=(N×6.02×1023)/(MW× 109)计算质粒拷贝数。C为每μL质粒中所含目的基因拷贝数;N为质粒浓度,单位为ng/μL;MW为重组质粒分子量。
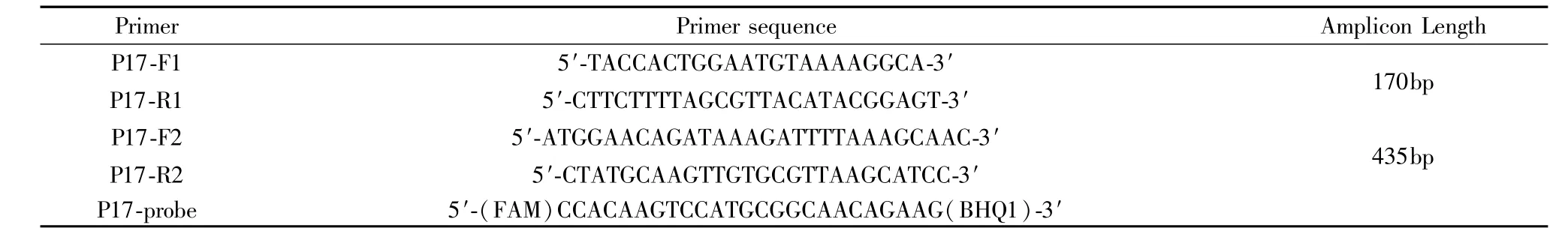
表1 所用引物及探针Tab.1 Primer and probe
1.2.4 qPCR反应体系的建立和优化
根据TAKARA Premix Ex TaqTM(Probe qPCR)的操作说明书配制qPCR反应体系,分别对引物浓度(0.1μmol~1μmol),探针浓度(0.1μmol~1 μmol)、循环数(36~45个循环)等条件进行优化,通过比较Ct值、荧光强度来判定优化结果。
1.2.5 敏感性试验及线性标准曲线的绘制
将H.bilis P17质粒标准品母液进行10倍梯度稀释,取108~100copies/μL这8个梯度稀释度的质粒作为qPCR反应模板,每个稀释度做3个重复,同时以pMD-19T空质粒为阴性对照,ddH2O为空白对照。通过实时荧光定量PCR仪自动绘制线性标准曲线。
1.2.6 qPCR检测方法特异性分析
同时使用小家鼠螺杆菌(H.muridarum)、啮齿类螺杆菌(H.rodentium)、肝螺杆菌(H.hepatitis)、盲肠螺杆菌(H.typhlonius)、鼠伤寒沙门氏菌、大肠杆菌等细菌DNA作为模板进行H.bilis qPCR特异性检测,同时以pMD-19T空质粒为阴性对照,水作为空白对照,每个样品做2个重复。
1.2.7 qPCR检测方法重复性分析
测定5个浓度梯度模板的Ct值,重复5次,通过计算Ct值的变异系数CV来评价检测方法的重复性。
1.2.8 H.bilis qPCR检测方法的临床应用
用本研究建立的 qPCR方法和普通 PCR方法[4]检测普通级别大鼠及野鼠的盲肠样品,并对比两种方法的检出率。
2 结果
2.1 pMD-HBP17质粒的构建
以胆汁螺杆菌的基因组DNA为模板,通过PCR扩增H.bilis P17基因全长ORF435 bp,通过TA克隆制备重组质粒。重组质粒经过PCR鉴定阳性(图1)。阳性菌株经测序鉴定与NCBI中H.bilis P17基因片段序列一致。
2.2 qPCR反应体系的建立
通过 ABI7500系统随机软件 SDS1.4分析qPCR结果。得出最佳反应条件是每20μL反应体系中加入 10μL Premix Ex Taq,0.2 μLROX Reference DyeII,上下游引物各0.2μmol,探针0.1 μmol,模板2μL。ABI7500反应程序为:95℃预变性30 s后进入PCR扩增阶段,95℃ 5 s,60℃ 34 s,同40个循环。其中60℃ 34 s为荧光收集阶段。
2.3 定量线性分析及敏感度检测
将pMD-HBP17质粒标准品进行10倍梯度稀释后,以2×108~2×100copies/μL稀释度作为模板进行qPCR反应,结果显示:2×108~2×101copies/μL浓度之间,标准曲线线性较好,扩增曲线呈典型的S型(图2),每组复孔间曲线拟合情况较好,相邻两组间起峰的循环数基本维持在3个循环左右,Ct值落在9~35之间。标准曲线定量线性方程所得斜率为-3.46,截距为37.51,线性相关系数为0.999。而2 ×100copies/μL组因模板浓度较低,接近TaqMan探针的临界检测浓度,复孔重复性不如前面8组,误差偏大,线性相关性不好,故排除。因此,本研究中标准品定量20拷贝以上能表现较好线性和相关性,故本方法检测的灵敏度为20个拷贝。定性判定可认为Ct值大于35为阴性,Ct值小于35为阳性。
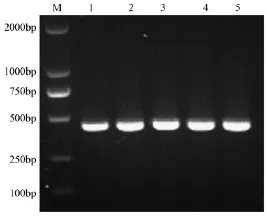
图1 重组质粒pMD-HBP17的PCR鉴定Note.DL2000 DNA Marker(M)and positive plasmid colony of pMD-HBP17(1~5).Fig.1 Result of PCR identification of the recombinant plasmid pMD-HBP17
2.4 qPCR检测方法特异性分析
对小家鼠螺杆菌(H.muridarum)、啮齿类螺杆菌(H.rodentium)、肝螺杆菌(H.hepatitis)、盲肠螺杆菌(H.typhlonius)、鼠伤寒沙门氏菌、大肠杆菌等进行检测,结果显示其他几种螺杆菌模板均未出现特异性扩增,对应扩增曲线均为平缓直线,而用pMD-19T空质粒作的阴性对照及水作的空白对照也均未出现特异性扩增,因此,该方法对胆汁螺杆菌核酸的检测是特异的(图4)
2.5 qPCR检测方法重复性分析
以2×106~2×101copies/μL的模板重复测定5次,分别得到5个Ct值,计算Ct平均值、标准差和变异系数(表2)。由表2可知,本方法检测重复性较好。

图2 pMD-HBP17质粒标准品qPCR扩增荧光动力曲线及标准曲线Note:A was fluorescence quantitative amplification plot of10-fold serial dilution standard plasmid;B was standard curve obtained with serial dilution of the pMD-HBP17 standard plasmid from 2×108 copies/well to 2×101 copies/well.Fig.2 Real-time fluorescence quantitative amplification plot and standard curve of pMD-HBP17 standard plasmid

图3 H.bilis qPCR方法特异性检测结果
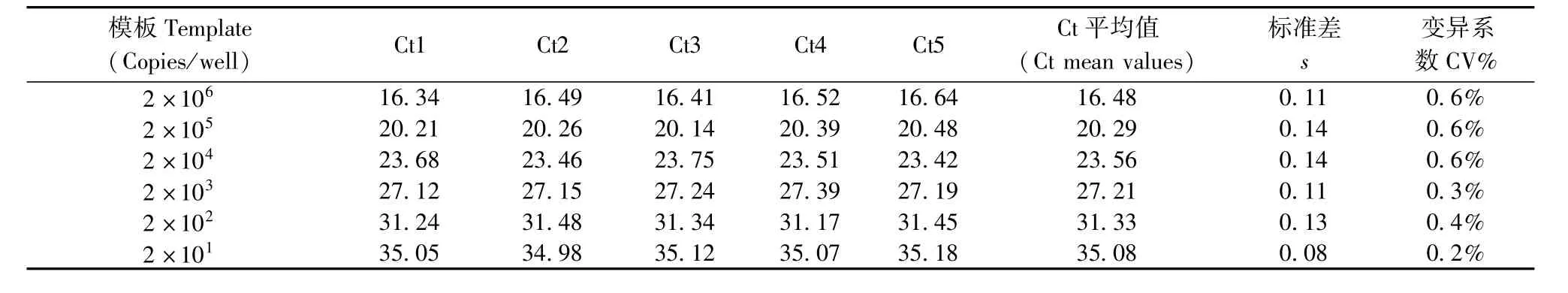
表2 H.bilis qPCR检测方法的重复性实验Tab.2 The repeatability evaluation of 10-fold serial dilution of pMD-HBP17 standard plasmid
2.6 qPCR检测方法的临床应用
对送检的52份SD大鼠盲肠样品和25份野鼠盲肠样品进行组织基因组提取后分别用qPCR方法和普通PCR方法检测样品中的胆汁螺杆菌,结果表明,本研究建立的qPCR方法的检出率为14.3%,而普通PCR方法的检出率为7.8%,新建立的qPCR方法较普通PCR方法具有更高的检出率(表3)。

表3 qPCR方法及普通PCR方法检测胆汁螺杆菌Tab.3 Detection of Helicobacter bilis by qPCR and PCR
3 讨论
啮齿动物螺杆菌为革兰氏阴性菌,生长要求苛刻,主要寄生于消化道,可导致肝胆疾病,并在肝炎发生中起促进作用,严重影响实验动物的质量[5]。用携带啮齿类螺杆菌的实验动物进行相关疾病的发病机制、药效学研究、药品及保健品的安全性评估时,其试验结果将受到干扰[6]。胆汁螺杆菌是一种典型而重要的螺杆菌,常以隐性感染形式普遍存在于大鼠、小鼠、沙鼠等啮齿动物的消化道中,与啮齿动物肝胆疾病、盲肠炎、结肠炎等的发生高度相关[7-8]。研究指出,胆汁螺杆菌还与人类胆管癌、胆囊炎等肠道疾病的发生存在相关性,对人类具有潜在危害性[9]。因此,螺杆菌在实验动物中的感染已经引起国内外研究者的高度重视,欧洲实验动物联盟已将其列为实验动物必须排除的病原菌,但我国因缺乏有效的检测方法,而尚未被列入实验动物质量国家标准,造成我国实验动物科研领域与国际水平的差距,进一步影响我国实验动物产业化,并对实验动物进出口带来不利影响[10]。因此,建立一种简便、快速、高效、准确的检测啮齿类螺杆菌的方法对保证及提高实验动物质量至关重要。
在螺杆菌检测方法研究的早期,分离培养法与分子生物学方法因其可靠直接而成为螺杆菌诊断检测的首选方法,但因螺杆菌的生长条件苛刻,而阻碍了该检测方法的应用[11]。随着分子生物学技术的发展,PCR检测技术因高效、快速简便等优点而被广泛应用于检测螺杆菌。TaqMan探针荧光定量PCR检测技术因其特异性好、灵敏度高及可定量等优点近年来被广泛应用于多种病原微生物的检测[12]。本研究中利用TaqMan探针技术建立胆汁螺杆菌qPCR检测方法,可用于胆汁螺的快速检测及定量。
本研究通过构建包含H.bilis P17基因序列的pMD-HBP17质粒,作为DNA定量标准品,并对标准品进行倍比稀释以作为反应模板,验证该检测方法的灵敏性。实验结果表明模板浓度在108-101拷贝范围内,其相应Ct值具有良好的线性相关性,相关系数为0.999,理论上该检测方法的定量准确性到达20拷贝。用qPCR方法和既有的普通PCR方法对77份临床样品进行检测,结果表明qPCR检测方法较普通PCR方法具有更高的敏感性和检出率。
[1] Hodzic E,McKisic M,Feng S,et al.Evaluation of diagnostic methods for Helicobacter bilis infection in laboratory mice[J].Comp Med,2001,51(5):406-412.
[2] Flahou B, Haesebrouck F, Smet A, et al. Gastric and enterohepatic non-Helicobacter pylori Helicobacters[J].Helicobacter,2013,18 Suppl 1:66-72.
[3] Javed S,Mejias-Luque R,Kalali B,et al.Helicobacter bilis gamma-glutamyltranspeptidase enhances inflammatory stress response via oxidative stress in colon epithelial cells[J].PLoS One,2013,8(8):e73160.
[4] Feng S,Ku K,Hodzic E,et al.Differential detection of five mouse-infecting helicobacter species bymultiplex PCR[J].Clin Diagn Lab Immunol,2005,12(4):531-536.
[5] Ding C,Feng J,Xie JY,et al.Epidemiological investigation of Helicobacter in laboratory rats and mice by PCR[J].Journal of Yangzhou University,2012,33(2):6-10.
[6] Nirah HS,Dangler CA,Robert PM,et al.Helicobacter bilis Helicobacter rodentium co-infection associated with diarrhea in a colony of scid mice[J].Laboratory Animal Science,1998,48 (5):455-459.
[7] Zhang LF,Liu X,Li H.Isolation and Identification of Rodent Helicobacters[J].Acta Laboratorium Animalis Scientia Sinica,2007,15(3):215-219.
[8] Miller CL, Muthupalani S, Shen ZL, et al.Isolation of Helicobacter spp.from mice with rectal prolapses[J].Comp Med,2014,64(3):171-178.
[9] Pandey M,Mishra RR,Dixit R,et al.Helicobacter bilis in human gallbladder cancer:results of a case-control study and a meta-analysis[J].Asian Pac JCancer Prev,2010,11(2):343 -347.
[10] 林祥梅.实验动物与出入境检验检疫[J].中国比较医学杂志,2011,Z1:34-38.
[11] Zheng Q,Bing F,Zheng M,etal.Identification of Helicobacter hepaticus firstly isolated in China from mice[J].Chinese Journal of Zoonoses,2009,25(3):210-213.
[12] 王静,张钰,闵凡贵,等.猴免疫缺陷病毒(SIV)实时荧光定量PCR检测方法的建立[J].中国比较医学杂志,2013,09:70-75
Detection of Helicobacter bilis using quantitative real-time PCR w ith TaqM an probe
WU Miao-li,YUANWen,RAO Dan,ZHU Yu-jun,WANG Jing,YIN Xue-qin,GUO Peng-ju
(Guangdong Laboratory Animals Monitoring Institute,Guangdong Key Laboratory of Laboratory Animals,Guangzhou 510663,China)
Objective To develop a rapid,sensitive and specific assay based on TaqMan probe real-time PCR to quantitate Helicobacter bilis(H.bilis).Method A 435 bp specific fragment of H.bilis P17 gene was amplified by PCR,then cloned into pMD19-T vector to constructa recombinant plasmid pMD-HBP17,which was used as standard DNA of this qPCR method.The qPCR system was optimized by using serial dilution of standard plasmid.The sensitivity,specificity,repeatability and quantitation range of thismethod were evaluated.The established method was used to detect 77 clinical samples.Result The quantitative standard curve from 108copies/well to 101copies/well of serial diluted plasmid DNAs showed that they had good linear correlation,the slope of the standard curvewas-3.46,R2>0.999,and the lowest limit reached 2×101copies/well.The positive rate of H.bilis detected by qPCR was 14.3%which is higher than detected by PCR(7.8%).Conclusion ThisqPCR method showed high sensitivity,specificity and stability and will be utilized for qualitative and quantitative detection of H.bilis.
Helicobacter bilis;QPCR;TaqMan probe
R-332
A
1671-7856(2015﹞10-0059-05
10.3969.j.issn.1671.7856.2015.010.014
国家科技支撑计划(2013BAK11B01)。
伍妙梨(1987-),女,硕士,研究方向:预防兽医学。
郭鹏举,研究员。E-mial:1517727522@qq.com。
﹞2015-08-18
技术方法
