秋刀鱼-20℃、-30℃和-50℃冻藏过程中品质变化
2015-05-07王凤玉曹荣赵玲任丹丹刘淇刘玉川
王凤玉,曹荣,赵玲,任丹丹,刘淇,*,刘玉川
(1.大连海洋大学食品工程学院,辽宁大连116071;2.中国水产科学研究院黄海水产研究所,山东青岛266071;3.蓬莱中柏京鲁船业有限公司,山东蓬莱265601)
秋刀鱼(Cololabis saira),属于颌针鱼目、竹刀鱼科、秋刀鱼属,主要分布于西北太平洋温带水域,是重要的远洋经济鱼类之一[1]。秋刀鱼风味独特,蛋白质和脂肪含量较高,含有人体必需的多种氨基酸且鲜味氨基酸含量丰富[2],在日本等地有悠久的食用历史。我国的远洋渔业起步较晚,2001年才开始逐步进行北太平洋秋刀鱼资源的探捕和开发利用,近几年我国秋刀鱼的捕捞量增长迅速,至2014年已达到7万余吨[3]。秋刀鱼所处海域距我国内陆远,需历经长时间的冻藏运输。冷冻会引起鱼肉蛋白质变性、脂肪氧化、肌肉组织结构松散等系列变化[4-5]。因而,研究秋刀鱼在冻藏过程中品质变化对于其冷链工艺的优化和资源的高效利用具有重要意义。
随着近海渔业资源的日益减少,远洋渔业资源的开发利用引起世界各国的广泛关注,远洋渔获物冷链贮运过程中品质变化与稳定化技术的研究成为国内外学者的研究热点。如Kimura等[6]对秋刀鱼在-10、-20℃和-40℃下三甲胺含量进行了研究,认为冻藏温度越低,三甲胺含量变化幅度越小。而有关秋刀鱼在冻藏过程中鲜度指标、生化指标以及组织结构变化的系统研究还较少。本文研究了在-20、-30℃和-50℃冻藏条件下,秋刀鱼蒸煮损失率、TVB-N值、肌原纤维蛋白含量、活性巯基含量、TBARS值以及肌肉组织微观结构的变化,以期为秋刀鱼冻藏工艺和货架期研究提供参考。
1 材料与方法
1.1 材料
秋刀鱼捕捞于北太平洋海域,在-35℃冻藏条件下运至黄海水产研究所食品工程与营养实验室。将秋刀鱼随机分为3组,放入保鲜袋中,分别在-20、-30℃和-50℃条件下冻藏。
1.2 方法
1.2.1 样品前处理
每隔15天取样一次,样品采用流水方式解冻,具体操作步骤为:冻结的秋刀鱼放入真空包装袋中,抽真空,之后置于塑料盒中,采用自然流水(常温)解冻,以秋刀鱼中心温度为0℃作为解冻终点。取鱼背部肌肉测定各项指标。
1.2.2 蒸煮损失率的测定
参照Sánchez-Alonso等[7]方法,稍作修改。从鱼背取4 cm×3 cm×3 cm大小的肌肉,放于保鲜袋中,在85℃水浴锅中,加热25 min后取出冷却至室温,用滤纸拭去其表面水分。按照如下公式计算。

1.2.3 挥发性盐基氮(TVB-N)的测定
根据GB/T 5009.44-2003《肉与肉制品卫生标准的分析方法》,采用微量扩散法[8]。
1.2.4 肌原纤维蛋白的提取及含量的测定
参照Wang等[9]的方法,略作修改。取5.00 g肉样,加入5倍质量0.1 mol/L KCl-20 mmol/L Tris-HCl缓冲液,匀浆,4℃条件下8 500 r/min离心10 min,弃上清液。在沉淀物中加入0.5 mol/L KCl-20 mmol/L Tris-HCl缓冲液50 mL,4℃浸提1 h,离心取上清液,即为肌原纤维蛋白溶液,通过双缩脲法测定其含量。
1.2.5 活性巯基的测定
参照Wu等[10]的方法,略作修改。将1 mL肌原纤维蛋白溶液中加入含有Tris-HCl(0.8 mL,0.2 mol/L)缓冲液的尿素中(8 mL,8 mol/L),混匀。取3 mL混合液加入0.02 mL DTNB溶液,静置15 min后,412 nm下测吸光度。计算公式为:
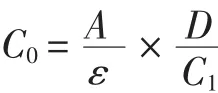
式中:C0为活性巯基的摩尔浓度,mol/g;A为412nm处吸光度;ε 为分子吸光系数 13600,mol·cm/L;D 为稀释倍数;C1为肌原纤维蛋白含量,mg/mL。
1.2.6 硫代巴比妥酸反应物(TBARS)含量测定
取5.00 g秋刀鱼肌肉,加入5%TCA溶液50 mL匀浆,8 500 r/min离心10 min。取上清液5 mL,加入0.02 mol/L TBA溶液5 mL,95℃水浴加热45 min。冷却至室温,532 nm下测定吸光度[11]。
1.2.7 肌肉组织结构观察
石蜡切片的制作参照汤元睿等[12]的方法,略作修改。将鱼肉切成3 mm×3 mm×2 mm薄片,放入40%的甲醛溶液中固定24 h。固定后乙醇梯度浓度脱水,然后用二甲苯进行透明处理,60℃浸蜡包埋,切片机切片,制片,光学显微镜观察。
1.2.8 数据处理
采用SPSS11.0软件进行数据处理,试验结果以平均值±标准偏差表示,组间采用t-检验进行显著性分析,P<0.01为极显著,P<0.05为显著,P>0.05为不显著。
2 结果与讨论
2.1 秋刀鱼冻藏过程中蒸煮损失率变化
不同冻藏温度下秋刀鱼的蒸煮损失率变化见图1。
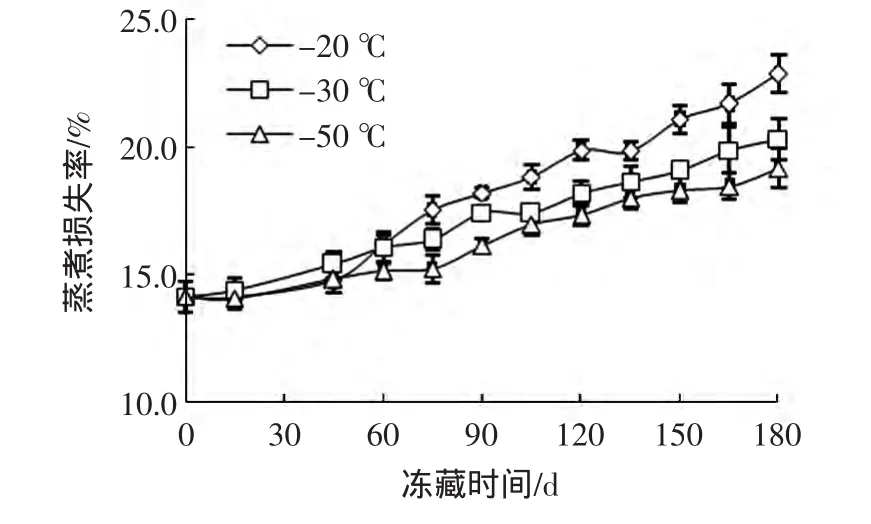
图1 秋刀鱼冻藏过程中蒸煮损失率变化Fig.1 Changes in cooking loss of Cololabis saira during storage
水产品在冻藏过程中,鱼肉蛋白会发生冷冻变性,导致肌肉持水力下降,同时一些水溶性维生素、矿物质等营养成分也将随着水分的流失而损失,造成鱼肉的营养价值的降低[13]。蒸煮损失率是评定肉及肉制品持水力的重要指标之一,并可以在一定程度上反映蛋白质冷冻变性的程度[14]。
新鲜秋刀鱼肌肉具有较好的持水能力,蒸煮损失率较低,仅为14.12%。随着冻藏时间的延长,蒸煮损失率呈现出上升趋势,这与鱼肉在冻藏过程中会发生肌球蛋白变性以及肌纤维细胞间隙增大,导致肌肉持水力的下降有关[15]。在前45天内,-20、-30℃和-50℃条件下的秋刀鱼蒸煮损失率无显著差异(P>0.05);从60天开始,-50℃组的蒸煮损失率显著低于-20℃组和-30℃组(P<0.05);第60天后,各组蒸煮损失率明显增大,总体上依次为-20℃组>-30℃组>-50℃组;至180天时,-20、-30℃和-50℃组的蒸煮损失率分别为22.85%、20.29%和19.14%,各组间有极显著差异(P<0.01)。
2.2 秋刀鱼冻藏过程中挥发性盐基氮(TVB-N)变化
秋刀鱼冻藏过程中挥发性盐基氮(TVB-N)变化见图2。

图2 秋刀鱼冻藏过程TVB-N值的变化Fig.2 Changes in TVB-N value of Cololabis saira during storage
TVB-N是指动物性原料或产品在腐败过程中蛋白质分解而产生的氨以及胺类等碱性含氮物质[16]。TVB-N一般随着鲜度的下降而增加,因此被广泛作为反映鱼、贝、虾类等水产品腐败程度的重要指标。秋刀鱼初始TVB-N值为7.70 mg/100 g,与三疣梭子蟹[17]、带鱼[18]比相对较高。水产鲜品的TVB-N与水产品种类、摄食类型、捕捞季节、生存环境等多种因素有关[19],秋刀鱼TVB-N含量相对较高,可能与其本身的化学组成有关。
冻藏过程中,秋刀鱼TVB-N值呈上升趋势。在冻藏前15天,秋刀鱼的TVB-N值变化不大,-20℃组、-30℃组和-50℃组之间无显著差异(P>0.05)。从第60天开始,-20℃组TVB-N值明显增大,第75天时显著高于-30℃组(P<0.05)和-50℃组(P<0.01)。第 180天时-20℃、-30℃和-50℃对应的TVB-N值分别为25.39 mg/100 g、18.98 mg/100 g和 16.01 mg/100 g。根据GB 2733-2005《鲜、冻动物性水产品卫生标准》,海鱼TVB-N≤30 mg/100 g为合格品[20]。冻藏180 d后,-20℃组秋刀鱼TVB-N值已接近30 mg/100 g的上限值,而-30℃组和-50℃组均未超过20 mg/100 g,说明更低温度条件下秋刀鱼鲜度保持更好。TVB-N值的增加与腐败微生物和蛋白酶活性有关[21],较低的冻藏温度更能抑制微生物的生长和酶活性,因此冻藏温度越低,鱼类产生的TVB-N值增加幅度越小。
2.3 秋刀鱼冻藏过程中肌原纤维蛋白含量变化
秋刀鱼冻藏过程中肌原纤维蛋白含量变化见图3。
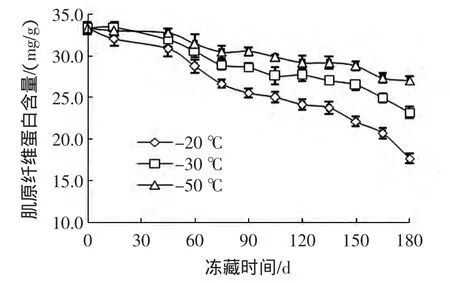
图3 秋刀鱼冻藏过程肌原纤维蛋白含量变化Fig.3 Changes in myofibrillar protein content of Cololabis saira during storage
肌原纤维蛋白是肌肉蛋白质的重要组成部分,通过测定其含量可表征肌肉蛋白冷冻变性的程度[22]。秋刀鱼在冻藏过程中,肌原纤维蛋白含量随贮藏时间的延长而下降,但不同温度条件下,肌原纤维蛋白含量下降的速度有明显差异,总体上冻藏温度越低,下降速度越慢。在冻藏前15天,各组间肌原纤维蛋白含量无显著差异(P>0.05)。从第60天开始,各组的肌原纤维蛋白含量产生显著差异(P<0.05)。至第180天时,-20、-30℃和-50℃组对应的肌原纤维蛋白含量分别下降到17.67、23.69 mg/g和27.01 mg/g,3组之间存在极显著差异(P<0.01)。
2.4 秋刀鱼冻藏过程中活性巯基含量变化
秋刀鱼冻藏过程中活性巯基含量变化见图4。

图4 秋刀鱼冻藏过程活性巯基含量变化Fig.4 Changes in sulfhydryl content of Cololabis saira during storage
巯基是蛋白质结构中十分活泼的基团[23]。秋刀鱼冻藏过程中,肌肉蛋白由于冷冻变性会发生内部结构的改变,巯基暴露氧化成二硫键,造成含量下降,同时二硫键的增加,使得蛋白分子间的网状结构得到加强,进一步影响了肌原纤维蛋白的溶解性。秋刀鱼冻藏过程中活性巯基含量变化与肌原纤维蛋白含量变化规律类似。在180 d内,活性巯基含量随冻藏时间的延长而下降,-20℃组下降速度相对较快。这与陶欢等[22]对3种淡水对虾冻藏中蛋白生化特性的研究结果类似。
2.5 秋刀鱼冻藏过程中硫代巴比妥酸反应物(TBARS)含量变化
秋刀鱼冻藏过程中硫代巴比妥酸反应物(TBARS)含量变化见图5。
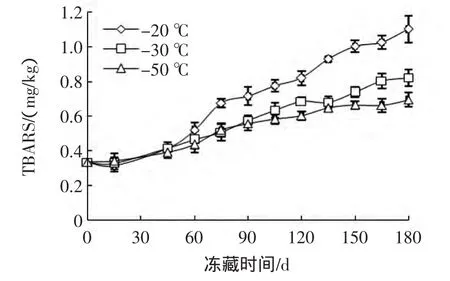
图5 秋刀鱼冻藏过程TBARS含量变化Fig.5 Changes in TBARS value of Cololabis saira during storage
水产品在贮藏过程中会发生酸败,TBARS值可用来评估脂质氧化程度[21]。秋刀鱼TBARS初始值为0.33 mg/kg,略高于一般水产品,这可能与秋刀鱼本身脂肪含量高有关[24]。秋刀鱼TBARS在贮藏初期变化不大,前45天内,-20℃组、-30℃组和-50℃组均没有显著增加,组间也无显著性差异(P>0.05)。第60天时,-20℃组的TBARS值开始快速增大,而-30℃组和-50℃组的TBARS值增加则相对平稳。-30℃组的TBARS值在第135天时有轻微下降,这可能与脂质氧化生成的MDA和其他短链物质不稳定,在贮藏过程中可进一步分解成有机醇和有机酸有关[25]。至冻藏第180天时,3组 TBARS值有极显著差异(P<0.01),-20℃组TBARS值为1.10 mg/kg,已达到轻度腐败的程度。
2.6 秋刀鱼冻藏过程中肌肉组织结构变化
秋刀鱼冻藏过程中肌肉组织结构变化见表1。

表1 秋刀鱼冻藏过程肌肉组织结构变化Table 1 Changes in muscular tissue of Cololabis saira during storage
新鲜秋刀鱼样品的肌纤维间间隙很小,肌纤维束结合紧密,无断裂现象。冻藏第45天后,3组秋刀鱼肌肉组织中出现不同程度的少量细小间隙,但整体上肌纤维变化相差不大,组间无明显差异。第90天时,-30和-50℃下秋刀鱼肌肉组织结构比较完整,肌纤维束结合较为紧密,但肌纤维间隙已开始增大,而-20℃下肌肉组织中则产生了较大的孔洞,肌纤维束发生轻微松散。第180天时,-20℃秋刀鱼肌纤维组织松散,肌纤维发生断裂,轮廓不清晰。-30℃下肌纤维空隙进一步增大,发生少量的断裂。-50℃与其他两组相比肌纤维分离间隙较小且较平均,形态依旧保持完整。说明-50℃储存条件对秋刀鱼肌纤维变化影响小。
3 结论
秋刀鱼在-20、-30℃和-50℃条件下贮藏,各项理化指标的变化趋势基本一致,但变化幅度有较大差异。总体上,冻藏温度越高,秋刀鱼肌肉持水能力越差,蒸煮损失率下降越明显;冻藏结束时,-20℃组的TVB-N值极显著高于另两组(P<0.01),而-30℃和-50℃组间差异较小;冻藏过程中,秋刀鱼肌肉蛋白发生冷冻变性,导致肌原纤维蛋白及巯基含量逐渐下降;秋刀鱼TBARS值随着冻藏时间的延长而增加,其中 -20℃组的TBARS值增加较快,180天时为1.10mg/kg,已达到脂肪轻微酸败程度;冻藏破坏了秋刀鱼肌肉组织结构,使肌纤维束变得松散,肌纤维之间的空隙增大,且冻藏温度越高,这种变化越明显。
冻藏至第180天时,与其他两组相比,-20℃条件下的秋刀鱼品质劣化程度更为明显,各项指标已接近货架期终点。从品质保持和经济效能的角度,-30℃适宜作为秋刀鱼冷冻贮藏的温度。
[1] Tseng C T,Sun C L,Yeh S Z,et al.Influence of climate-driven sea surface temperature increase on potential habitats of the Pacific saury(Cololabis saira)[J].ICES Journal of Marine Science:Journal du Conseil,2011,68(6):1105-1113
[2] Tanaka R,Naiki K,Tsuji K,et al.Effect of antioxidative treatments on lipid oxidation in skinless fillet of pacific saury Cololabis saira in frozen storage[J].Journal of Food Processing and Preservation,2013,37(4):325-334
[3] 周爱忠,张勋,张禹,等.我国开发西北太平洋公海秋刀鱼资源的SWoT分析与策略[J].现代渔业信息,2010,25(3):8-11
[4] Ali Sahari M,Pirestani S,Barzegar M.Effect of Frozen Storage on Quality Changes of Five Fish Species from South Caspian Sea[J].Current Nutrition&Food Science,2013,9(4):315-320
[5] Robinson J,Barnabas E R,Nathan F.Quality changes of farmed cobia steaks held in cold stores(-18℃)[J].International Journal of Food Science&Technology,2012,47(11):2429-2435
[6] Kimura M,Hiraoka Y,Kimiya T,et al.Formation of trimethylamine in Pacific saury muscle during frozen storage[J].Nippon Suisan Gakkaishi,2010,76(6):1073-1079
[7] Sánchez-Alonso I,Haji-Maleki R,Borderias A J.Wheat fiber as a functional ingredient in restructured fish products[J].Food Chemistry,2007,100(3):1037-1043
[8] 中华人民共和国卫生部,中国国家标准化管理委员会.GB/T5009.44-2003肉与肉制品卫生标准的分析方法[S].北京:中国标准出版社,2007
[9] Wang H,Luo Y,Shen H.Effect of frozen storage on thermal stability of sarcoplasmic protein and myofibrillar protein from common carp(Cyprinus carpio)muscle[J].International Journal of Food Science&Technology,2013,48(9):1962-1969
[10]Wu H,Wang Z,Luo Y,et al.Quality Changes and Establishment of Predictive Models for Bighead Carp (Aristichthys nobilis)Fillets During Frozen Storage[J].Food and Bioprocess Technology,2014,7(12):3381-3389
[11]Paola A S,Isabel Y M.Effect of Frozen Storage on Biochemical Changes and Fatty Acid Composition of Mackerel(Scomber japonicus)Muscle[J].Journal of Food Research,2014,4(1):135
[12]汤元睿,谢晶,李念文,等.不同冷链物流过程对金枪鱼品质及组织形态的影响[J].农业工程学报,2014,30(5):285-292
[13]王晓香,夏杨毅,孙金辉,等.冻藏对兔肉理化特性及微观结构的影响[J].食品科学,2014(14):46
[14]Benjakul S,Sutthipan N.Muscle changes in hard and soft shell crabs during frozen storage[J].LWT-food science and Technology,2009,42(3):723-729
[15]Skipnes D,Østby M L,Hendrickx M E.A method for characterising cooklossandwaterholdingcapacityinheattreatedcod(Gadusmorhua)muscle[J].Journal of food engineering,2007,80(4):1078-1085
[18]杨胜平,谢晶,高志立,等.冷链物流过程中温度和时间对冰鲜带鱼品质的影响[J].农业工程学报,2013,29(24):302-310
[19]Goulas A E,Kontominas M G.Combined effect of light salting,modified atmosphere packaging and oregano essential oil on the shelflife of sea bream(Sparus aurata):Biochemical and sensory attributes[J].Food Chemistry,2007,100(1):287-296
[20]中华人民共和国卫生部,中国国家标准化管理委员会.GB 2733-2005鲜、冻动物性水产品卫生标准[S].北京:中国标准出版社:2005
[21]Fuentes A,Masot R,Fernández-Segovia I,et al.Differentiation between fresh and frozen-thawed sea bream (Sparus aurata)using impedance spectroscopy techniques[J].Innovative Food Science&Emerging Technologies,2013(19):210-217
[22]陶欢,陈舜胜.三种淡水对虾在冻藏过程中蛋白质特性的变化[J].水产学报,2010,34(3):389-394
[23]Wedemeyer WJ,Welker E,Narayan M,et al.Disulfidebonds?and?protein?folding[J].Biochemistry,2000,39(15):4207-4216
[24]叶彬清,陶宁萍,王锡昌.秋刀鱼肌肉营养成分分析及评价[J].营养学报,2014,36(4):406-408
[25]Borneo R,León A E,Aguirre A,et al.Antioxidant capacity of medicinal plants from the Province of Córdoba(Argentina)and their in vitro testing in a model food system[J].Food Chemistry,2009,112(3):664-670
