制备抗五氯酚钠单克隆抗体及其应用于酶联免疫试剂盒的初步研究
2015-05-05冯才伟贾芳芳
刘 欢,冯才伟,贾芳芳,冯 静,彭 鸽,张 瑜
(1.中国水产科学研究院,北京100141;2.北京勤邦生物技术有限公司,北京 102206)
制备抗五氯酚钠单克隆抗体及其应用于酶联免疫试剂盒的初步研究
刘 欢1,冯才伟2,*,贾芳芳2,冯 静2,彭 鸽2,张 瑜2
(1.中国水产科学研究院,北京100141;2.北京勤邦生物技术有限公司,北京 102206)
本文通过五氯酚钠与4-溴丁酸乙酯经过一系列反应,得到半抗原,制备出抗五氯酚钠单克隆抗体,然后利用酶联免疫技术研制了一种快速检测鱼肉、虾肉中的五氯酚钠试剂盒,经过测试,该试剂盒对鱼肉、虾肉样本的检测限为0.75 μg/kg,IC50为0.31 μg/L,平均回收率为71.5%~104.7%,试剂盒的标准曲线范围为0.05~4.05 μg/L,批内、批间相对标准偏差小于10%,稳定性良好。
五氯酚钠,单克隆抗体,酶联免疫试剂盒
五氯酚钠是一种性质稳定的农药,可用于杀虫、抗菌、防腐、除草等[1-3]。由于五氯酚钠容易污染环境,并且容易在人体内富集[4-5],因此,五氯酚钠被美国列为可疑致癌物质,限制其使用;我国农业部于2002年也将五氯酚钠列入《食品动物禁用的兽药及其化合物清单》,禁止在水生动物养殖中使用[6-7]。
由此可见,研究水产中五氯酚钠残留量的检测方法是有必要的。然而,目前现有的气相色谱法、气相色谱-电子捕获法、气相色谱-氢火焰法等仪器方法[8-14],由于其费用昂贵及操作难度等缺点,较难用于基层单位对大量样本的筛查。因此,我们制备了抗五氯酚钠单克隆抗体,并将其应用于检测鱼肉、虾肉等水产组织中五氯酚钠含量的酶联免疫试剂盒的开发。
1 材料与方法
1.1 材料与仪器
五氯酚钠标准品 北京标准物质研究中心;牛血清白蛋白、卵清蛋白、氢氧化钠以及磷酸盐 北京百欣试剂公司;鱼肉、虾肉 超市。
酶标仪(最大量程为4.0) 上海雷勃分析仪器有限公司;涡旋仪、均质器 湖南湘立科学仪器有限公司。
1.2 制备抗原
1.2.1 制备半抗原 1.0 g五氯酚钠与4-溴丁酸乙酯在DMF中,在无水碳酸钾与碘化钠的催化下,反应生成五氯酚-4溴-丁酸乙酯产物,经乙酸乙酯萃取,水洗,柱层析纯化分离,得到中间产物,中间产物在氢氧化钾的水溶液中加热反应,水解生成半抗原,经乙酸乙酯提取,二氯甲烷重结晶,得到半抗原产物。

图1 五氯酚钠半抗原合成Fig.1 Synthesis of pentachlorophenoI-Na hapten
1.2.2 制备免疫原——半抗原与牛血清白蛋白(BSA)偶联物合成 取18 mg半抗原,溶解于1 mL N,N-二甲基甲酰胺中,得到溶液(1),取氯甲酸异丁酯50 μL加入(1)中,4 ℃下搅拌30 min,得到反应液A。称取BSA 50 mg,使之充分溶解在4.0 mL PBS(pH7.2)中,将反应液A逐滴缓慢滴加到蛋白溶液中,并于室温下搅拌24 h,用0.01 mol/L PBS 4 ℃透析3 d,每天换3次透析液,于-20 ℃保存备用。通过紫外扫描法鉴定半抗原与载体蛋白的偶联是否偶联成功。
1.2.3 制备包被原——半抗原与卵清蛋白(OVA)偶联物合成 取18 mg半抗原,溶解于1 mL N,N-二甲基甲酰胺,得到溶液(1),取50 μL氯甲酸异丁酯加入(1)中,4 ℃下搅拌30 min,得到反应液A。称取50 mg的卵清蛋白,溶解于4.0 mL PBS(pH7.2)中,将反应液A滴加到蛋白溶液中,室温搅拌24 h,用0.01 mol/L PBS 4 ℃透析3 d,每天换3次透析液,于-20 ℃保存备用。通过紫外扫描法鉴定半抗原与载体蛋白的偶联是否偶联成功。
1.3 制备单克隆抗体以及酶标记抗抗体
1.3.1 单克隆抗体的制备
1.3.1.1 动物免疫 按照150 μg/只的免疫剂量将免疫原注入到Balb/c小鼠体内,从而获得抗血清。
1.3.1.2 细胞融合和克隆化 测定小鼠血清,测定血清效价,效价结果达到1∶2000~1∶1000,取小鼠脾细胞,按照8∶1的数量配比和SP2/0骨髓瘤细胞融合,利用间接竞争酶联免疫法测定细胞上清液,进行阳性孔筛选。通过有限稀释法克隆化阳性孔,从而得到能够分泌五氯酚钠单克隆抗体的杂交瘤细胞株。
1.3.1.3 细胞冻存和复苏 用冻存液将1.3.1.2得到的单克隆杂交瘤细胞株制成1×106个/mL的细胞悬液,用液氮保存。复苏时,将取出的冻存管立即放入37 ℃水浴中,离心去除冻存液,最后移入培养瓶内培养。
1.3.1.4 单克隆抗体的生产与纯化 按照0.5 mL/只的灭菌石蜡油剂量注入Balb/c小鼠腹腔,一周后,按照5×105个/只的剂量向腹腔注射稳定的单克隆杂交瘤细胞株,一周后可采集腹水。可通过辛酸-饱和硫酸铵法纯化腹水。
1.3.2 酶标记抗抗体的制备 将1.3.1得到的鼠源抗体免疫无病原体羊,得到羊抗鼠抗抗体[15],利用过碘酸钠法,将其与辣根过氧化物酶(HRP)偶联[16],得到酶标记抗抗体。
1.4 筛选抗原包被浓度以及单克隆抗体浓度
百分吸光率(%)=(标准品或样本溶液的平均吸光度值/0 μg/L标准溶液的平均吸光度值)×100。测定浓度为0,0.05 μg/L的五氯酚钠标准品的百分吸光率,测定波长为450 nm,抗原稀释倍数依次为:1∶2000,1∶4000,1∶8000;单克隆抗体稀释倍数依次为:1∶50000,1∶100000,1∶200000,1∶400000;酶标记抗抗体液的稀释倍数为1∶1000。
1.5 制备酶标板
将优选浓度的抗原包被液100 μL包被于96孔酶标板中,置于37 ℃,孵育2 h,洗板后,加入150 μL封闭液(0.05%BSA溶解于0.02mol/L PBS),置于37 ℃,孵育2 h。
1.6 鱼肉、虾肉的前处理方法
向1.0 g搅拌均匀的样本中加入2 mL 0.1 mol/L NaOH,涡旋2 min,再加入8 mL乙腈,涡旋3 min,离心5 min,转速为3000 r/min。取上清液1 mL到10 mL的玻璃试管中,50~60 ℃水浴氮气流下吹干;再加入1.5 mL 0.02 mol/L的磷酸盐缓冲液,涡旋30 s即可。
1.7 测定鱼肉、虾肉的OD450 nm值
向酶标板每孔中加入50 μL标准品(浓度为0、0.05、0.15、0.45、1.35、4.05 μg/L)和50 μL鱼肉、虾肉样本,再加入适宜稀释后的抗体液50 μL,25 ℃避光30 min。洗板后,每孔加入100 μL酶标记抗抗体,25 ℃避光30 min。洗板后,每孔加入50 μL过氧化氢,再加入50 μL四甲基联苯胺,25 ℃避光15 min。最后加入50 μL 2 mol/L H2SO4,测定酶标板孔OD450 nm值。
1.8 鱼肉、虾肉中五氯酚钠的实际浓度计算方法
分别以五氯酚钠标准品浓度(μg/L)的对数、标准品百分吸光率为标准曲线的横、纵坐标,然后将鱼肉、虾肉的OD450 nm代入标准曲线,得到相应的浓度,该浓度乘以稀释倍数即为鱼肉、虾肉中五氯酚钠含量。
1.9 灵敏度和检测限
分别检测20份鱼肉、虾肉的空白样本,利用空白样本浓度的平均值加上3倍标准差计算检测限(LOD)。LOD是检测方法可检测出的最低被测物浓度,也称为检测低限或最小检出浓度[17]。
1.10 精密度和准确度
我国农业部于2002年也将五氯酚钠列入《食品动物禁用的兽药及其化合物清单》(中华人民共和国农业部公告第193号),禁止在水生动物养殖中使用。《农残办技术材料要求及审查程序》对兽药残留酶联免疫检测试剂盒的备案技术资料要求:对于禁用药物,添加浓度至少为1倍定量限和2倍定量限。定量限(LOQ)是指在精密度和正确度可接受的情况下检测系统能够得到可靠结果的被测物最低浓度,分析物在这个浓度下被可靠检出[18]。分别对鱼肉、虾肉样本添加五氯酚钠,使其浓度达到1倍定量限和2倍定量限,测定添加回收率,用来考察准确度。同时,每个样本做4个平行,包被3批酶标板,计算相对标准偏差(RSD%),用来考察精密度。
1.11 稳定性
将试剂盒存放在4 ℃,每个月测定一次,连续测定12个月;将试剂盒存放在37 ℃,每天测定一次,连续测定7 d。记录试剂盒的最大吸光度值(0 μg/L)、50%抑制浓度以及1.5、3.0 μg/kg的添加鱼肉、虾肉空白样本的回收率,评价不同时间、不同温度对试剂盒的稳定性影响。
1.12 交叉反应率实验
2,4-二氯酚、2,4,6-三氯酚、苯酚与五氯酚钠具有类似结构[19],对其进行酶联免疫吸附测定,通过标准曲线分别得到其50%抑制浓度,用下式计算试剂盒对2,4-二氯酚、2,4,6-三氯酚、苯酚的交叉反应率:
交叉反应率(%)=引起50%抑制的五氯酚钠浓度/引起50%抑制的五氯酚钠类似物浓度×100
2 结果与分析
2.1 半抗原与人工抗原的鉴定
2.1.1 鉴定半抗原 核磁共振氢谱测定已制备的五氯酚钠半抗原,其质子核磁共振(H-NMR)数据:11.0(1H,COOH)、4.0(2H,Ph-O-CH2-)、2.0(2H,-CH2-)、2.3(2H,-CH2-COO-)谱图见图2。

图2 五氯酚钠半抗原核磁共振氢谱Fig.2 Proton NMR Spectra of pentachlorophenoI-Na hapten
取上述产物经核磁共振氢谱测定,化学位移在4.0 ppm处的为邻近酚氧的亚甲基信号峰,2.0 ppm处两组为亚甲基信号峰,11 ppm处为羧基氢信号峰,说明半抗原合成成功[20-21]。
2.1.2 鉴定人工抗原 通过紫外扫描法鉴定人工偶联抗原,见图3、图4。偶联抗原、半抗原、载体蛋白的紫外吸收曲线各不相同,说明人工抗原有效偶联。
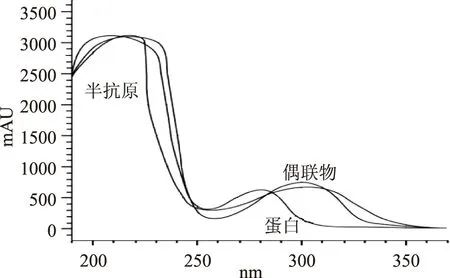
图3 五氯酚钠半抗原-牛血清白蛋白的紫外吸收光谱Fig.3 Ultraviolet absorption spectrum of PCP-Na Hapten-BSA

图4 五氯酚钠半抗原-卵清蛋白的紫外吸收光谱Fig.4 Ultraviolet absorption spectrum of PCP-Na hapten-OVA
2.2 筛选抗原包被浓度以及单克隆抗体浓度
测定浓度为0 μg/L和0.05 μg/L的五氯酚钠标准品的OD450 nm,见表1。
当OD450 nm(0.05 μg/L)/OD450 nm(0 μg/L)的抑制率在70%~85%时,以抗原、单克隆抗体的最大稀释倍数作为抗原、单克隆抗体的最佳稀释倍数[22],由此可见,本研究中的最佳抗原稀释倍数为4000,最佳单克隆抗体稀释倍数为200000。

表1 抗原、抗体的浓度筛选(OD450nm)
2.3 标准曲线
实验表明,标准曲线的范围为0.05~4.05 μg/L,IC50(50%抑制浓度)为0.31 μg/L;线性方程y=-0.7x+6.579,R2为0.9942。

表2 标准曲线的酶联免疫法测定

表3 鱼肉空白样本检测限测定结果(μg/L)

表4 虾肉空白样本检测限测定结果(μg/L)

表5 鱼肉、虾肉精密度及准确度实验
2.4 灵敏度和检测限
本研究对鱼肉、虾肉样本的检测限为0.75 μg/kg,见表3、表4。
2.5 精密度和准确度
测定添加不同浓度五氯酚钠的鱼肉、虾肉样本,平均回收率范围是70.8%~90.2%,可见当添加浓度为1.5、3.0 μg/kg时,试剂盒符合农医发[2005]17号规定的回收率范围大于40%或符合相应检测标准的要求,并且符合本实验平台技术要求的60%~130%,即检测样本能够得到可靠结果,LOQ=1.5 μg/kg,建立的LOD和LOQ的关系符合LOD≤LOQ[23];批内相对标准偏差范围是5.7%~9.9%;批间相对标准偏差范围是9.4%~9.8%,见表5。
2.6 稳定性
将试剂盒分别保存在4 ℃和37 ℃,测定的试剂盒的最大吸光度值(0 μg/L)范围是1.75~1.99,50%抑制浓度范围是3.0~4.0 μg/L,五氯酚钠添加回收率范围是71.5%~104.7%,由此可见,各指标均在正常范围之内,结果见表6、表7。从测定结果可知,该试剂盒在4 ℃至少能够保存12个月,在37 ℃至少能够保存7 d。

表6 试剂盒在4 ℃保存的稳定性

表7 试剂盒在37 ℃保存的稳定性
2.7 交叉反应率实验
五氯酚钠抗体与2,4-二氯酚、2,4,6-三氯酚、苯酚的交叉反应率见表8。

表8 交叉反应率实验
由表8可知,五氯酚钠抗体与2,4-二氯酚、2,4,6-三氯酚、苯酚的交叉反应率分别为1.6%,4.9%,0.3%。
3 讨论
余宇燕[23-24]等采用了氯乙酸法合成五氯酚(PCP)的衍生物五氯苯氧乙酸半抗原,在此基础上,采用活化酯法合成五氯酚的人工抗原,制备单克隆抗体。本文制备的五氯酚钠半抗原结构的间隔臂为4个碳长度的碳链,与蛋白结合后,能够更大限度地暴露在其表面,突出小分子结构特征,使免疫出的抗体具有更好的亲和力。
GB 29708-2013《食品安全国家标准 动物性食品中五氯酚钠残留量的测定》使用气相色谱-质谱法测定动物性食品中的五氯酚钠残留量,该方法的实验样本为猪的肌肉、肝脏和肾脏及鸡的肌肉和肝脏组织[25],未使用鱼肉、虾肉作为样本。目前,尚未检索到鱼肉、虾肉样本中五氯酚钠含量检测的国家标准,相关文献也较少。因此,可为检测水产样本中五氯酚钠提供一定的手段。
4 结论
本研究制备了抗五氯酚钠单克隆抗体,并将其应用于酶联免疫试剂盒的开发,通过一系列实验,确定了最佳的抗原液浓度和单克隆抗体浓度,得到该试剂盒的标准曲线范围为0.05~4.05 μg/L,鱼肉、虾肉的检测限为0.75 μg/kg,平均回收率为71.5%~104.7%。批内相对标准偏差范围是5.7%~9.9%,批间相对标准偏差范围是9.4%~9.8%,重现性较好。五氯酚钠抗体与2,4-二氯酚、2,4,6-三氯酚、苯酚的交叉反应率分别为1.6%,4.9%,0.3%。稳定性是评价试剂盒质量的一个重要方面[26-27],本研究的试剂盒在4 ℃能够保存12个月,在37 ℃下能够保存7 d,各项测定指标均在正常范围之内,说明该试剂盒具有良好的稳定性。
[1]胡滨,陈一资,胡惠民. 动物性食品中五氯酚钠残留及对人畜毒害的研究[J]. 肉品卫生,2005(2):27-29.
[2]杨淑贞,韩晓冬,陈伟.五氯酚对生物体的毒性研究进展[J].环境与健康杂志,2005,22(5):396-398.
[3]张彤晴,蒋丽娟,葛家春,等. 五氯苯酚对渔业环境的危害与对策研究进展[J]. 江苏农业科学,2007(4):256-259.
[4]杨彩根,宋学宏,孙涛,等.五氯酚钠在青虾体内的药代动力学研究[J].江苏农业科学,2012,40(3):265-267.
[5]肖宇芳,刘广民,董永亮,等.土壤中五氯酚的快速测定[J]. 岩矿测试,2008,27(2):117-119.
[6]Agency for Toxic Substances and Disease Registry(ATSDR). Tox FAQsTMfor Pentachlorophenol[EB/OL].[2011-03-15].
[7]中华人民共和国农业部.《食品动物禁用的兽药及其化合物清单》(公告第193号)[Z].北京,2002.
[8]国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社,1985:368-370.
[9]李荣,甘金华,徐进,等. 气相色谱-电子捕获法直接测定水体中的五氯酚钠[J]. 中国环境监测,2012,28(1):44-46.
[10]Lars Rudling. Determination of pentachlorphyenol in organic tissues and water[J]. Water Research,1970(4):533-537.
[11]费志良,葛家春,吴军,等. 气相色谱测定青虾、草鱼肌肉中五氯苯酚及其钠盐残留总量的方法[J]. 南京师大学报:自然科学版,2004,27(3):70-73.
[12]薛辉利,张晓辉,杜建明,等. 虾类中五氯苯酚残留的气相色谱分析[J]. 福建分析测试,2009,18(3):64-65.
[13]池缔萍.固相微萃取气相色谱法测定水产品中五氯苯酚及其钠盐残留量[J]. 分析实验室,2007(12):31-323.
[14]洪爱华,尹平河,梁志红. 高效液相色谱-质谱联用法测定饮用水中的五氯苯酚[J]. 生态环境学报,2010(1):69-71.
[15]杨利国,胡少昶,魏平华,等.酶联免疫技术[M].江苏:南京大学出版社,1998.
[16]郭春祥,郭锡琼.介绍一种简单、快速、高效的辣根过氧化物酶标记抗体的过碘酸钠法[J].免疫学杂志,1983(33):97-100.
[17]冯仁丰.分析灵敏度(检测限)[J].上海医学检验杂志,2002,17(3):133-136.
[18]杨有业,张秀明.临床检验方法学评价[M].北京:人民卫生出版社,2008:142-167.
[20]马兆扬,黄金祥.半抗原:N-甲基-N′-戊酸基-二吡啶-二溴化物的合成[J].卫生研究,2004,33(2):220-221.
[21]田园. 展青霉素特异性抗体的制备及其免疫学检测方法的研究[D].泰安:山东农业大学,2012.
[22]董李学,冯才伟,冯静,等. 抗氧氟沙星单克隆抗体的制备及ELISA快速试剂盒的初步研制[J].中国畜牧兽医,2014,41(8):90-94.
[23]谭丽娜,杨泽华,赵克斌.酶联免疫法检测血清乙型肝炎表面抗原的空白限检出限及定量限的建立与评价[J].中国药物与临床,2013,13(2):144-146.
[24]余宇燕,张淑玲,邹艳辉,等.五氯酚钠免疫层析检测试纸条的研究[J].分析测试学报,2014,33(7):830-834.
[25]余宇燕,唐舒雅,庄惠生.五氯酚人工抗原的合成与多克隆抗体的制备[J].农业环境科学学报,2007,26(1):314-317.
[26]中华人民共和国农业部、中华人民共和国国家卫生和计划生育委员会.,GB 29708-2013《食品安全国家标准 动物性食品中五氯酚钠残留量的测定》[S].北京,2013.
[27]唐伟国. 医学检验诊断试剂的制备与应用[M]. 上海:上海科技文献出版社,1996:99.
[28]刘英华,陈瑛. 叶酸的检测方法及临床应用研究进展[J].中国妇幼保健,2013,28(1):177-180.
Study on the production of pentachlorophenoi-na monoclonal antibodies and its enzyme linked immunosorbent assay kit for rapid detection
LIU Huan1,FENG Cai-wei2,*,JIA Fang-fang2,FENG Jing2,PENG Ge2,ZHANG Yu2
(1.Chinese Academy of Fishery Sciences,Beijing 100141,China;2. Beijing Kwinbon Biotechnology Company,Beijing 102206,China)
The synthesized pentachlorophenoI-na hapten was prepared from a sequence of reactions that used pentachlorophenoI-Na and 4-Bromobutyric acid ethyl ester. And pentachlorophenoI-Na monoclonal antibodies were prepared by pentachlorophenoI-Na antigen. Then the limit of detection and relative standard deviation(RSD)of pentachlorophenoI-Na enzyme linked immunosorbent assay kit was studied. The limit of detection was 0.75 μg/kg in fish and shrimp,with the IC50values of 0.31 μg/L. The average recoveries were between 71.5% and 104.7%. The standard curve ranged from 0.05 to 4.05 μg/L,and RSD was less than 10%. The stability tests results revealed that the kit can be kept for a long time.
PentachlorophenoI-Na;monoclonal antibodies;enzyme linked immunosorbent assay kit
2014-12-30
刘欢(1980-),女,博士,研究方向:水产品质量安全检测技术及管理,E-mail:liuh@cafs.ac.cn。
*通讯作者:冯才伟(1978-),男,硕士,研究方向:食品安全检测技术研究,E-mail:fengcaiwei@kwinbon.com。
TS207.3
A
1002-0306(2015)21-0307-06
10.13386/j.issn1002-0306.2015.21.055
