太湖大银鱼( Protosalanx chinensis) 细胞色素b 基因序列多态性分析
2015-04-02李大命张彤晴唐晟凯钟立强
李大命, 张彤晴, 唐晟凯, 钟立强
( 江苏省淡水水产研究所,江苏省内陆水域渔业资源重点实验室,江苏 南京210017)
银鱼科( Salangidae) 鱼类又称银鱼( Icefish or Salangid) ,为一年生小型名贵鱼类,具有很高的经济价值和营养价值[1]。大银鱼( Protosalanx chinensis)隶属于银鱼科,新银鱼亚科( Neosalanginae) ,大银鱼属( Protosalanx) ,是银鱼科中个体最大的种,主要分布在朝鲜半岛西海岸至瓯江以北各水系及近海岸,系近海河口洄游或淡水定居鱼类。大银鱼在中国水体中分布广泛,且具有重要的渔业价值,曾为中国重要的出口创汇水产品。近30 多年来,由于水体生态环境污染、水利工程建设和过渡捕捞等因素,中国野生大银鱼的资源量严重下降[2],开展大银鱼资源保护已经迫在眉睫。
遗传多样性是评估资源现状、制定野生种群保护和管理策略的重要前提[3-4]。有关大银鱼的研究主要集中在形态学、个体生态学和繁殖生物学等方面[2]。近年来,国内外学者对银鱼的遗传学开展了一些研究,主要集中在银鱼的分子系统发育、遗传多样性和种群结构等方面。比如,罗宏伟等分析了三峡库区大银鱼、太湖新银鱼和短吻间银鱼线粒体DNA 细胞色素b 基因序列多态性[5]; 郭立等采用4个线粒体基因片段研究了银鱼科鱼类的系统发育[6];Zhang 等在长江流域利用cyt b 基因全序列对全世界17 种银鱼中的15 种银鱼属间的分子系统发育关系进行了比较[7]; Zhao 等利用线粒体cyt b 基因全序列对淮河、长江以及珠江流域的太湖新银鱼13 个种群共计354 个个体的遗传多样性和种群结构进行了分析[8]。
太湖是中国第三大淡水湖泊,湖泊渔业是其最重要的功能之一[9-10]。在太湖渔业中,银鱼占有非常重要的地位,大银鱼占太湖银鱼渔业年总产量的50%以上,产品大都出口,创造了巨大的经济效益[11]。国内学者对太湖大银鱼的胚胎发育、生长和食性等进行了研究[11-13],但对太湖大银鱼的遗传学研究较少,仅见夏德全等采用RAPD 技术分析了太湖银鱼种群遗传结构特征[14]。近10 多年来,则鲜有太湖大银鱼遗传多样性的研究报道。本试验采用cyt b 基因作为分子标记,对太湖大银鱼的遗传多样性进行初步研究,为合理开发和利用大银鱼野生资源,以及保护太湖银鱼种质资源提供科学依据。
1 材料和方法
1.1 试验材料
大银鱼于2013 年5 月采自太湖漫山水域,随机选择35 尾样本,其体长在3.1 cm 至6.5 cm 之间。每个大银鱼样本剪少量尾鳍条放入无水乙醇中固定,带回实验室保存备用。
1.2 DNA 提取
大银鱼样本基因组DNA 的提取参照Sambrook等的方法[15]。采用分光光度计( Unico UV-4802H)和1%琼脂糖凝胶电泳分别测定DNA 浓度和检测DNA 质量。置于-20 ℃储存备用。
1.3 PCR 扩增及测序
扩增cyt b 基因的引物为L14321 和H15634[7]。L14321 引物序列: 5'-CCAGTGACTTGAAAAACCACCG-3'; H15634 引物序列: 5'-CTTAGCTTTGGGAGTTAAGGGT-3',引物由上海生物工程有限公司合成。
PCR 反应体系总体积为50 μl,其中2×PCR Mix 25 μl ( 包括Taq 酶1.25 U,dNTPs 10 μmol,MgCl20.1 mmol ) ,上、下游引物(10 μmol/L) 各2 μl,DNA 模板2 μl,其余体积用超纯水补足。PCR 反应程序为:94℃预变性4 min;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸90 s,30 个循环;72 ℃延伸10 min。
PCR 产物用1%琼脂糖凝胶电泳检测,对扩增效果好的PCR 产物进行割胶纯化后,直接送上海生物工程有限公司进行测序,为保证所测序列的可靠性,所有样品均采用双向测序。
1.4 数据统计与分析
采用DNAstar[16]软件对DNA 序列进行比对拼接,并辅以人工校对。用DnaSP[17]软件计算多态位点数目( Np) 、单倍型数目( Nh) 、单倍型多样性指数( h) 、核苷酸多态性( π) 和平均核苷酸差异数( k)等。用MEGA 4.1[18]软件计算序列的碱基组成、变异位点和简约信息位点。以太湖新银鱼( Neosalanx taihuensis) 为外群,采用邻接法( Neighbor-Joining,NJ) 构建单倍型分子系统树,并对各分支进行1 000次重复检验。利用Tajima’s D 中性检验分析大银鱼种群历史上是否发生扩张。
2 结果
2.1 太湖大银鱼cyt b 基因碱基组成和变异分析
经校对获得35 条cyt b 基因同源序列,其长度为1 141 bp,序列中碱基A、T、G 和C 的平均含量分别为21.7%、29.3%、16.7%和32.4%,A +T 的含量( 50.92%) 略高于G + C 的含量( 49.07%) 。在这1 141 bp 序列中,共检测到13 个变异位点,占分析位点总数的1.14%。其中9 个为简约位点,4 个单一多态位点( 表1) 。这些突变位点中有11 个转换位点和2 个颠换位点,没有插入和丢失位点。
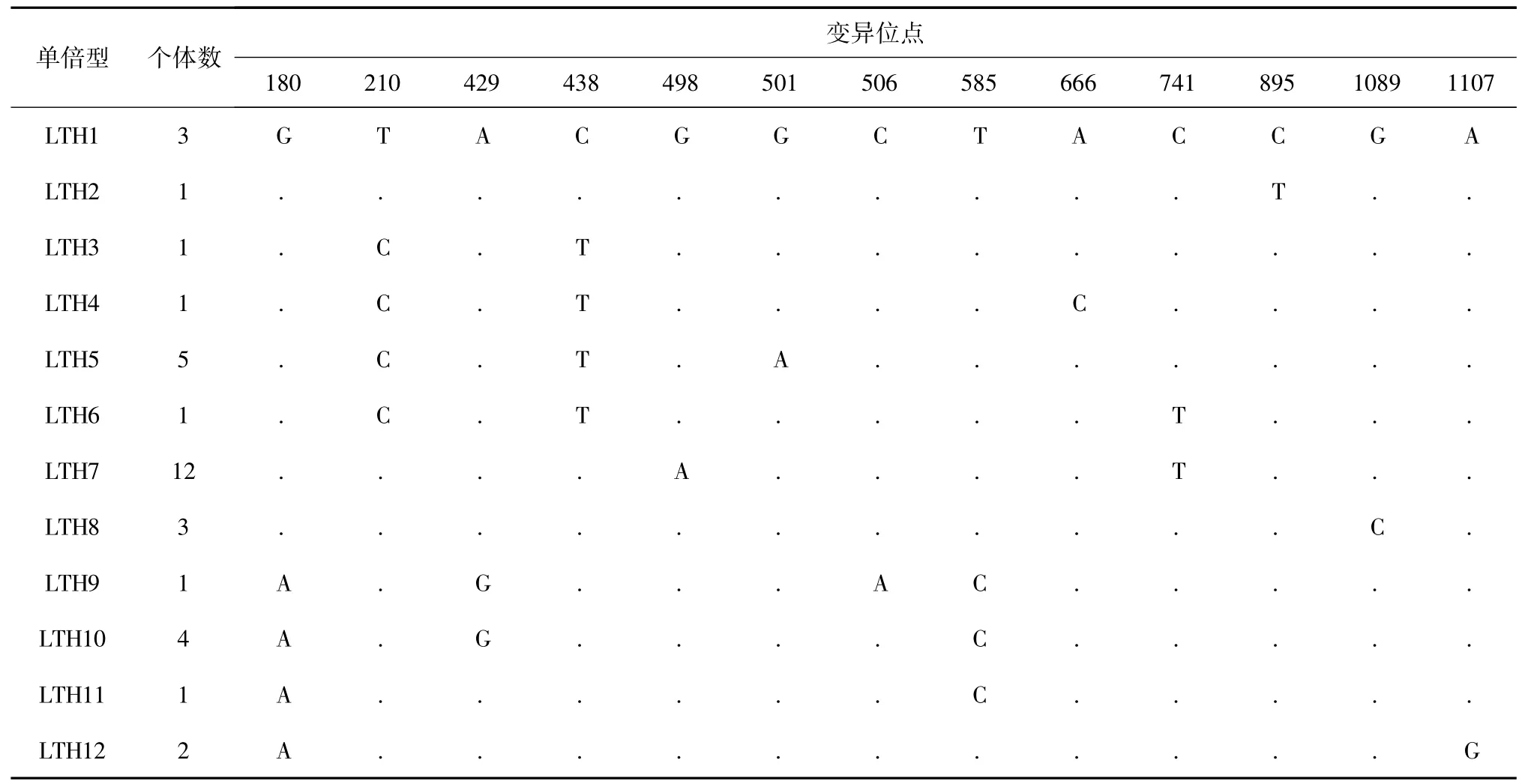
表1 太湖大银鱼mtDNA cyt b 基因单倍型多态性位点分布Table 1 Distribution of polymorphic sites in 12 haplotypes of Protosalanx chinensis with mtDNA cyt b in Lake Taihu
2.2 太湖大银鱼种群的遗传多样性
35 个大银鱼个体共定义12 个单倍型( LTH1 ~LTH12) ,其中单倍型LTH7 个体数最多,为12 个( 表1) 。大银鱼种群单倍型多样性指数和核苷酸多样 性 指 数 分 别 为0.850 ± 0.045 和0.002 96 ±0.000 17,平均核苷酸差异数为3.378,具有高单倍型多样性和低核苷酸多样性的特点( 表2) 。中性检验Tajima’s D 值为正值(0.224 52) ,且差异不显著( P >0.10) ,表明太湖大银鱼种群比较稳定,没有经历过种群扩张。

表2 太湖大银鱼种群的遗传多样性参数Table 2 Parameter of genetic diversity of P. chinensis population in Lake Taihu
2.3 cyt b 单倍型聚类分析
以太湖新银鱼为外群,采用临接法( NJ) 构建太湖大银鱼12 个单倍型的分子系统树( 图1) 。由图1 可以看出,12 个大银鱼cyt b 单倍型聚为一支,太湖新银鱼单独一支。单倍型间的遗传距离较小,最大值为0. 006,平均遗传距离为0. 003( 表3) ,表明单倍型之间没有出现遗传分化。
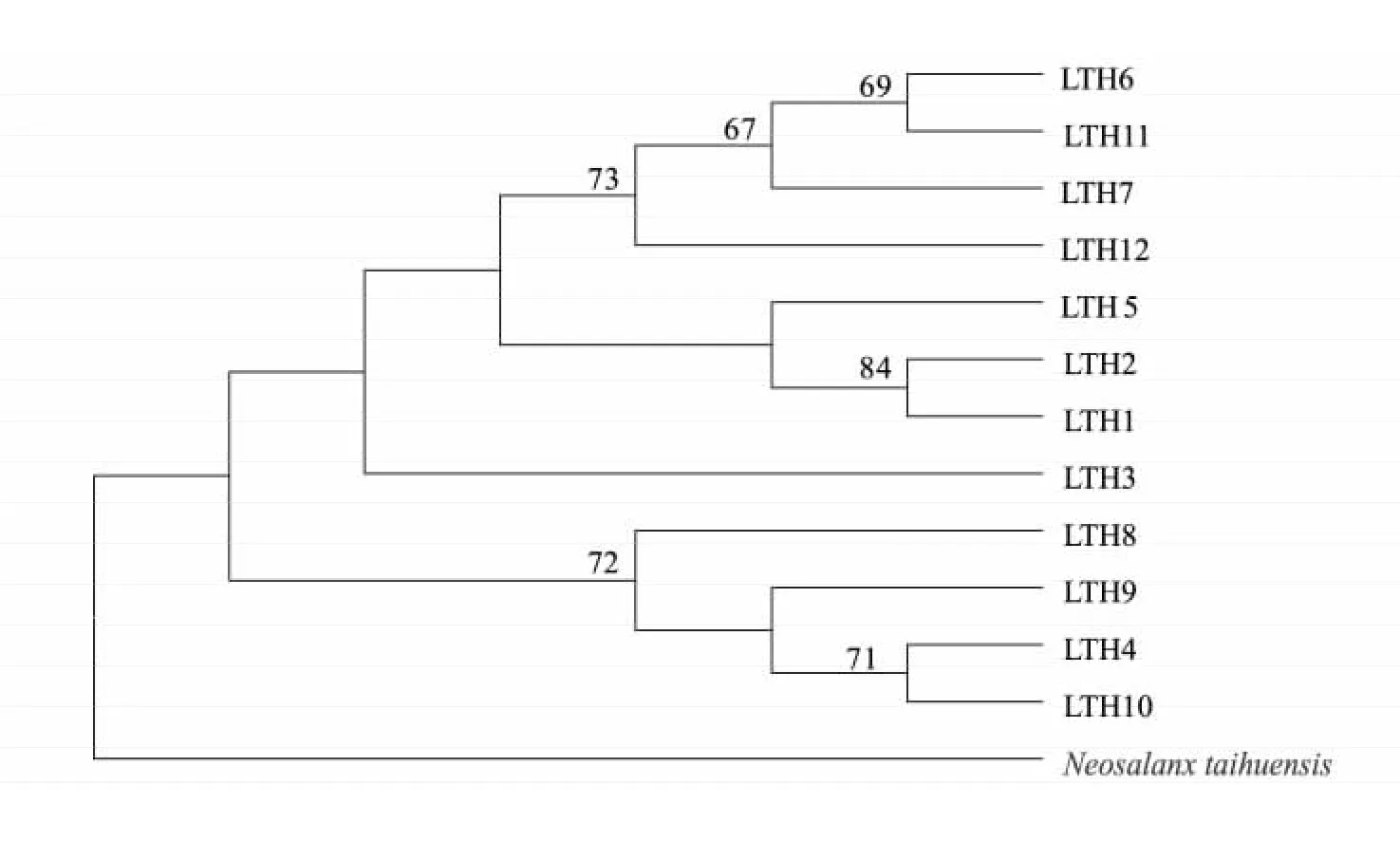
图1 大银鱼cyt b 单倍型的NJ 系统树Fig.1 The phylogenetic tree of mtDNA cyt b haplotypes of Protosalanx chinensis
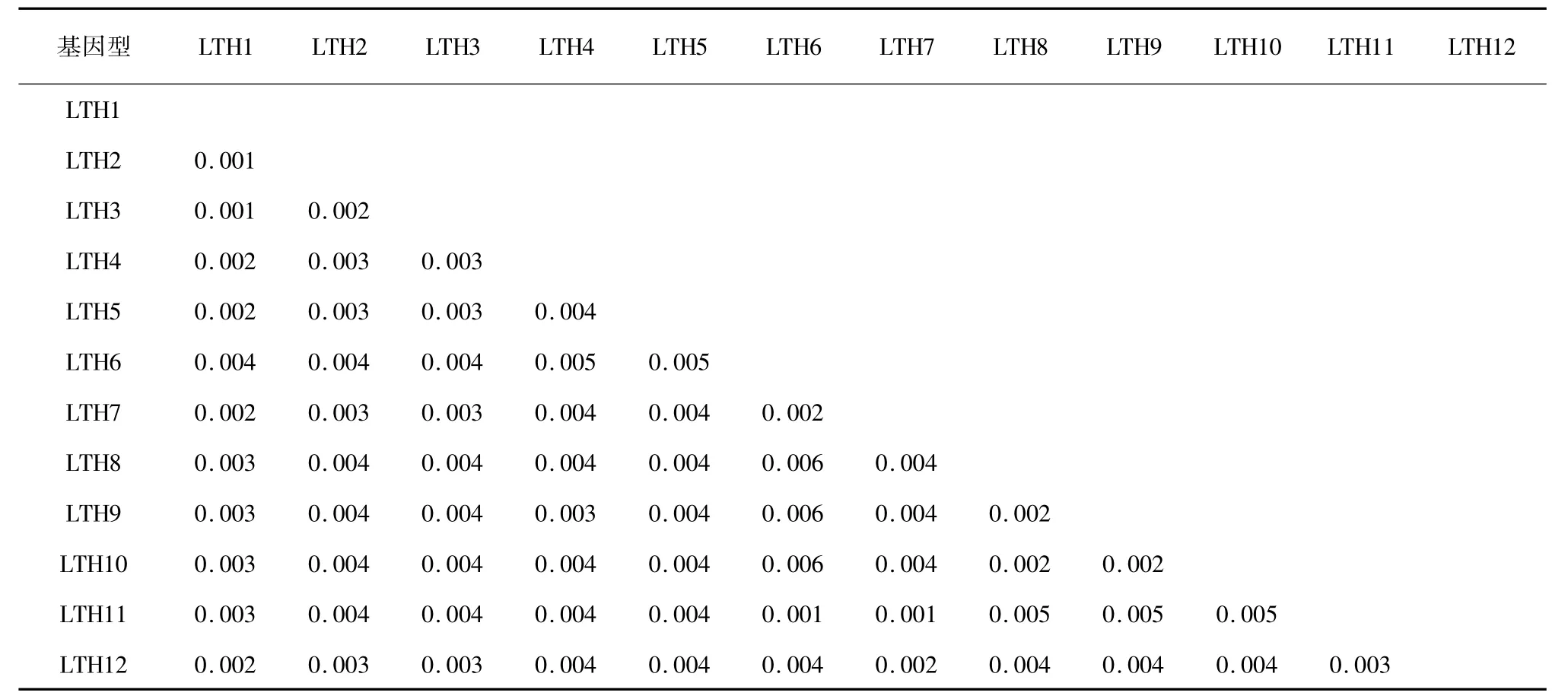
表3 太湖大银鱼cyt b 基因序列12 个单倍型遗传距离(Kimura-2-parameter 法)Table 3 Genetic distance between 12 haplotypes of P. chinensis with cyt b sequences (Kimura-2-parameter method)
3 讨论
线粒体DNA( mtDNA) 具有严格的母系遗传,进化速率快,几乎无重组等特点,被广泛用于鱼类系统发育和群体遗传研究,其中细胞色素b 基因( cyt b)为重要的蛋白质编码基因,其进化速率适中,能够有效反映亚种、种群、属等不同水平的遗传信息[19]。本研究获得了35 条太湖大银鱼cyt b 基因同源序列(1 141 bp) ,碱基G( 16.71%) 的含量最低,具有明显的反G 偏倚,显示出cyt b 基因的共同特征[20]。共检测到13 个变异位点,没有插入或丢失位点,其中11 个转换位点,2 个颠换位点,结果符合同种鱼类中转换在数量上远超过颠换的特征[21]。
遗传多样性是指生物种内和种间的遗传变异度,是生物进化与适应环境的基础[22]。单倍型多样性指数和核苷酸多样性指数是衡量一个物种或群体遗传多样性的2 个重要指标。本研究中,太湖大银鱼的单倍型多样性指数和核苷酸多样性指数分别为0.850 ±0.045 和0.002 96 ±0.000 17,呈现出高单倍型多样性和低核苷酸多样性的特征。有研究者通过对线粒体DNA 序列的遗传变异分析,将不同单倍型多样性和核苷酸多样性间的组合分成4 种类型:第1 种类型是较低的单倍型多样性( h <0.5) 与较低的核苷酸多样性( π <0.005) ; 第2 种类型是高单倍型多样性与低核苷酸多样性; 第3 种类型是低单倍型多样性与高核苷酸多样性; 第4 种类型是高单倍型多样性与高核苷酸多样性[23]。本研究中大银鱼种群的结果属于第2 种类型,该类型是由于经过瓶颈效应后伴随着迅速的种群增长与突变的积累造成,快速的种群增长有利于提高对新突变的保持力而导致核苷酸多样度降低。一方面由于过度捕捞、环境污染等因素,在上世纪80 年代太湖大银鱼种群数量急剧下降,遗传多样性降低,即受到遗传瓶颈效应的影响;另一方面,大银鱼生长快、繁殖周期短,能迅速扩大种群数量,有利于积累更多突变。因此太湖大银鱼种群遗传多样性具有较高的单倍性多样性和较低的核苷酸多样性特点。另外,通过比较本研究太湖大银鱼遗传多样性参数与文献报道[7,11,24]的研究结果,可以得出太湖大银鱼种群的遗传多样性最高。因此,保护太湖大银鱼种质资源对于保护中国银鱼种质资源的基因遗传多样性具有重要意义。
从单倍型间的遗传距离和NJ 系统树可以看出,太湖大银鱼单倍型间的遗传距离非常低,所有单倍型聚为一支,表明大银鱼种群内没有明显的遗传分化,这与夏德全等[14]对太湖大银鱼种群的遗传结构分析结果是一致的,太湖大银鱼种群内、种群间的遗传相似性指数及遗传距离都十分相近,这可能与历史上大银鱼可能受到较为严重的遗传瓶颈效应的影响有关。但需要注意的是,不同的cyt b 单倍型出现的频率有较大差异,单倍型LTH7 个体数有12 个,但6 个单倍型( LTH2、LTH3、LTH4、LTH6、LTH9 和LTH11) 仅有1 个个体出现,这一方面可能是大银鱼种群进化过程中自然选择的结果,也可能受到近些年来太湖较大规模大银鱼增殖放流所带来的选择效应的影响。假如一旦这些数量较少的单倍型失去,会降低大银鱼的遗传多样性。因此,在增值放流之前,有必要对增殖放流群体与野生群体进行遗传多样性和种群结构进行对比研究,从而避免增殖放流可能带来的不利影响。
物种的遗传多样性高低与其适应能力、生存能力和进化潜力密切相关。丰富的遗传多样性意味着较高的适应生存潜力,蕴藏着较大的进化潜能、丰富的育种和遗传改良潜力。物种遗传变异的减少可能导致严重的后果,如成活率、生长与繁殖效率变低,降低种群个体对环境变化的适应能力。本研究结果表明目前太湖大银鱼有较高的单倍型多样性,但核苷酸多样性较低。同时大银鱼的种群波动剧烈,对栖息水环境质量要求很高。因此,为保护和合理利用太湖大银鱼资源,我们建议加大太湖环境保护力度,改善水环境质量、建立大银鱼种质资源保护区,保护区内禁止一切人类活动、控制银鱼捕捞强度和缩短捕捞时间等措施,以实现太湖大银鱼渔业的可持续发展。
[1] 张 洁. 银鱼科鱼类及其物种多样性保护[J]. 生物学通报,2008,43(6) :4-6.
[2] 王忠锁,傅萃长,雷光春. 中国银鱼的多样性及其保护对策[J]. 生物多样性,2002,10(4) :416-424.
[3] AVISE J C. A role for molecular genetics in the recognition and conservation of endangered species[J]. Trends in Ecology and Evolution,1989,4: 279-281.
[4] WAITS L. Mitochondrial DNA phylogeography of the North American brown bear and implications for conservation[J]. Conservation Biology,1989,13: 408-417.
[5] 罗宏伟,段辛斌,王 珂,等. 三峡库区3 种银鱼线粒体DNA细胞色素b 基因序列多态性分析[J]. 淡水渔业,2009,39(6) : 16-21.
[6] 郭 立,李 隽,王忠锁,等. 基于四个线粒体基因片段的银鱼科鱼类系统发育[J]. 水生生物学报,2011,35(3) : 449-459.
[7] ZHANG J,LI M,XU M Q,et al. Molecular phylogeny of icefish Salangidae based on complete mtDNA cytochrome b sequences,with comments on estuarine fish evolution[J]. Biological Journal of the Linnean Society,2007,91(2) : 325-340.
[8] ZHAO L,ZHANG J,LIU Z J,et al. Complex population genetic and demographic history of the Salangid,Neosalanx taihuensis,based on cytochrome b sequences[J]. BMC Evolution Biology,2008,8: 201-219.
[9] 谷孝鸿,白秀玲,江南,等. 太湖渔业发展及趋于设置与功能定位[J]. 生态学报,2006,26 (7) : 2247-2254.
[10] 周 毅,石建华,钱 伟,等. 太湖藻类分布及其对鱼类的毒性试验[J]. 江苏农业科学,2013,41(4) :311-313.
[11] 张开翔. 大银鱼胚胎发育的观察[J]. 湖泊科学,1992,4(2) :25-37.
[12] 王玉芬,蒋全文. 太湖大银鱼生长特性的研究[J]. 湖泊科学,1992,4(1) : 56-62.
[13] 朱成德. 太湖大银鱼生长与食性的初步研究[J]. 水产学报,1985,9(3) : 275-287.
[14] 夏德全,曹 萤,吴婷婷,等. 太湖中大银鱼、太湖新银鱼和寡齿新银鱼群体的遗传结构[J]. 水产学报,1999,23(3) : 254-260.
[15] SAMBROOK J,RUSSELL D W. Molecular cloning: A laboratory manual[M]. 3 rd ed. New York: Cold Spring Harbor Laboratory Press,2002: 463-469.
[16] BURLAND T G. DNASTAR's Laser gene sequence analysis software[J]. Methods in Molecular biology,2000,132: 71-91.
[17] ROZAS J,SACHEZ-DELBARRIO J C,Messeguer X,et al.DnaSP,DNA polymorphism analyses by the coalescent and other m ethods [J]. Bioinformatics,2003,19 ( 18) : 2496-2497.
[18] TAMURA K,DUDLEY J,Nei M,et al. MEGA 4: molecular evolutionary genetics analys is ( MEGA ) softw are version 4.0[J].Molecular Biology and Evolution,2007,10: 1092-1093.
[19] GRAY M W,BURGER G,LANG B F. Mitochondrial evolution[J]. Science,1999,283 (5407) : 1476-1481.
[20] ROGERS A R,HARPENDING H. Population growth makes waves in the distribution of pairwise genetic differences[J]. Molecular Biology and Evolution,1992,9(3) :552-569.
[21] KOHER T D,THOMAS W K,MEYER A,et al. Dynamics of mitochondrial DNA evolution in an imals: Amplification and sequencing with conserved primers[J]. Proceedings of the National Academy of Sciences,1989,86 (16) : 6196-6200.
[22] 施立明. 遗传多样性及其保存[J]. 生物科学信息,1990,2(1) : 158-164.
[23] GRANT W S,BOWEN B W. Shallow population histories in deep evolutionary lineages of marine fishes: insights from sardines and anchovies and lessons for conservation[J]. Journal of Heredity,1998,89: 415-426.
[24] 赵 亮,张 洁,刘志谨,等. 乔氏新银鱼基于细胞色素b 序列的种群遗传结构和种群历史[J]. 生物多样性,2010,18( 3) :251-261.
