CT引导下射频消融治疗33例肺癌的回顾性分析
2015-03-31邵国良郑家平陈玉堂郝伟远
罗 君, 邵国良, 郑家平, 陈玉堂, 姚 征, 曾 晖, 郝伟远
肺癌是我国人群常见的恶性肿瘤,是恶性肿瘤的第1位死因。其发病率呈逐年上升趋势,严重危害人民身体健康。大部分患者诊断时已是中晚期,丧失了手术切除的机会。射频消融术(RFA)作为一种微创治疗手段,其有效性、易操作性及安全性已得到证实。目前已被广泛用于实体肿瘤的治疗。随着RFA在肺癌中实践经验的加深,该技术正迅速成为治疗肺癌的又一种可靠手段。本文就我院采用RFA治疗肺癌的经验作一总结,以期为临床工作提供参考。
1 材料与方法
1.1 临床资料
收集我院2007年5月—2013年8月行RFA治疗的肺癌患者。入选标准为:①早期(Ⅰ期或Ⅱa期)原发性肺癌不宜手术或拒绝手术者;②Ⅲ、Ⅳ期原发性肺癌标准治疗后残余的孤立性结节行补救治疗者;③原发灶已控的转移性肺癌,未发现肺外转移灶,且同侧肺病灶数量≤2个;④病灶最大直径≤5 cm,距离大血管或较大支气管≥1.0 cm;⑤术前检查血小板计数≥100×109/L,凝血酶原时间国际正常化比值(INR)≤1.5,心肺功能符合静脉麻醉要求。禁忌证为:①肺部弥漫性转移或全身转移者;②肿瘤紧靠肺门或大血管,距离<1.0 cm;③同侧肺中病灶数目>3个,或病灶最大直径>5 cm;④严重阻塞性肺炎、肺动脉高压、肺不张或大量恶性胸水;⑤其他重要脏器功能衰竭者。患者在接受肺RFA治疗的同时仍可接受放、化疗或其他标准治疗。共收集患者33例,其中男26例,女7例;年龄37~76岁,中位年龄57岁;共消融治疗35个病灶,其中原发性肺癌病灶18个,转移性肺癌病灶17个;病理类型为鳞癌11处,腺癌20处,肝细胞癌4处;病变位于左肺15例,右肺20例;临床分期为Ⅰ期患者6例,Ⅲ期3例,Ⅳ期 24例;病灶大小 9~42 mm,中位18 mm。所有患者及其家属均签署了知情同意书。
1.2 方法
1.2.1 操作流程 射频治疗仪为泰科(CTRF-220)或RITA射频消融系统,工作频率为480 KZ,输出能量为0~200 W。电极针为泰科(ACT-1530或ACT-1520)或RITA(star Burst xli)。影像引导采用16排螺旋CT(西门子,SOMATOM Sensation 16),扫描层厚为5mm。操作时先行CT平扫,根据病灶部位决定患者扫描体位(原则上采用仰卧位,方便配合麻醉)。在心电监护和全麻下,调试好冷循环射频仪并连接相关电极,先做CT扫描定位,皮肤表面做好标记。常规消毒铺巾,用1%利多卡因5ml作穿刺点局麻,在CT引导下将射频针插入病灶部位,观察并调整针尖位置到最佳,后连通射频电极,时间持续12 min,消融时从电极针注水孔间隙注入生理盐水以防组织炭化。保证消融灶边缘超过肿瘤边缘0.5~1 cm。结束后CT扫描显示病灶区为大片磨玻璃密度影,完成肿瘤消融。再对穿刺针道进行消融以防止针道种植。拔出射频针,结束手术。术后心电监护24 h,给予止血等对症处理。
1.2.2 术后随访与评价 采用16排螺旋CT于术后1、3个月及以后每隔3个月对肺部病灶进行增强CT检查,观察消融病灶的大小变化及局部血供情况。CT图像层厚均为5 mm,病灶大小在肺窗进行测量,消融灶血供情况在纵隔窗动脉增强期进行观察。1年后患者在当地医院复查,采用定期电话随访。电话随访截止2013年12月15日,其中失访1例(2.9%),失访者在生存分析中以最后有效随访日期作为截尾值处理。
1.2.3 统计学处理 应用SPSS 17.0统计学软件,生存分析采用乘积极限法(Kaplan-Meier)。P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
本研究对33例患者35个病灶进行了RFA,均顺利完成。术后CT随访时间为2~31个月。随访3个月以上共32例患者34个病灶,其中2个病灶分别于术后3、6个月发现局部复发。术后1年的随访数据显示,共5个病灶出现局部复发,1年局部控制率为85.3%(见表1)。随访资料齐全的32例患者中,无进展生存期(PFS)为3~31个月,中位PFS(mPFS)(18.0±1.3)个月。其中15例原发性肺癌的1年生存率为12/15,17例转移性肺癌为12/17,平均1年生存率24/32(见表2)。肿瘤长径<3 cm者的预期PFS为(18.4±2.1)个月,3~5 cm者的预期PFS为(15.1±1.7)个月,两组间的PFS差异无统计学意义(P>0.05)。另外,不同的年龄、性别、病理类型、临床分期等均与患者预期PFS无显著相关(P>0.05)。
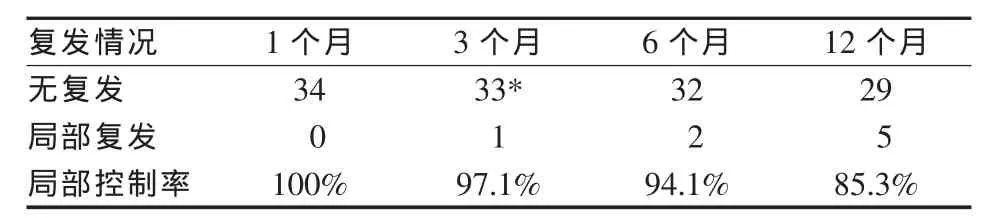
表1 消融病灶局部控制率病灶的局部控制率

表2 1年生存率
2.2 CT表现
RFA中实时CT平扫监测,发现所有病灶体积均不同程度增大,密度较术前降低10~30 Hu,部分病灶消融区可见空泡状改变。术后1个月CT表现:32个病灶(32/34,94.1%)体积较术前增大超过20%,病灶周围渗出性改变。术后3个月的CT表现为31个病灶(31/34,91.2%)周围渗出性改变较前明显缩小,消融区无明显强化。术后1年的CT表现为无复发的病灶消融区体积均较前进一步缩小,且无明显强化,提示肿瘤坏死吸收。见图1。
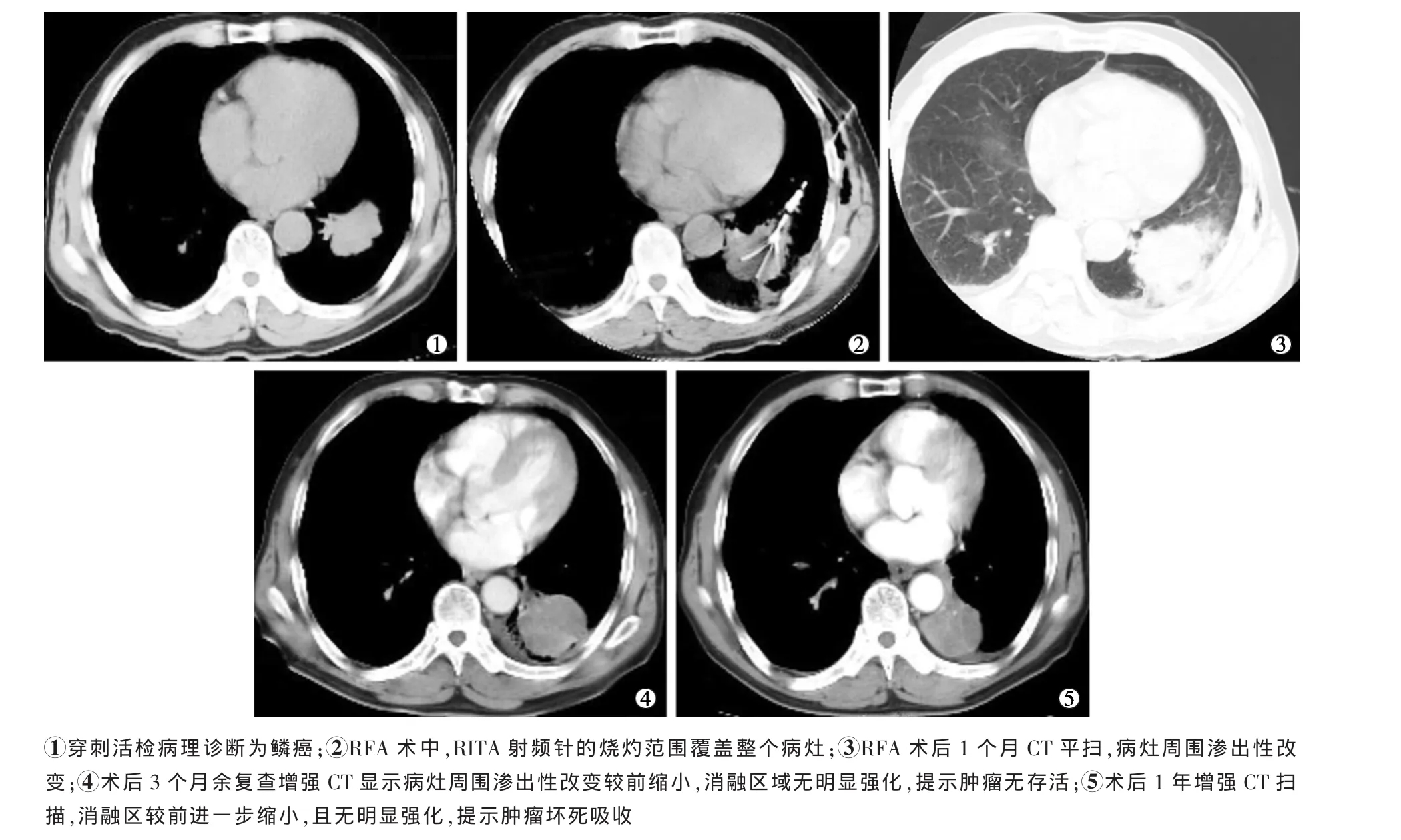
图1 肺鳞癌RFA治疗前后图像
2.3 不良反应
肺部RFA的手术时间为45~100min,中位时间60min。穿刺过程中部分患者感胸痛不适,但程度多不剧烈。RFA过程中多数患者无明显胸部疼痛,1例术后胸痛明显。术中出现少量咯血3例(3/33,9.1%);气胸2例(2/33,6.1%),其中1例肺压缩超过20%,现场胸腔穿刺排气后好转;4例(4/33,12.1%)术后出现胸腔积液,其中1例为中等量积液;1例(1/33,3.0%)出现两肺感染;有1例(1/33,3.0%)术后出现支气管胸膜瘘。全部35例次手术中未出现大出血、张力性气胸、感染性休克等严重并发症。
3 讨论
对于不能手术切除的肺癌,尤其是5 cm以下的病灶,RFA可达到类似根治的效果[1]。近年来,RFA技术和设备的进步,使得中晚期肺癌亦能在RFA中获益。蒲德利等[2]在中晚期非小细胞肺癌(NSCLC)患者中采用RFA联合吉西他滨、顺铂(GP)方案化疗,其有效率可达81.3%,而单纯化疗组的治疗有效率仅为43.8%,两者间差异有统计学意义(P<0.01)。而不良反应发生率和程度差异无统计学意义(P>0.05)。
肺组织电流阻抗高,含气结构热传导不佳,使局部热量不易散发而积聚在消融区边缘,导致能量充分集中在病变部位,促其发生凝固性坏死[3]。而肺血管中的血液具有散热及降温效应,使治疗过程中不易损伤血管,RFA可能只适合结构致密的肿瘤,操作时的难度在于如何控制消融的范围[4]。
本研究共观察了33例肺癌患者的35处RFA治疗。通过实时CT扫描可以观察到消融区的病灶在术中即发生密度降低的改变,术后短期内大部分病灶的体积较前有所增大,但Hu值较术前降低,且增强CT提示无明显强化。这一改变可能是RFA热损伤后肺组织炎性充血水肿、肉芽组织增生所致。一般持续到术后3个月左右,坏死的肿瘤细胞被吸收或机化,该区域才出现缩小改变。当然,如果消融区域持续增大,且CT增强下出现强化改变,则往往提示肿瘤复发。
对于RFA后疗效的评价,由于坏死的病灶往往长期存在,而不伴有体积明显缩小,即使有病灶存活,其形态亦不规则,无法利用影像学工具进行测量。因此,本研究并未采用WHO或RECIST实体肿瘤疗效评价标准,而是根据CT增强扫描显示消融区内是否出现强化病灶来判断是否局部复发。结果仅有1例患者的病灶在RFA术后3个月内出现局部复发,2例在术后6个月内复发,5例在术后1年内复发,1年局部控制率达85.3%(29/34)。有研究发现,对于3 cm以上的病灶,射频后PFS较短[5],本研究亦观察到这一现象[(18.4±2.1)个月对(15.1±1.7个月)],但两组患者的PFS无统计学差异。
肺癌RFA治疗的常见并发症包括气胸、胸腔积液、发热、咳嗽、咯血等,反应大多较轻,仅个别需要临床干预。有报道RFA中最常见的并发症是气胸,其发生率为28.4%,大部分可以自愈,而9.8%患者需要行胸腔闭式引流[6]。本研究观察到的不良反应中最常见的是胸腔积液(11.4%),其次为咯血(8.6%),气胸(5.1%),肺部感染(2.9%)及支气管胸膜瘘(2.9%)。多数情况下只要及时行对症处理,上述并发症均可痊愈,总体而言,肺癌RFA是一项较为安全的介入操作。当然,治疗过程中也应注意防止大出血、张力性气胸、支气管胸膜瘘等严重并发症。回顾上述患者的治疗过程发现,减少RFA相关并发症的关键在于穿刺路径的合理选择、以及穿刺准确度的把握,避免重复穿刺。
综上所述,无论是肺部原发灶还是转移灶,RFA均能有效控制肿瘤进展,与手术相比,其优势包括精确控制,完全毁损,反复使用,并且安全简便、疗效确切,因此其具有重要的临床应用价值。
[1] Ettinger DS,Akerley W,Borghaei H,et al.Non-small cell lung cancer[J].JNatl Compr Canc Netw,2012,10:1236-1271.
[2] 蒲德利,廖江荣.射频消融联合化疗治疗周围型中晚期非小细胞肺癌疗效观察[J].介入放射学杂志,2013,22:129-132.
[3] 刘宝东,支修益,刘 磊,等.CT引导下射频消融治疗中晚期非小细胞肺癌的近期疗效观察[J].中国肺癌杂志,2009,12: 775-779.
[4] Yamazaki N,Watanabe H,Lu X,et al.Development of a temperature distribution simulator for lung RFA based on air dependence of thermal and electrical properties[J].Conf Proc IEEE Eng Med Biol Soc,2012:5699-5702.
[5] Schoellnast H,Deodhar A,Hsu M,et al.Recurrent non-small cell lung cancer:evaluation of CT-guided radiofrequency ablation as salvage therapy[J].Acta radiol,2012,53:893-899.
[6] Simon CJ,Dupuy DE,Dipetrillo TA,et al.Pulmonary radiofrequency ablation:long-term safety and efficacy in 153 patients[J].Radiology,2007,243:268-275.
