电针对阿尔茨海默病大鼠认知功能及海马Nogo-A、NgR表达的影响*
2015-03-22西安交通大学第二附属医院老年神经科西安710004
西安交通大学第二附属医院老年神经科(西安710004)
王 辉 何 娅▲ 陈松盛 马巧亚 王锐利
电针对阿尔茨海默病大鼠认知功能及海马Nogo-A、NgR表达的影响*
西安交通大学第二附属医院老年神经科(西安710004)
王 辉 何 娅▲陈松盛 马巧亚 王锐利
目的:了解电针对阿尔茨海默病(AD)大鼠认知功能及海马区Nogo-A、NgR表达的影响。方法:双侧海马注射Aβ1-40制备大鼠AD模型,1周后加电针治疗,第5周行水迷宫实验评价大鼠认知功能,并用Western Blot方法检测海马区Nogo-A、NgR表达的变化。结果:水迷宫实验中逃避潜伏期在AD组大鼠较假手术组显著延长(P<0.05),而AD+电针组较AD组显著缩短(P<0.05)。原平台所在象限的游泳时间占总时间的比值AD组大鼠显著低于假手术组(P<0.05),而AD+电针组则显著高于AD组(P<0.05)。Western Blot实验显示:AD组大鼠较假手术组Nogo-A表达增高,NgR表达降低,AD+电针组大鼠较AD组Nogo-A表达则相对下调,NgR表达相对上调。结论:AD大鼠海马区Nogo-A表达增高,NgR表达降低,可能与AD的病理改变有一定联系。电针治疗能明显改善AD大鼠的认知功能,上调NgR表达可能是其机制之一。
阿尔茨海默病(Alzheimer disease,AD)是一种常见的中枢神经系统退行性疾病,主要表现为进行性的记忆力减退、日常生活能力下降和精神行为异常等,它严重影响患者的生存质量,也给社会和家庭带来了沉重的负担。细胞外β淀粉样蛋白(Amyloid protein β,Aβ)沉积形成的老年斑和tau蛋白异常聚集导致的神经纤维原缠结是AD两个特征性的病理变化。研究认为[1-4],AD患者脑内海马区出现神经轴突生长抑制因子Nogo-A及其受体NgR的异常表达,且这些蛋白异常表达与AD的病理改变有一定的联系。电针在临床上常用于中枢神经系统疾病的治疗,疗效肯定,但其作用机制不详[5-6]。本实验用Aβ1-40双侧海马区注射制备大鼠AD模型,加用电针治疗,采用水迷宫实验评价大鼠认知功能,并用Western Blot方法检测大鼠海马区Nogo-A、NgR蛋白表达的变化,了解电针对阿尔茨海默病大鼠认知功能的影响及其可能的机制。
材料与方法
1 材 料 成年健康清洁级雄性SD大鼠36只(220~250g),由西安交通大学医学院实验动物中心提供。自由饲养1周,行水迷宫实验排除训练异常的大鼠。动物随机分为3组:假手术组12只、AD模型组12只、AD模型+电针治疗组12只,术前12h禁食,自由饮水。Aβ1-40、NgR抗体为海南医学院马琳教授惠赠,Aβ1-40使用前溶于灭菌的双蒸水配成浓度5g/L的溶液,37℃孵育7d。Nogo-A抗体购自Santa Cruz公司。
2 方 法 ①大鼠AD模型的制备:按照2%异戊巴比妥50mg/kg体重腹腔注射麻醉大鼠,麻醉后的大鼠俯卧于大鼠立体定向仪上,门齿钩、耳棒固定头部,使前后囟在同一平面上,剪去头顶部毛发,正中切口,分离暴露前囟。参照大鼠脑立体定向图谱,按照海马CA1坐标确定进针点位于前囟后3mm,向左右各旁开2.2mm,做好标记,颅钻钻一小孔,深度以钻透颅骨不伤及硬脑膜为宜,使用立体定向仪配套的夹持器将微量注射器从定位处缓慢穿入,深度为2.8mm,缓慢注入Aβ1-40 1μl,注射时间为5min,留针5min,缓慢退出微量注射器。双侧均注射结束后用牙科水泥封固颅骨孔,缝合切口,局部消毒,术后每只大鼠腹腔注射青霉素8万U。术后将大鼠保持侧卧位,60W白炙灯照射使肛温保持在 37℃左右,注意吸痰保持呼吸道通畅,待大鼠清醒后放回笼内。假手术组除双侧注入生理盐水外,其余操作同手术组。②电针治疗:AD+电针组大鼠于AD模型制备后1周行电针治疗。参考《中国兽医针灸学》定位[7],于大鼠头部正中两耳间取“百会”,前肢内侧,距腕关节约3mm的尺桡骨间取“内关”,第2腰椎棘突下旁开1寸取“肾俞”,大鼠后肢膝部外侧前下方取“足三里”。采用28号0.5寸不锈钢毫针,“百会”平刺1~2mm,“肾俞”稍向内斜刺5mm,“内关”直刺1mm,行提插捻转平补平泻法,“足三里”直刺5mm,加用“三元牌”电针仪(型号G6805-Ⅲ),采用疏密波刺激以上穴位,频率2Hz,电压为2V,每次20min,连续治疗20d。③水迷宫实验:所有大鼠进入实验前及AD模型制备后第5周分别行Morris水迷宫实验。Morris水迷宫为直径1.2m的圆形水池,水深约30cm,水温23~25℃左右,迷宫上方装有摄像头并与计算机相连,应用水迷宫分析软件可记录大鼠的游泳轨迹等数据。迷宫池壁内侧标明4个入水点,将水池随意分为Ⅰ、Ⅱ、Ⅲ、Ⅳ象限,在象限Ⅱ中央设置一个平台,平台距水面约2cm。获得性训练:每天4次,将大鼠分别从4个象限头朝池壁投入水池,记录其寻找到平台的时间为逃避潜伏期,最长限制时间为120s,若120s内未找到平台,则逃避潜伏期记为120s,并由实验人员引导其游到平台,让其在平台休息30s后擦干身体放入笼中休息,再投入其它大鼠。所有大鼠进入实验前进行1天的获得性训练,每只大鼠4次,若其中有2次不能在120s内找到隐藏的平台,则被视为训练异常,不纳入实验。AD模型制备后第5周进行的水迷宫实验共有两项内容,其中获得性训练共进行5d(分别记为D1~D5),每天4次,取4次的均值记为当天的逃避潜伏期数据。第二项内容是探查训练:完成获得性训练的第二天撤去平台,记录其在一定时间内的游泳轨迹,计算大鼠在象限Ⅱ(原平台所在象限)游泳的时间与总时间的比值,考察大鼠对原平台的记忆。④Nogo-A、NgR蛋白检测:采用Western blot方法进行。水迷宫实验结束后大鼠于10%水合氯醛3.5ml/kg体重腹腔注射麻醉,断头取脑,迅速分离海马组织,液氮速冻,后置于-80℃冰箱保存。检测时取大鼠海马组织匀浆后提取总蛋白,用蛋白试剂盒定量,将3组大鼠海马的蛋白样品上样,经SDS-聚丙烯酰胺凝胶电泳,再将电泳凝胶上的蛋白质条带转移至PVDF膜上,封闭后分别加入抗Nogo-A、NgR抗体,后加入酶标二抗依次反应,ECL显色。结果用光密度扫描计算机进行图像分析,以背景光密度值进行标准校正,计算Nogo-A、NgR蛋白表达的相对量。
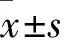
结 果
1 水迷宫实验 在获得性训练中,每组大鼠的逃避潜伏期均随着训练天数的增多而逐渐缩短。与假手术组相比,AD模型组大鼠逃避潜伏期明显延长,差异有统计学意义(P<0.05)。从第2天开始,与AD组相比,AD+电针治疗组逃避潜伏期明显缩短,差异有统计学意义(P<0.05)。(见表1)。在探查训练中,AD组大鼠在象限Ⅱ的游泳时间占总时间的比值明显低于假手术组大鼠,差异有统计学差异(P<0.05)。AD+电针组大鼠在象限Ⅱ的游泳时间占总时间的比值明显高于AD组大鼠,差异有统计性意义(P<0.05)。(见表2)。

表1 获得性训练中大鼠的逃避潜伏期
注:与假手术组比较*P<0.05;与AD组比较**P<0.05

表2 探查训练中大鼠在水池各象限游泳的时间与总时间的比值
注:与假手术组比较*P<0.05;与AD组比较**P<0.05
2 Nogo-A、NgR蛋白检测 Western Blot实验显示:相对于假手术组,AD组大鼠Nogo-A表达明显增高,NgR表达明显降低,差异均有统计学意义(P<0.05)(见图1);而相对于AD组,AD+电针组大鼠Nogo-A表达下调,NgR表达上调, 差异均有统计学意义(P<0.05)(见图2)。

图1 三组大鼠Nogo-A蛋白Western Blot结果(*P<0.05)

图2 三组大鼠NgR蛋白Western Blot结果(*P<0.05)
讨 论
海马是参与学习记忆的重要器官,AD的病理改变首先出现在海马-内嗅皮层,影像学的研究也发现AD患者双侧海马体积明显缩小。在本实验中,大鼠双侧海马注射Aβ1-40后表现出明显的认知功能下降症状,提示AD模型构建成功。本实验中AD+电针治疗组大鼠学习记忆能力虽明显低于假手术组,但仍显著高于AD组,提示电针治疗能明显改善阿尔茨海默病大鼠的认知功能。
Nogo-A是一种抑制神经轴突生长的髓鞘相关蛋白,属于内质网膜蛋白RTN家族成员,被认为是阻碍中枢神经系统受损神经轴突再生修复的重要因素。NgR是位于细胞膜表面能够与Nogo-A的Nogo-66区域特异结合的蛋白。研究发现[3]NgR与P75或TAJ/TROY、Lingo-1组成受体复合物,Nogo-A与其结合后,激活下游的RhoA激酶,使无活性的Rho-GDP转变成有活性的Rho-GTP,后者进而激活ROCK,通过影响肌动-肌球蛋白系统导致轴突生长锥的塌陷,发挥其神经生长抑制作用。Nogo-A、NgR在动物的中枢神经系统广泛表达。随着研究的深入,人们逐渐发现Nogo-A、NgR与阿尔茨海默病的发生发展有一定的联系。
He等[8]研究发现RTN家族成员可与β淀粉样前体蛋白APP的转换酶BACE1结合,减少对APP的酶切,抑制Aβ产生。Park等[9]研究发现NgR与APP可相互作用减少Aβ分泌,敲除NgR基因的AD小鼠Aβ水平升高,老年斑形成增加。同年他们还报道[10],在敲除NgR基因的AD小鼠,皮下给予可溶性的Nogo受体片段NgR-Fc能够减少脑内Aβ产生,提高动物的认知能力。对于NgR在海马区的表达有研究得出了不同的结论,唐寒芬等[11]研究发现在阿尔茨海默病大鼠海马区NgR表达下降。虽然NgR作为阿尔茨海默病一个可能的治疗方向引起了研究者的广泛关注,但对于Nogo-A及NgR在AD发生发展中的作用尚需进一步的研究。
传统医学电针刺激相应穴位能够对多种中枢神经系统疾病产生明显的神经保护作用,已有很多研究[12]证实电针对阿尔茨海默病疗效肯定,但机制尚不明确。目前有很多相关的学说,如:调节神经递质的释放、抗氧化应激、改善神经元突触的可塑性、提高神经营养因子的含量、抑制tau蛋白的表达、降低Aβ的水平、上调自噬活性等。
本实验采用Western Blot检测大鼠海马区Nogo-A、NgR蛋白的表达,发现在AD组大鼠Nogo-A表达较假手术组明显增高,NgR表达则明显降低。与唐寒芬等的研究结果一致,而与Zhu等人的研究结果似乎矛盾。考虑可能的原因:Zhu等的研究曾提示,在阿尔茨海默病患者海马的CA1、CA2区NgR表达阳性的细胞占整个锥体层细胞的百分比明显高于对照组患者,而在CA3、CA4区域未观察到这种差别。本实验中未对海马组织的亚结构进一步详细区分,且动物样本量不够大,可能造成实验结果的不一致。另外,Zhu等的研究对象是AD患者,与大鼠的表达是否一致尚需进一步研究。加之研究方法以及AD病程等方面的不一致也是可能的原因。由于Nogo-A与BACE1以及NgR与APP有相互作用位点,因此Nogo-A与NgR的异常表达可能与AD的病理改变有一定的联系。
实验中观察到,相对于AD组,AD+电针治疗组大鼠海马区Nogo-A表达下调,差异有统计学意义。参考He等的研究,Nogo-A作为Aβ沉积的负性调控因子,表达下调有利于Aβ沉积,不利于大鼠认知功能的改善,因此我们推断Nogo-A表达下调可能与神经再生方面的调控有关。同时我们还观察到,AD+电针治疗组大鼠海马区NgR表达上调。参考Park等人的研究,NgR能够减少Aβ的产生,从而有利于认知功能的改善,这可能是电针治疗改善AD大鼠认知功能的机制之一。
[1] Gil V, Nicolas O, Mingorance A,etal. Nogo-A expression in the human hippocampus in normal aging and in Alzheimer disease[J]. J Neuropathol Exp Neurol, 2006, 65(5):433-444.
[2] 刘 涛.阿尔茨海默病信号转导机制的研究进展[J].陕西医学杂志,2012,41(6):742-743,759.
[3] 刘 涛,张荣超,黄 悦.跑台运动对D-半乳糖致阿尔茨海默病模型大鼠干预的实验研究[J].陕西医学杂志,2014,43(2):149-151,157.
[4] Schmandke A,Schmandke A,Schwab ME.Nogo-A:Multiple Roles in CNS Development, Maintenance, and Disease[J].Neuroscientist,2014,20(4):372-386.
[5] 唐纯志,赖新生,杨君军,等.电针对老年性痴呆大鼠脑内SOD、MDA、GSH-Px影响的实验研究[J].陕西中医,2005 26(2):180-181.
[6] 汪 艳,张兆蓬,王学员.电针配合重复经颅磁刺激治疗血管性痴呆49例[J].陕西中医,2012,33(1):82-84.
[7] 于 船.中国兽医针灸学[M].北京:农业出版社,1984:212.
[8] He W,Lu Y, Qahwash I,etal.Reticulon family members modulate BACE1 activity and amyloid-beta peptide generation[J].Nat Med,2004,10(9):959-965.
[9] Park JH,Gimbel DA,GrandPre T,etal.Alzheimer precursor protein interaction with the Nogo-66 receptor reduces amyloid-beta plaque deposition[J].J Neurosci,2006,26(5):1386-1395.
[10] Park JH,Widi GA,Gimbel DA,etal.Subcutaneous Nogo receptor removes brain amyloid-beta and improves spatial memory in Alzheimer's transgenic mice[J].J Neurosci,2006,26(51):13279-13286.
[11] 唐寒芬.脑灵汤对阿尔茨海默病模型大鼠海马CA3区域Nogo-A和NgR表达变化的影响[D].中南大学,2011.
[12] 朱 晶,国海东,邵水金.针灸治疗阿尔茨海默病机制的研究进展[J].针刺研究,2012,37(5):422-425.
(收稿:2014-09-22)
Effects of electro-acupuncture on cognitive functions and expression of Nogo-A and NgR in hippocampus of Alzheimer’s disease rats
Department of Elderly Neurology, The Second Affiliated Hospital of Xi’an Jiaotong University(Xi’an 710004)
Wang Hui He Ya Chen Songsheng et al
Objective:To observe the effects of electro-acupuncture on cognitive functions and expression of Nogo-A and NgR in hippocampus of Alzheimer’s disease rats.Methods:The rats of Alzheimer’s disease were established by injection β amyloid 1-40 into bilateral hippocampus and were treated with electro-acupuncture for twenty days after one week. The cognitive functions were evaluated by Morris water maze testing in fifth week and the expression of Nogo-A and NgR in hippocampus were detected by Western Blot.Results:The escape latency of rats in AD group was significantly longer than that in sham-operated group and was significantly shorter in electro-acupuncture group than that in AD group. The percentage of swimming time in the original quadrant in AD group was significantly lower than that in sham-operated group and was significantly higher in electro-acupuncture group than in AD group. The down-regulated Nogo-A and up-regulated NgR were discovered in AD group and were corrected by electro-acupuncture.Conclusion:The Nogo-A up-regulation and NgR down-regulation in AD rats have relationship with the pathological changes. The treatments of electro-acupuncture obviously improved the cognitive functions, of which the change of NgR expression are supposed to be one of the mechanisms.
Alzheimer disease Hippocampus Electroacupuncture @Nogo-A @NgR
*陕西省科技攻关项目资助[2006K13-G1(7)]
▲通讯作者
阿尔茨海默病 海马 电针 @Nogo-A @NgR
R749.16
A
10.3969/j.issn.1000-7377.2015.02.006
