细胞色素氧化酶3A4启动子报告基因的构建及其活性检测
2015-03-21高旭东王春平杨予涛杨永平杨俊兰
张 帆,司 文,高旭东,冯 帆,王春平,杨予涛,杨永平,杨俊兰
1解放军总医院 肿瘤内科,北京 100853;2解放军第三零二医院 肝脏肿瘤诊疗与研究中心,北京 100039;3沈阳军区总医院 药剂科,辽宁沈阳 110016;4首都医科大学 神经科学研究所,北京 100071
细胞色素氧化酶3A4启动子报告基因的构建及其活性检测
张 帆1,司 文1,高旭东2,冯 帆3,王春平2,杨予涛4,杨永平2,杨俊兰1
1解放军总医院 肿瘤内科,北京 100853;2解放军第三零二医院 肝脏肿瘤诊疗与研究中心,北京 100039;3沈阳军区总医院 药剂科,辽宁沈阳 110016;4首都医科大学 神经科学研究所,北京 100071
目的建立细胞色素氧化酶(cytochrome P-450,CYP)3A4启动子报告基因并在孕烷X受体(pregnane X receptor,PXR)表达阳性的肿瘤细胞中检测其转录活性。方法利用PCR扩增CYP 3A4的启动子区远端调控序列(-7836/-7208)和近端调控序列(-362/+52)序列;将上述序列克隆至pGL3-Promoter载体上;利用萤光素酶报告基因系统检测CYP 3A4报告基因的活性。结果在肝癌细胞系中,PXR的激动剂利福平能够剂量依赖性地诱导远端调控序列荧光素酶报告基因(R2=0.92;P=0.003 4)和近端调控序列荧光素酶报告基因(R2=0.95;P=0.011)的活性,EC50为(5.65±0.58)μmol/L和(8.91±1.12)μmol/L;PXR的拮抗剂酮康唑能够剂量依赖性地抑制利福平诱导的远端调控序列荧光素酶报告基因(R2=0.92;P=0.003 4)和PXRELuc(R2=0.92;P=0.003 4)活性,IC50为(0.55±0.08)μmol/L和(0.94±0.14)μmol/L。此外,多种化疗药物(PXR的潜在配体)能够在PXR阳性的肿瘤细胞系中诱导远端调控序列荧光素酶报告基因和近端调控序列荧光素酶报告基因的活性。结论成功构建了CYP 3A4启动子报告基因,在此基础上建立了在不同肿瘤细胞中检测PXR转录活性的方法。
细胞色素氧化酶3A4;孕烷X受体;萤光素酶报告基因;转录活性
孕烷X受体(pregnane X receptor,PXR)在消化系统器官和肿瘤组织中分布广泛,其结构由转录激活的N-末端结构域(N-terminal domain, N-TD)、保守的DNA结合区(DNA-binding domain,DBD)和高度可变的配体结合的C-末端结构域(ligand binding domain,LBD)组成[1-6]。PXR与配体结合后能够转位至细胞核,介导下游基因的转录[7]。多种内/外源化学物质被确定为PXR的配体,能够诱导CYP3A4、CYP2B6、CYP2C8、CYP2C9和CYP2C19等多种亚型的CYP 450转录[2-3]。其中,CYP 3A4是最为常见的分布广泛的CYP 450亚型[3]。CYP 3A4的表达量及其催化活性是肝代谢活性等的标志,能够介导吉非替尼和索拉非尼等化疗药物的氧化代谢。本研究根据基因文库的序列,选取CYP 3A4启动子区域中含有PXR结合元件DR3和ER6的远端调控序列(-7836/-7208),以及仅含有ER6位点的近端调控序列(-362/+52),将上述两段序列克隆到pGL3-启动子载体上,构建CYP 3A4报告基因,检测其活性,为后续研究靶向药物的代谢、清除及耐药机制奠定基础。
材料和方法
1 材料 质粒pGL3-Prpmopter和β-gal表达载体均由首都医科大学杨予涛博士惠赐;胃癌BGC823、肝癌HepG2、大肠癌LS180、肺癌A549和乳腺癌MCF-7等细胞系均由本实验室保存;所用引物购自赛百盛(SBS)公司,使用pH 8.0的10 mmol/L Tris配置成200 μl溶液;Primary-STAR以及Taq等DNA聚合酶购自宝生物公司(TaKaRa);限定性内切酶KpnⅠ和XhoⅠ,以及T4-DNA连接酶购自New England Biolab公司;质粒小提试剂盒、DNA回收试剂盒、PCR产物回收试剂盒以及萤光素酶报告基因试剂盒等均购自Promega公司;含蛋白酶抑制剂(1∶500)的RIPA细胞裂解液、SDS-蛋白电泳Loading Buffer、蛋白Marker以及硝酸纤维素膜(NC膜)购自Bio-Rad公司;蛋白印迹实验(Western blot)所用抗体购自Santa Cruz公司;化学发光试剂盒(Qiangen公司);转染试剂Lipofectin AMINE2000购自Invitrogen公司;CCK-8试剂和牛血清白蛋白购自Amerresco公司;DMEM细胞培养基和胎牛血清购自Gibco公司;细胞培养皿及24孔培养板购自Corning公司;工具药物利福平和酮康唑购自Sigma公司,分子靶向药物索拉非尼和吉非替尼购自大连美仑公司,细胞毒性药物紫杉醇和丝裂霉素购自Sigma公司,全部药物均由质谱确证其结构正确,采用高效液相色谱(high performance liquid chromatography,HPLC)检测其纯度>98%,使用二甲亚砜配制成3 mmol/L的母液,4℃保存。
2 主要设备 PCR仪(ABI公司);DNA电泳仪、SDS-PAGE电泳仪和半干转膜仪(Bio-Rad公司);多功能酶标仪(Wallac公司);TS-100倒置相差显微镜(Nikon公司)。
3 CYP 3A4启动子区序列的克隆 CYP 3A4启动子区域中PXR的结合位点XREM(-7836/-7208)和PXRE(-362/+52)序列设计引物,以XhoⅠ和KpnⅠ为限定性内切酶位点,扩增XREM和PXRE序列,PCR产物回收、备用。所用引物:XREM Sense:5′-CGCTCGAGTCTAGAGAGATGGTTCATTCC-3′;Anti-sense 5′-CGGGTACCTCGTCAACAGGTTAAAG GAG-3′;PXRE Sense:5′-CGCTCGAGAGATCTGT AGGTGTGGCTTGTTGG-3′;Anti-sense 5′-CGGGTA CCTGTTGCTCTTTGCTGGGCTATGTGC-3′。
4 XREM-Luc和PXRE-Luc报告基因载体的构建
将pGL3-Prpmopter载体和PCR产物使用XhoⅠ和KpnⅠ酶切4 ~ 6 h,琼脂糖凝胶电泳回收,备用。使用T4连接酶进行连接实验,将连接产物转化DH5α感受态细胞,铺板、挑菌、扩增并提取质粒,进行PCR和酶切鉴定,测序。
5 细胞培养及转染 使用添加10%胎牛血清的DMEM培养基培养BGC823、HepG2、LS180、A549和MCF-7等细胞,用不含抗生素的DMEM培养基,将细胞种于24孔板(80% ~ 90%密度)中,按照厂商说明书将XREM-Luc和PXRE-Luc,以及内参β-gal质粒转染相应细胞。转染相应质粒后的细胞,按照表1中所示药物浓度梯度处理细胞。对于荧光素酶活性实验,使用10 μmol/L利福平预处理细胞,再加入酮康唑;对于细胞抑制率实验,则仅使用化疗药物。
6 XREM-Luc和PXRE-Luc报告基因活性的测定
按照王博等[8]的方法,测定报告基因的萤光素酶活性及内参活性,在此基础上计算相对活性和抑制率。计算公式:
相对活性(%)=(药物处理组报告基因活性-溶剂对照组报告基因活性)/(药物最大作用组报告基因活性-溶剂对照组报告基因活性)×100%[9]。
药物作用抑制率(%)=(激动剂处理组报告基因活性-药物处理组报告基因活性)/(激动剂处理组报告基因活性-溶剂对照组报告基因活性)×100%。
利用Origin 8.5软件在此基础上分别计算EC50和IC50值。
7 细胞抑制率实验 按照张帆等[10]的方法,将肿瘤癌细胞系接种于24孔板中,待每孔细胞密度达到80% ~ 90%换新鲜培养基,每孔1 ml;配置化疗药物工作液,浓度梯度见表2,按照1∶1 000比例加入24孔板中(每孔1 μl),化疗药物的终浓度见表2。孵育72 h后,每孔加入30 μl CCK-8试剂,孵育4 h后,多功能酶标仪在450 nm 测定吸光度,并计算细胞增殖抑制率。
抑制率(%) = (对照组A 450 nm -药物处理组A 450 nm)/(对照组A 450 nm -溶剂对照组A 450 nm)×100%。
8 蛋白免疫印迹实验 按照冯帆等[11]的方法进行实验,一抗稀释条件:兔抗人PXR单抗(1∶2 000稀释);兔抗人GAPDH内参多抗(1∶5 000稀释),37℃孵育2 h。硝酸纤维素膜用TBST洗3次,二抗稀释条件:辣根过氧化物酶-羊抗兔单克隆抗体(1: 5 000稀释),室温孵育1 h。
9 统计学分析 使用统计和绘图软件Origin 6.1中的Sigmoidal Fit模块进行回归分析,拟合药物作用的量效曲线并计算相应IC50值和EC50值;使用Origin 6.1软件中的Polymoidal Fit模块拟合药物作用曲线,并计算其R2值和P值。

表1 实验中工具药物和化疗药物的浓度梯度设置Tab. 1 Concentrations of compounds used in concentration-response effect test

表2 实验中化疗药物浓度梯度设置Tab. 2 Concentrations of compounds used in concentration-response effect test

表3 在HepG2细胞中检测CYP 3A4报告基因活性Tab. 3 Activity of CYP3A4 reporters in HepG2 cell
结 果
1 XREM-Luc和PXRE-Luc报告基因表达载体的构建 XREM-Luc和PXRE-Luc质粒进行菌落PCR鉴定,仅有成功插入XREM(图1A)及PXRE (图1B)序列的质粒能够扩增出PCR条带;对阳性克隆进行酶切鉴定(图1C、图1D),符合结果预期。
2 XREM-Luc和PXRE-Luc载体的测序鉴定 对前述的阳性克隆进行测序分析,表明所得序列(出示XREM-Luc和PXRE-Luc重组载体中,XREM和PXRE序列中的PXR结合位点)无突变发生。见图2。
3 XREM-Luc和PXRE-Luc的活性鉴定 PXR的激动剂利福平能够在HepG2细胞中剂量依赖性地诱导XREM-Luc(R2=0.92;P=0.003 4)和PXRE-Luc (R2=0.95;P=0.011)活性。PXR的拮抗剂酮康唑能够剂量依赖性地抑制PXR激动剂利福平诱导的XREM-Luc(R2=0.96;P=0.009 8)和PXRE-Luc(R2= 0.98;P=0.002 2)活性。这表明,构建的CYP 3A4报告基因具有明确的活性。见图3、表3。
4 化疗药物对XREM-Luc和PXRE-Luc活性诱导作用 PXR在胃癌BGC823、肝癌HepG2、大肠癌LS180、肺癌A549和乳腺癌MCF-7等细胞系中均有表达(图4)。索拉非尼、吉非替尼、紫杉醇和丝列霉素能够在BGC823、HepG2、LS180、A549和MCF-7细胞中剂量依赖地升高远端调控序列荧光素酶报告基因和近端调控序列荧光素酶报告基因的活性(表4 ~表5)。上述化疗药能够在PXR阳性的肿瘤细胞内诱导CYP3A4报告基因的活性,其诱导浓度与其作用(杀伤肿瘤细胞)浓度接近。见表6。
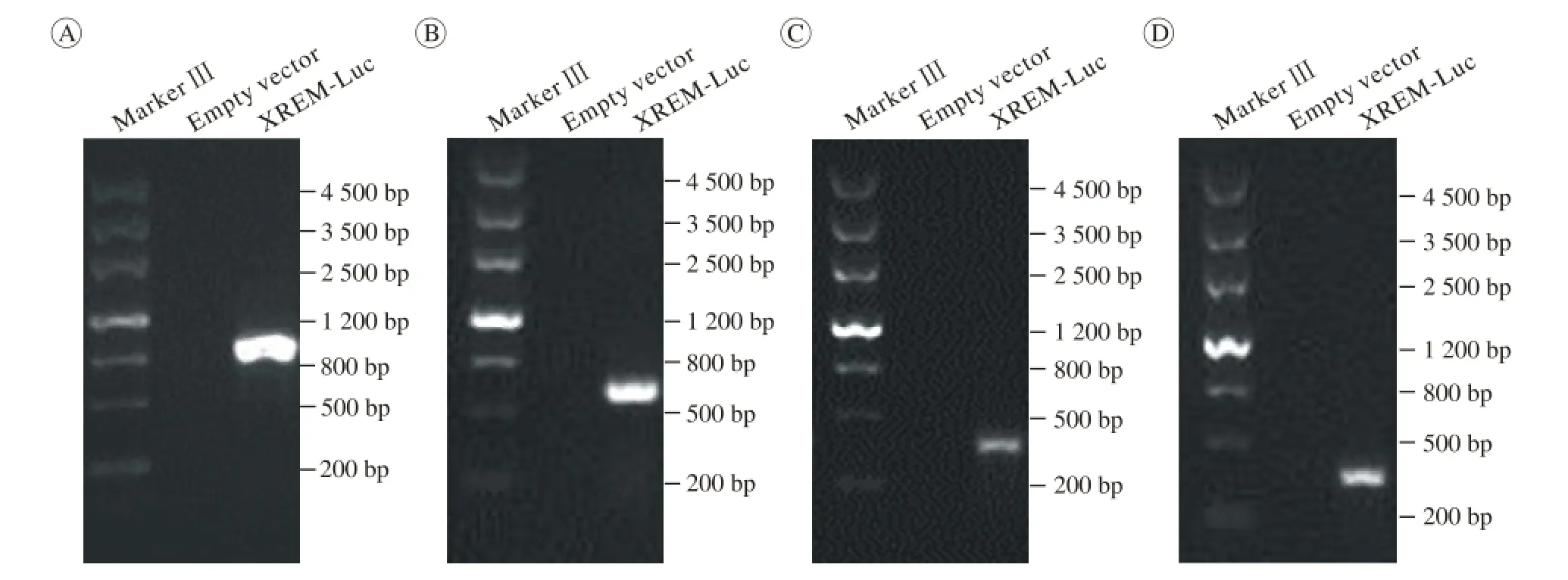
图 1 重组CYP 3A4告基因的PCR和酶切鉴定A ~ B: PCR鉴定结果; C ~ D: 限定性内切酶切鉴定实验结果; A: XREM-Luc报告基因; B: PXRE-Luc报告基因Fig. 1 Identif i cation of CYP3A4 luciferase reporters via PCR assays and restriction endonuclease experiment A-B: PCR assays; C-D: restriction endonuclease experiment; A: XREM-Luc reporter; B: PXRE-Luc reporter


图 2 重组PXR 应答元件报告基因的测序鉴定A: XREM-Luc 报告基因; B: PXRE-Luc报告基因Fig. 2 Identif i cation of CYP3A4 luciferase reporters via DNA sequencing A: XREM-Luc reporter; B: PXRE-Luc reporter
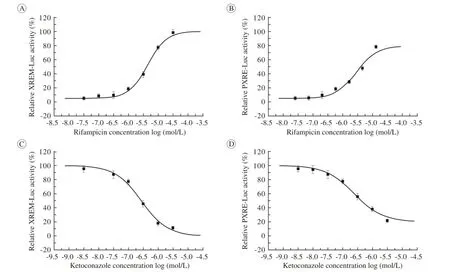
图 3 PXR在GC823、 HepG2、 LS180、 A549和MCF-7细胞中的表达鉴定A: A549转染XREM-Luc表达载体后使用系列浓度梯度的利福平(PXR激动剂); B: A549转染PXRE-Luc表达载体后使用系列浓度梯度的利福平; C: A549转染XREM-Luc表达载体后使用10μmol/L 利福平后,再使用系列浓度梯度的酮康唑 (PXR拮抗剂)处理细胞; C: A549转染XREM-Luc表达载体后使用10μmol/L 利福平后,再使用系列浓度梯度的酮康唑处理细胞; D: A549转染PXRE-Luc表达载体后使用10μmol/L 利福平后,再使用系列浓度梯度的酮康唑处理细胞Fig. 3 Effect of PXR agonist and antagonist on XREM-Luc and PXRE-Luc activity A: A549 cells transfected with XREM-Luc and then treated with indicated concentrations of Rifampicin (agonist of PXR); B: A549 cells transfected with PXRE-Luc and then treated with indicated concentrations of Rifampicin (agonist of PXR); C: A549 cells transfected with XREM-Luc and then treated with indicated concentrations of Rifampicin (agonist of PXR) and Ketoconazole (antagonist of PXR); D: A549 cells transfected with PXRE-Luc and then treated with indicated concentrations of Rifampicin (agonist of PXR) and Ketoconazole (antagonist of PXR)
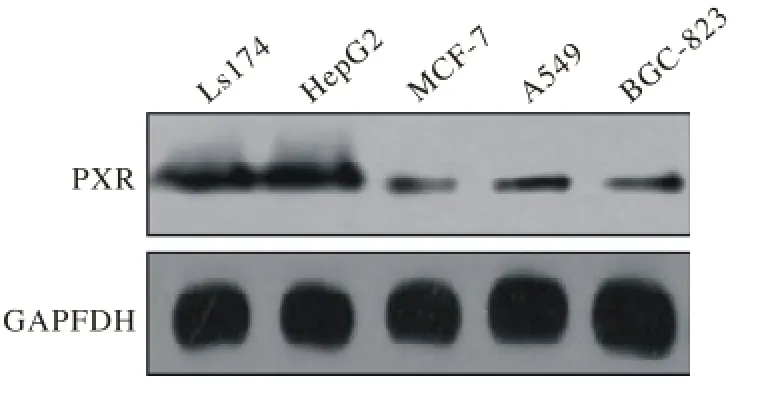
图 4 PXR在BGC823、 HepG2、 LS180、 A549和MCF-7细胞中的表达鉴定Fig. 4 Expression of PXR in BGC823, HepG2, LS180, A549 and MCF-7 cells
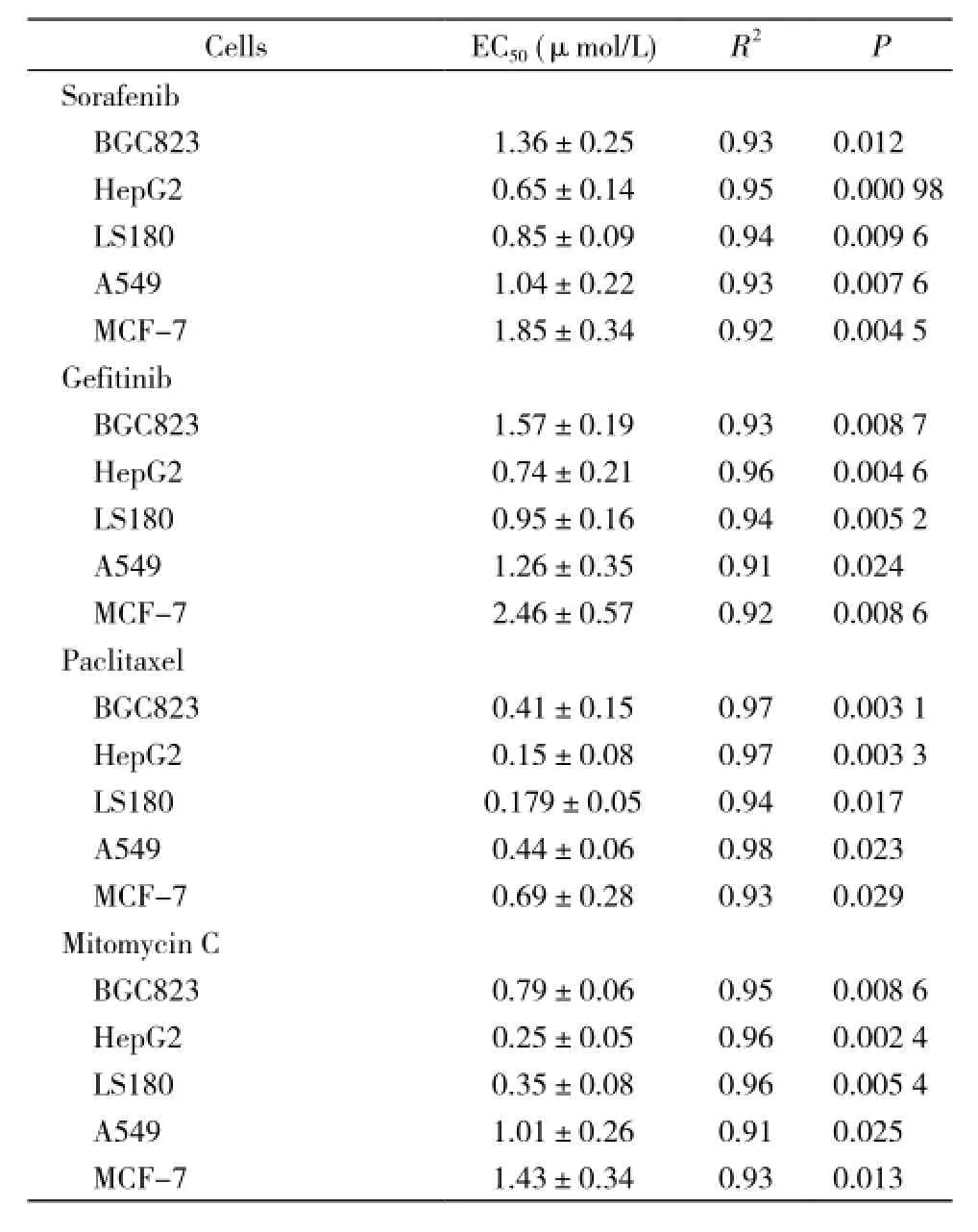
表4 化疗药物在不同细胞中诱导XREM-Luc报告基因的活性Tab. 4 Activity of XREM-Luc reporter induced by chemotherapeutics

表5 化疗药物在不同细胞中诱导PXRE-Luc报告基因的活性Tab. 5 Activity of PXRE-Luc reporter induced by chemotherapeutics
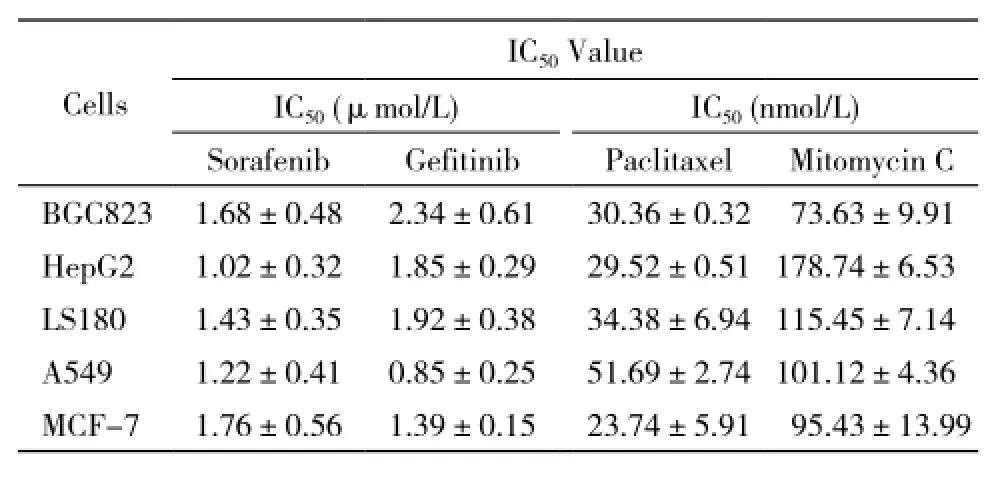
表6 化疗药物作用于BGC823、HepG2、LS180、A549和MCF-7细胞的IC50值Tab. 6 Cytotoxicity activity of chemotherapeutics on BGC823, HepG2, LS180, A549 and MCF-7 cells
讨 论
PXR不仅在消化系统肿瘤中分布广泛,其下游基因MDR-1编码和MRP-2/3能够调控肺癌细胞的化疗药耐受;乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)能够调控乳腺癌细胞系的化疗药耐受作用[12-13]。此外,PXR下游基因CYPs能够介导化疗药的氧化代谢,CYP 3A4是最主要的CYPs亚型,能够介导索拉非尼等分子靶向化疗药物的氧化代谢,影响其化疗效果[14]。为研究CYP 3A4的功能以及对化疗药物的影响,本研究构建了CYP 3A4的报告基因远端调控序列荧光素酶报告基因和近端调控序列荧光素酶报告基因。PXR的激动剂利福平能够剂量依赖性地诱导远端调控序列荧光素酶报告基因和近端调控序列荧光素酶报告基因的活性(表3);PXR的拮抗剂酮康唑能够剂量依赖性地抑制利福平诱导的远端调控序列荧光素酶报告基因和近端调控序列荧光素酶报告基因的活性(表3)。这表明本研究成功构建了CYP 3A4报告基因,建立了利用CYP 3A4报告基因检测PXR转录活性的方法。
PXR/CYP3A4在乳腺癌、肝癌等多种肿瘤组织中均有表达。紫杉醇、丝裂霉素和喜树碱等化疗药以及利福平等抗生素都能够诱导PXR的活性并介导CYP 3A4和CYP 2B6等型CYPs的表达[1-2]。另有报道称,多种蛋白激酶抑制剂:吉非替尼、伊马替尼、拉帕替尼以及舒尼替尼等也能够诱导PXR的活性[15-17]。因此,药物代谢系统可能是肿瘤细胞原发性/诱导性多药耐药的新作用机制。为此,本研究选取了代表性细胞毒性化疗药物:紫杉醇和丝列霉素,以及小分子蛋白激酶抑制剂索拉非尼和吉非替尼,在PXR表达阳性的乳腺癌、肝癌、肺癌、大肠癌和胃癌细胞系中检测其对CYP 3A4报告基因活性的影响(表4 ~表5)。结果显示,上述药物均能够诱导远端调控序列荧光素酶报告基因和近端调控序列荧光素酶报告基因的活性(表4 ~表5)。进一步,我们得到了上述药物作用于所选细胞系的IC50值(表6),发现小分子蛋白激酶抑制剂诱导PXR活性的浓度与其杀伤肿瘤细胞的作用浓度基本相当,而细胞毒性化疗药诱导PXR活性的浓度比其杀伤肿瘤细胞的作用浓度略高。
本研究进一步拓展了对药物代谢和清除系统调控肿瘤细胞癌化疗药物多药耐受的认识,对深入理解其分子机制以及化疗药物临床耐药的检测指标具有重要临床意义;也为今后开发新的肿瘤化药治疗策略提供更多选择。
1 Glas J, Seiderer J, Fischer D, et al. Pregnane X receptor (PXR/ NR1I2) gene haplotypes modulate susceptibility to inflammatory bowel disease[J]. Inflamm Bowel Dis, 2011, 17(9): 1917-1924.
2 Krausova L, Stejskalova L, Wang H, et al. Metformin suppresses pregnane X receptor (PXR)-regulated transactivation of CYP3A4 gene[J]. Biochem Pharmacol, 2011, 82(11): 1771-1780.
3 刘志浩,李燕.核受体对药物代谢酶和转运体的调控[J].药学学报,2012,47(12):1575-1581.
4 Istrate MA, Nussler AK, Eichelbaum M, et al. Regulation of CYP3A4 by pregnane X receptor: The role of nuclear receptors competing for response element binding[J]. Biochem Biophys Res Commun, 2010, 393(4): 688-693.
5 Thompson PD, Jurutka PW, Whitfield GK, et al. Liganded VDR induces CYP3A4 in small intestinal and colon cancer cells via Dr3 and ER6 vitamin D responsive elements[J]. Biochem Biophys Res Commun, 2002, 299(5): 730-738.
6 Kakizaki S, Takizawa D, Tojima H, et al. Xenobiotic-Sensing nuclear receptors CAR and PXR as drug targets in cholestatic liver disease[J]. Curr Drug Targets, 2009, 10(11): 1156-1163.
7 Wallace BD, Betts L, Talmage G, et al. Structural and functional analysis of the human nuclear xenobiotic receptor PXR in complex with RXRα[J]. J Mol Biol, 2013, 425(14): 2561-2577.
8 王博,冯帆,张帆,等.LINE-1ORF-1p对ERα阳性乳腺癌细胞的体外影响研究[J].军医进修学院学报,2012,33(7):763-766.
9 冯帆,龙隆,李微,等.应用高内涵分析技术识别雄激素受体激动剂[J].中国药理学与毒理学杂志,2014,28(1):42-50.
10 张帆,冯帆,任磊,等.反义核酸药物癌泰得对乳腺癌细胞株的体外杀伤作用[J].军医进修学院学报,2010,31(4):370-371.
11 冯帆, 张琼, 刘洪英, 等. 酪氨酸激酶抑制剂伊马替尼耐药K562细胞系的建立及其耐药特征[J]. 中国药理学与毒理学杂志,2012, 26(4): 563-569.
12 Amiri-Kordestani L, Basseville A, Kurdziel K, et al. Targeting MDR in breast and lung cancer: discriminating its potential importance from the failure of drug resistance reversal studies[J]. Drug Resist Updat, 2012, 15(1/2): 50-61.
13 Poirier A, Portmann R, Cascais AC, et al. The need for human breast cancer resistance protein substrate and inhibition evaluation in drug discovery and development: why, when, and how?[J]. Drug Metab Dispos, 2014, 42(9): 1466-1477.
14 Ye L, Yang X, Guo E, et al. Sorafenib metabolism is significantly altered in the liver tumor tissue of hepatocellular carcinoma patient[J]. PLoS One, 2014, 9(5):e96664.
15 Harmsen S, Meijerman I, Maas-Bakker RF, et al. PXR-mediated P-glycoprotein induction by small molecule tyrosine kinase inhibitors[J]. Eur J Pharm Sci, 2013, 48(4-5):644-649.
16 Yuen MF, Hou JL, Chutaputti A, et al. Hepatocellular carcinoma in the Asia pacific region[J]. J Gastroenterol Hepatol, 2009, 24(3):346-353.
17 Tanaka M, Katayama F, Kato H, et al. Hepatitis B and C virus infection and hepatocellular carcinoma in China: a review of epidemiology and control measures[J]. J Epidemiol, 2011, 21(6):401-416.
Construction of CYP 3A4 luciferase reporters and their transcription activity
ZHANG Fan1, SI Wen1, GAO Xudong2, FENG Fan3, WANG Chunping2, YANG Yutao4, YANG Yongping2, YANG Junlan11Department of Medical Oncology, Chinese PLA General Hospital, Beijing 100853, China;2Center for Liver Cancer, 302 Military Hospital of China, Beijing 100039, China;3Department of Pharmacy, General Hospital of Shenyang Military Command, Shenyang 110016, Liaoning Province, China;4Beijing Institute for Neuroscience, Beijing 100071, China
s: YANG Yongping. Email: yongpingyang@hotmail.com; YANG Junlan. Email: yangjunlan1123@126.com
Objective To construct the cytochrome P-450 (CYP) 3A4 luciferase reporters and test their transcription activity in the positive tumor cells expressed by pregnane X receptor (PXR). Methods The sequences of XREM (-7836/-7208) and PXRE (-362/+52) in CYP 3A4 promoter were amplif i ed via PCR method, and then they were cloned into pGL3-Promoter vectors. The activity of CYP 3A4 reporters was measured by luciferase assay. Results The Rifampicin, which was the agonist of PXR, induced the activity of XREM-Luc (R2=0.92; P=0.003 4) and PXRE-Luc (R2=0.95; P=0.011) in a dose dependent manner, with the EC50value of 5.65±0.58 μmol/L and 8.91±1.12 μmol/L, respectively. The Ketoconazole, which was the antagonist of PXR, inhibited the activity of XREM-Luc (R2=0.92; P=0.003 4) and PXRE-Luc (R2=0.92; P=0.003 4) induced by Rifampicin in a dose dependent manner, with the IC50value of 0.55±0.08 μmol/L and 0.94±0.14 μmol/L, respectively. In addition, the effect of some potential PXR's ligands on CYP 3A4 reporters could be examined in the cells expressed by PXR. Conclusion The construction of the CYP 3A4 reporters is successfully established, which lays foundation for further functional study of CYP 3A4.
cytochrome P-450 3A4; pregnane X receptor; luciferase reporters gene; transcriptional activity
R 73-3
A
2095-5227(2015)02-0160-06
10.3969/j.issn.2095-5227.2015.02.018
时间:2014-10-11 16:51
http://www.cnki.net/kcms/detail/11.3275.R.20141011.1651.003.html
2014-08-12
国家科技重大专项项目(2012ZX1002D2DD;2013ZX100 05002);国家自然科学基金项目(81272330;81202362)
Supported by the National Science and Technology Major Project (2012ZX 1002D2DD; 2013ZX10005002); National Natural Science Foundation of China (81272330; 81202362)
张帆,女,博士,主治医师。研究方向:肿瘤学。Email: zfzhangfan10@126.com
杨永平,男,硕士,主任医师,主任。Email: yongping yang@hotmail.com;杨俊兰,女,硕士,主任医师。Email: yangjunlan 1123@126.com
