体外冲击波联合高压氧治疗骨不连的实验研究*
2015-03-18郁少林李宏宇来文兵
郁少林,李宏宇,来文兵,杨 勇,蔡 敏
(广西壮族自治区人民医院骨科,南宁530021)
自20世纪90年代体外冲击波(extracorpoporeal shock wave,ESW)用于治疗骨不连以来,其疗效得到了临床实验的证实[1]。高压氧(hyperbaric oxygen,HBO)治疗有提高氧分压,增加血氧弥散距离,改善缺氧组织状态、改善微循环等优点。研究表明:高压氧有明显促进成骨细胞成骨分化,增加骨痂内钙、磷等多种微量元素的水平[2-3]。本文通过将体外冲击波对骨折端产生的力学作用和高压氧促进骨生长、改善微循环的作用结合对兔桡骨骨折骨不连进行治疗,取得了满意效果,为临床治疗骨不连提供了一种良好协同方法。
1 材料与方法
1.1 实验动物与仪器 标准健康雄性新西兰实验大白兔50只,体质量3.0~3.5kg,兔龄5~6个月;体外冲击波碎石机;动物高压氧舱;数码成像X线机(DR);光学显微镜;原子吸收分光光度计等。
1.2 方法
1.2.1 模型制作 麻醉后,参照王旭明等[4]的改良“截骨骨不连模型”,截除双侧桡骨中段1.0cm(包括骨膜),断端填塞明胶海绵后,缝合伤口。肌内注射青霉素30万单位,12周后摄X线片,如出现骨折端硬化,断端间隙存在,髓腔封闭,证实骨不连模型建立成功,则纳入研究。
1.2.2 分组情况 48只实验动物造模成功,将48只兔子按体质量进行编号,运用随机数字表将实验动物随机分成4组,每组12只,共24条桡骨,A组为体外冲击波联合高压氧组;B组为单纯高压氧组;C组为体外冲击波组;D组为完全对照组,不做任何干预措施。4组实验动物采用相同的喂养及居住环境。
1.2.3 体外冲击波治疗 麻醉后将实验动物固定在体外冲击波碎石机上,透视定位后,采用冲击波焦点能量为0.5mJ/mm2,频率为70~80次/分,冲击量为800次,焦点聚焦范围为1.5cm2,在透视下调整冲击焦点,分别对骨折远、近端边缘进行冲击共进行两次。在治疗过程中,定时X线透视,以保证焦点准确的定位。冲击波治疗时间约20min,共进行冲击波治疗1次。
1.2.4 高压氧治疗 在动物高压氧舱进行,压力0.25Mpa(2.5ATA),以循环封闭方式吸氧,加压时间为20~30min,稳压时间70min,减压时间30~35min,1次/天,冲击波治疗后连续进行7d高压氧治疗,此后3周每周进行2次高压氧治疗。
1.2.5 X线片检查 于体外冲击波治疗前及治疗后4、8、12周行X线片检查,主要观察骨不连区的间隙距离变化,并在计算机上精确测量治疗前后骨折间隙的平均宽度,采用多点测量取平均值的方法,记录所获得的平均值。根据Perkins公式计算骨痂生成量:骨痂生成量=2πr1(r2-r1)L。其中r1为治疗前骨质半径,r2为治疗后的半径,L为骨痂长度。
1.2.6 光镜检查 每个时间点每组处死实验动物4只(空气栓塞法),取出骨不连部位(长1.5~2.0cm)组织,生理盐水冲洗后,置入4%多聚甲醛溶液固定,48h后,置入10%乙二胺四乙酸二钠(EDTA)中脱钙4周,每周更换脱钙液1次。待标本变软(注射针头无阻力穿过)后用梯度乙醇脱水,二甲苯透明,石蜡处理切片,HE染色,4μm连续切片,HE染色后制作成切片后在光学显微镜下进行组织学观察,观察骨痂中成骨细胞计数。
1.2.7 骨痂钙元素水平测定 取骨不连区部分新生骨痂,滤纸吸干后置入烤箱中进行烘干(60℃,48h),称质量后放入到硝酸∶高氯酸(4∶1)溶液中24h,取出标本置于电热板加热消化至白色液体,然后用去离子水稀释定容,定容后直接在原子吸收分光光度计上测定钙元素水平。其计算公式为:钙元素水平(mg/g)比=元素水平(mg)/骨痂干质量(g)。
1.3 统计学处理 采用SPSS19.0软件,计量资料用±s表示。所得资料不同组间各时间点比较采用单因素方差分析(one-way ANOVA),方差齐的采用 LSD-t检验比较不同组间差异。以P<0.05为差异有统计学意义。
2 结 果
2.1 大体观察 A组达到骨性愈合,表明平整光滑,颜色亮,质地硬,较难掰断;B、D组未愈合,表现为纤维连接,形成假关节,未见明显的骨痂生成;C组基本达到愈合,表现为骨皮质完整,皮质有少量半点,较A组稍薄,有大量骨痂,抗外力稍弱。见图1。
2.2 X线征观察 A、C两组骨不连间隙变化明显,其中A组变化较C组更为明显。B、D两组骨折间隙无明显改变,骨折断端仍为硬化骨,骨髓腔封闭,呈现骨不连影像学改变。见图2,数据比较见表1~2。

图1 12周时处死兔大体标本
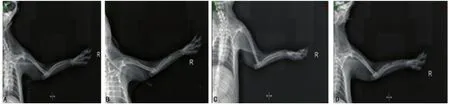
图2 治疗后12周X线观察
表1 各组治疗前后不同时间X线检查骨折间隙变化(±s)
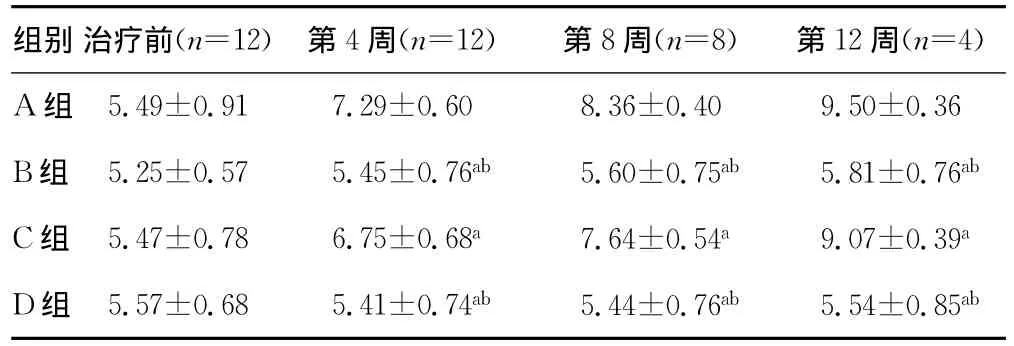
表1 各组治疗前后不同时间X线检查骨折间隙变化(±s)
a:P<0.05,与A组比较;b:P<0.05,与B组比较。
组别 治疗前(n=12) 第4周(n=12) 第8周(n=8) 第12周(n=4)5.49±0.91 7.29±0.60 8.36±0.40 9.50±0.36 B组 5.25±0.57 5.45±0.76ab 5.60±0.75ab 5.81±0.76ab C组 5.47±0.78 6.75±0.68a 7.64±0.54a 9.07±0.39a D组 5.57±0.68 5.41±0.74ab 5.44±0.76ab 5.54±0.85 A组ab
表2 治疗后骨痂生成量(±s)

表2 治疗后骨痂生成量(±s)
a:P<0.05,与A组比较;b:P<0.05,与B组比较。
组别 第4周(n=4) 第8周(n=4) 第12周(n=4)27.44±5.18 36.78±5.38 46.5±7.09 B组 6.60±0.44ab 6.91±0.25ab 7.00±0.23ab C组 24.17±3.38a 32.75±3.29a 37.08±6.05a D组 6.42±0.51ab 6.55±0.33ab 6.50±0.14 A组ab
2.3 光镜检查 A组4周时骨岛形成,骨痂以软骨骨痂和骨性骨痂为主,可见骨小梁周围有成骨细胞,骨小梁增粗;8周骨样组织逐渐成熟骨化,形成新的骨组织,纤维组织出现钙化和骨化,骨小梁继续增粗增多,可见部分连续骨小梁(图3A);12周,此时骨小梁粗大且致密,连续性较明显,可见大量正常骨成分及成骨细胞。C组4周时可见骨小梁增粗,骨痂以纤维骨痂和软骨骨痂为主,未见骨性骨痂,骨小梁周围可见有成骨细胞,但数量不及A组;8周可见骨岛形成,骨小梁较前增粗,可见少量骨化组织,未见连续骨小梁(图3B);12周时骨小梁数量明显增多,但排列不规则,可见部分呈网络状的骨小梁,骨组织无生长迹象,纤维组织出现骨化现象,A、C两组各时间点骨痂中铺上元量水平比较。B、D两组各时间段所取骨间隙处无明显骨痂生成,故未进行骨痂钙水平及钙元素的测定。早期可见炎症细胞浸润,镜下未见活跃的呈增生状的成骨细胞,见较多的成纤维细胞和排列紊乱的纤维结缔组织。
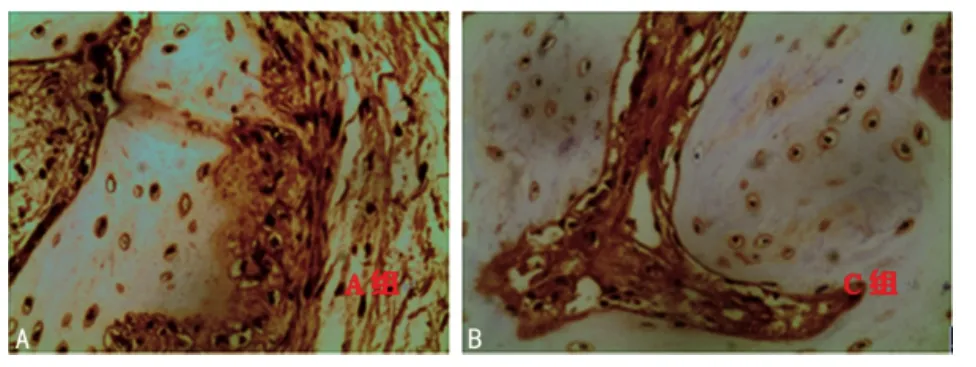
图3 治疗后8周光镜观察情况
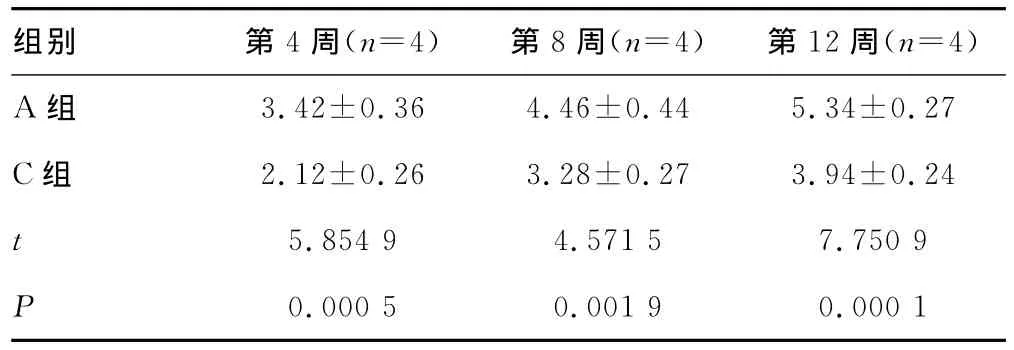
表3 A、C两组各时间点骨痂中钙元素水平比较(mg/g)
2.4 骨痂钙元素水平 B、D组无明显骨痂生成,A、C两组各时间骨痂中成骨细胞计数见表4。
表4 A、C两组各时间点骨痂中成骨细胞计数(±s)
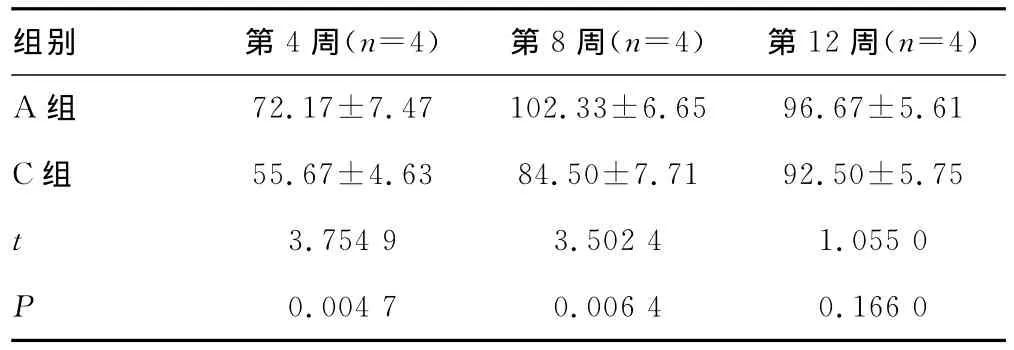
表4 A、C两组各时间点骨痂中成骨细胞计数(±s)
组别 第4周(n=4) 第8周(n=4) 第12周(n=4)72.17±7.47 102.33±6.65 96.67±5.61 C组 55.67±4.63 84.50±7.71 92.50±5.75 t 3.754 9 3.502 4 1.055 0 P A组0.004 7 0.006 4 0.166 0
3 讨 论
3.1 骨不连产生原因分析 骨不连发生率约为5%~50%[5],其发生受多种因素的影响,这些因素包括以下几点。(1)血供因素,骨折的愈合机制启动的根本因素在于局部的血液供应,Melnyk等[6]研究表明骨折软组织损伤或过度剥离可明显增加骨不连的发生;(2)固定问题:不正确的固定方式及内固定术后不正确的功能锻炼,可导致内固定松动或移位而造成骨不连的发生[7-8];(3)感染:感染本身并不能直接导致骨不连的发生[9],但感染通过改变骨折端的局部内环境及微生物以及其分泌物对骨及周围软组织的直接破坏,是导致骨不连的主要原因;(4)全身因素,如高龄、代谢性疾病、糖尿病、酗酒、营养不良、恶病质等因素的存在会延迟骨折愈合,甚至造成骨不连的发生;(5)早期手术:潘治军等[10]对280例骨不连患者进行分析得出,早期手术与骨痂生长能力存在较大相关性。
3.2 体外冲击波联合高压氧治疗骨不连的意义 高压氧能加快骨痂生长及骨痂中钙盐的沉积,促进骨的钙化[11]。体外冲击波联合高压氧作用的可能机制如下。(1)体外冲击波使骨折断端产生微骨折,重启骨折愈合机制,而高压氧治疗通过增加动脉血和缺氧组织氧分压梯度而提高骨折处氧供应,改善骨折处缺血缺氧环境,起到加快骨折愈合的作用[12]。(2)促进成骨细胞成骨分化。在本实验中,发现体外冲击波联合高压氧组的成骨作用明显强于单纯体外冲击波治疗组,光镜检查也发现:联合高压氧组镜下成骨细胞数明显多于单纯体外冲击组。(3)促进某些生长因子的作用。国内学者研究表明高压氧能促进骨折断面生长因子BMP-2、BMP-7、CD34、VEGF表达上调,且VEGF与BMP-2、BMP-7、CD34呈正相关[13],这些因子的存在能起到加快新生骨形成作用,促进骨折的愈合。(4)减少影响骨折愈合物质的产生。研究表明高压氧治疗具有减少血浆中分子物质的作用,这些中分子物质对组织愈合产生负面影响[14]。
本研究表明高压氧对体外冲击波治疗后骨不连部位骨组织生长起到了良好的促进作用,提高了体外冲击波治疗骨不连的有效性。冲击波的作用主要为:造成骨不连两端的微骨折、打通封闭髓腔、形成血肿,激活骨细胞的再生,再次启动骨折的愈合过程。冲击波治疗操作过程中应注意:(1)治疗前给予足量麻醉剂,以免实验动物中途苏醒;(2)固定动物不可过紧,以免造成肢体的缺血坏死;(3)应在透视下定位后方可进行冲击波治疗。单纯高压氧治疗对骨不连无明显作用;高压氧的主要协同作用表现为:(1)改善骨不连部位氧供及血供,改善局部微循环,促进骨折愈合;(2)促进骨折端骨痂形成;(3)促进骨痂中钙及其他元素的沉积;(4)促进成骨折端成骨细胞分化。对于使用冲击波治疗的骨不连患者,如果无明显禁忌证,可以联合高压氧治疗来提高疗效。
[1]Wang CJ,Chen HS,Chen CE,et al.Treatment of nonunions of long bone fractures with shock waves[J].Clin Orthop Relat Res,2001,387:95-101.
[2]吴东,吴建珊,阎福华,等.高压氧对体外培养的成骨细胞增殖和分化的影响[J].生物化与生物物理进展,2008,35(7):791-800.
[3]张传开,史跃,孙阳,等.自体骨髓细胞移植联合高压氧治疗四肢骨不连[J].组织工程研究,2013,17(19):3515-3520.
[4]王旭明,邢更彦,韩新明.体外冲击波结合自体5-BrdU标记骨髓间充质干细胞移植治疗骨不连的实验研究[J].生物骨科材料与临床研究,2010,7(3):1-4.
[5]葛站勇,白俊清.胫骨骨不连的常见原因及治疗进展[J].中国煤炭工业医学杂志,2013,16(3):508-510.
[6]Melnyk M,Henke T,Claes L,et al.Revascularisation during fracture healing with soft tissue injury [J].Arch Orthop Trauma Surg,2008,128(10):1159-1165.
[7]黄志明,林川,熊涛.18例肱骨干骨折术后骨不连原因分析[J].重庆医学,2008,37(21):2472-2475.
[8]彭国常,汪玉辉,李跃,等.胫骨内固定术后非感染性骨不连的原因分析及治疗[J].临医学工程,2014,21(1):52-53.
[9]蒋亮东,陶澄,何爱咏,等.75例股骨骨折不愈合发生的原因分析[J].重庆医学,2014,43(8):970-972.
[10]潘治军,杨涛,思玉楼,等.280例骨不连原因分析[J].中国骨伤,2014,26(4):284-285.
[11]Kuffler DP.Hyperbaric oxygen therapy:can it prevent ir-radiation-induced necrosis[J].Int Exp Neurol,2012,235(2):517-527.
[12]孙贵平.高压氧在下肢创伤中的疗效分析V.华中科技大学,2012.
[13]刘震.高压氧对兔下颌骨牵引区生长因子表达的影响[D].泸州医学院,2012.
[14]林忠豪,张玲,练克俭,等.高压氧综合治疗肢体创伤疗效观察[J].中华理疗杂志,2000,23(3):147-149.
