20-HETE在心肌缺血再灌注损伤中的作用及机制研究*
2015-03-14郭立荣孔德营
韩 勇,郭立荣,孔德营,蒋 慧,田 虹
(遵义医学院:1.生理学教研室;2.形态学实验室,贵州遵义563000)
20-羟二十烷花生四烯酸(20-HETE)是 Capdevila等[1]学者首先发现在肝脏组织中由细胞色素P-450催化花生四烯酸(AA)生成的内源性活性物质,被发现以来得到了心血管领域学者的关注,目前研究认为20-HETE是调节肾、脑等小动脉血管紧张度的重要因子[2-4]。但其对心脏功能的影响研究甚少,有学者[5-6]在心肌缺血再灌注损伤的研究中,发现冠状血管内细胞色素P-450催化AA的代谢产物20-HETE生成明显增加,表明20-HETE参与心肌缺血再灌注进程中,但其作用机制尚未完全阐明。大量的研究表明活性氧簇(ROS)是引起心肌缺血再灌注的主要启动因子[7-8],但在心肌缺血再灌注中ROS被激活及生成的分子机制尚待深入研究。因此,本研究的目的是在大鼠离体心脏上探究心肌缺血再灌注中20-HETE对心肌功能及ROS生成的影响,探究20-HETE加重心肌缺血再灌注的可能机制。
1 材料与方法
1.1 实验动物分组及试剂 雄性Wistar大鼠(220±20)g 60只,缺血再灌注对照组为A组,缺血再灌注+HET0016(20-HETE合成酶抑制剂)组为B组、缺血再灌注+20-HETE(10、30、50nmol/L)组为C、D、E组,每组12只。20-HETE购于美国Sigma-Aldrich公司,HET0016购于美国Cayman公司;ROS检测试剂盒及蛋白质过氧化检测试剂盒购于南京建成生物制品公司;全蛋白提取试剂盒购于上海生工生物工程有限公司;BCA蛋白浓度检测试剂盒购于北京鼎国昌盛生物技术有限责任公司;肌酸激酶(CK)检测试剂盒购于四川迈克科技有限公司。
1.2 方法
1.2.1 建立模型 大鼠麻醉后,开胸取出心脏置于4℃ KH液中修剪,迅速将主动脉套管后置于Langendorff心肌灌流系统上,37℃下使用 KH 液(NaCl 118.0mmol/L,NaHCO325.0 mmol/L,KCl 4.7mmol/L,KH2PO41.2mmol/L,MgSO4·7H2O 1.2mmol/L,CaCl22.0mmol/L,葡萄糖11.0mmol/L)进行主动脉逆行灌流。大鼠左心室插入一个充水小球囊,另一端连接到压力传感器监测心室内压变化。使用Powerlab/8P系统连续记录左心室发展压(LVDP),左心室舒张末期压(LVEDP),左心室最大收缩速率、最大舒张速率(±dp/dtmax)。定时收集灌流液测定冠状动脉流量(CF),并使用日立HITACHI 7060全自动化分析仪(DGKC法)检测CK水平。
1.2.2 心肌缺血再灌注实施方案 37℃条件下,离体心脏缺血前灌流20min平衡,然后全心缺血35min,再灌注15min后检测ROS水平,或再灌注40min后用于检测生化指标,或再灌注120min用以检测心肌梗死面积。测定缺血前及再灌注后的左心室功能及血流动力学变化。
1.2.3 心肌梗死面积测定 心脏再灌注后,-20℃下冷冻1 h,切片(2~3mm)放入含有1%TTC的磷酸盐缓冲液中,37℃条件下孵育15min染色,10%甲醛固定。梗死区通过测定染色区域(红色,存活组织)和非染色区域(白色,坏死组织)面积占全部左心室面积比值后进行比较。
1.2.4 心肌ROS水平测定 ROS的生成使用对氧敏感的荧光探针DHE法测定,离体心脏再灌注15min后,剪成小块(100mm3)置入组织包埋剂中,液氮冷冻,冰冻切片(10μm)后置于载玻片上,然后将切片在PBS缓冲液中使用DHE(1.6 μmol/L)37℃避光孵育30min,激光共聚焦显微镜下在488 nm激发光,560~660nm滤波接收,获取荧光照片。
1.2.5 蛋白质过氧化水平检测 蛋白质羰基的产生是蛋白质分子被自由基氧化修饰的重要标记,羰基的水平基于羰基与2,4-二硝基苯肼(DNPH)反应生成二硝基苯腙进行测定,心脏再灌注后,提取心肌组织蛋白(1mg/mL),100μL加入500μL DNPH(10mmol/L)室温孵育60min,20%三氯乙酸沉淀蛋白,蛋白沉淀物使用1∶1乙醇和乙酸乙酯洗脱3次后,使用6 mol的盐酸胍重悬浮蛋白,370nm下检测吸光度。
1.3 统计学处理 使用SPSS15.0软件分析数据,计量资料采用x±s表示,组间比较采用单因素方差分析及t检验方法,P<0.05为差异有统计学意义。
2 结 果
2.1 20-HETE对缺血再灌注后心肌力学的影响 离体心脏灌流平衡20min,全心缺血35min,再灌注40min,应用Powerlab/8P系统连续实时记录各组心脏血流动力学功能改变,再灌注末期各组心脏心肌收缩力均明显下降,如图1A所示。在心肌缺血再灌注进程中,当使用HET0016减少内源性20-HETE生成后,显著改善了再灌注后心脏血流动力学指标的恢复,其中 LVDP由 A 组(48.6±3.4)%升高至(71.6±3.5)%,LVEDP由(41.8±3.3)%降低至(32.1±4.5)%,而±dP/dtmax分别由(51.9±2.1)%恢复至(69.0±3.2)%及(47.1±3.6)%升至(64.1±3.7)%。而外源性加入20-HETE后,剂量依赖性地加重了缺血再灌注诱导的心肌血流动力学指标的下降,其中E组心肌血流动力学指标显著下降(P<0.05);LVDP由 A组(48.6±3.4)%下降至(24.1±7.4)%,LVEDP由(41.8±3.3)%升至(76.0±4.7)%,±dP/dtmax分别由(51.9±2.1)%降至(29.2±6.3)%及(47.1±3.6)%降至(26.2±7.9)%,见图1B~D。
2.2 20-HETE对缺血再灌注后CF及CK释放的影响 再灌注末期与A组比较,B组心脏的CF由(6.0±1.1)mL/min升至(8.2±1.3)mL/min,CK 由(331.0±12.0)U/L 降低至(198.7±11.2)U/L,差异有统计学意义(P<0.05)。E组CF由(6.0±1.1)mL/min降低至(4.5±0.7)mL/min,CK 由(331.0±12.0)U/L升至(660.0±21.0)U/L,见图2。
2.3 20-HETE对缺血再灌注后心肌梗死面积的影响 离体心脏灌流20min,然后全心缺血35min,再灌注120min后,通过TTC染色法检测心肌梗死面积。与A组比较,B组心脏的梗死面积显著减少(P<0.05),由(39.8±2.3)% 降低至(29.6±2.4)%。而外源性加入20-HETE各组,剂量依赖性地增加了再灌注后心肌梗死面积(P<0.05),其中E组心肌梗死面积达到了(58.1±4.1)%,见图3。
2.4 20-HETE对缺血再灌注后心肌组织ROS生成的影响
B组荧光强度为72.0±5.1明显低于A组的105.0±3.5,而E组的荧光强度为145.0±7.3显著高于 A组(P<0.05),见图4。
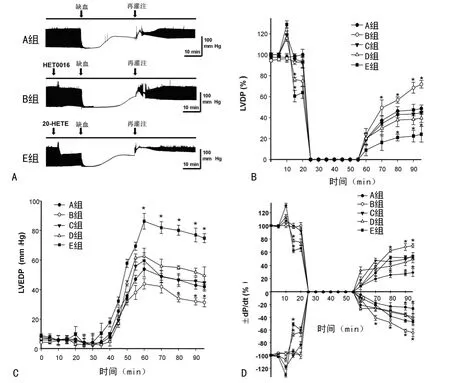
图1 20-HETE对心肌缺血再灌注后心肌力学的影响
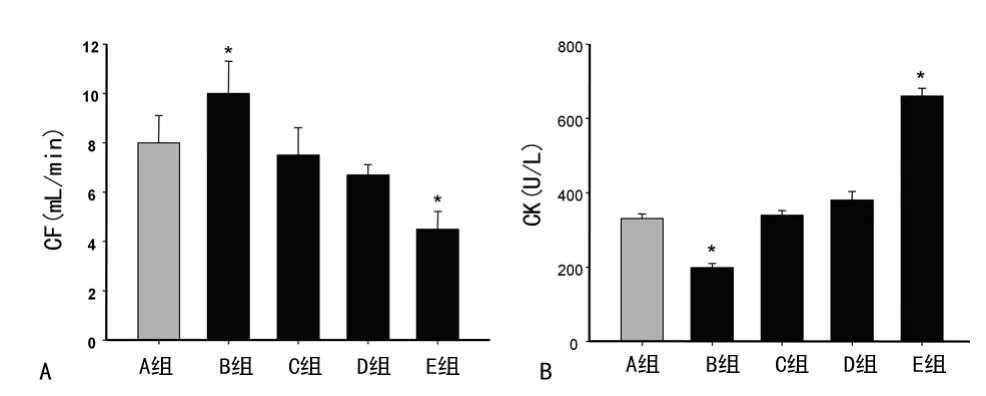
图2 20-HETE对缺血再灌注后CF及CK释放的影响
2.5 20-HETE对缺血再灌注后心肌组织蛋白质过氧化的影响 与A组相比,使用HET0016处理后降低了蛋白质的羰基化作用(P<0.05),E组则显著增强了蛋白质的羰基化作用(P<0.05),见图5。

图3 20-HETE对再灌注后心肌梗死面积的影响
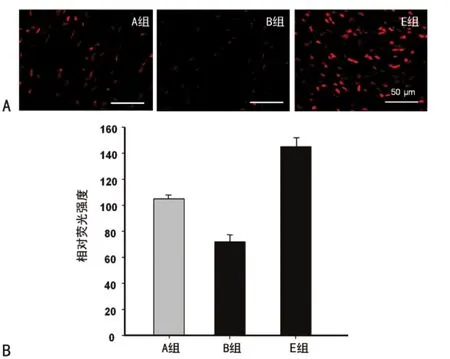
图4 20-HETE对再灌注后心肌组织ROS生成的影响
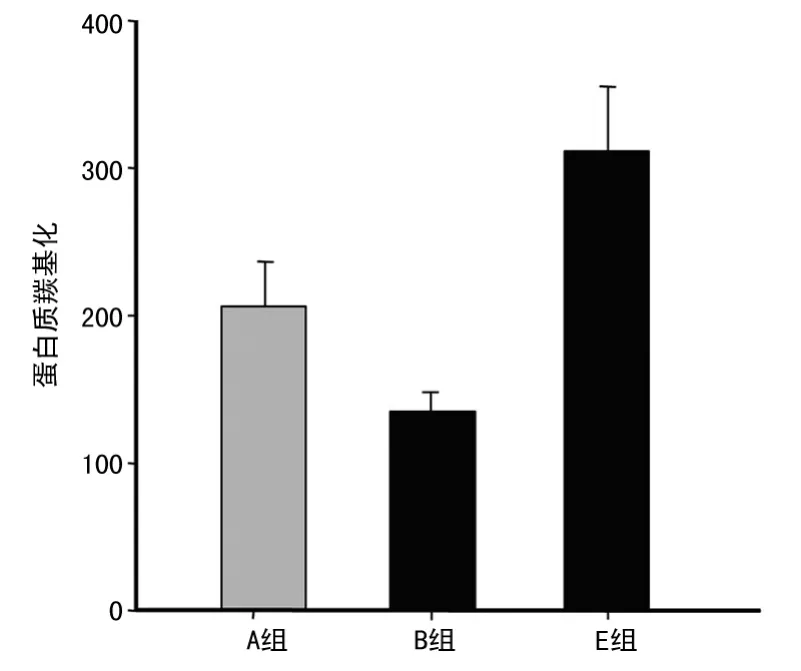
图5 20-HETE对再灌注后心肌组织蛋白质羰基化作用
3 讨 论
经皮冠状动脉腔内成形术和冠状动脉内支架是临床治疗急性心肌梗死常用的治疗手段[9],但是缺血一定时间的心肌组织在恢复血液灌注后,却伴发严重心律失常和心肌功能紊乱,甚至导致致命性的并发症,即缺血再灌注损伤[10-11],如何减轻缺血再灌注导致的心肌损伤是临床治疗缺血性心肌病的重要问题。
有研究报道发现20-HETE参与了肾和脑缺血导致的损伤[12-13],在心肌缺血再灌注损伤中也有研究发现 20-HETE水平明显增加,心肌组织中CYP450ω-羟化酶表达和活性显著增强[5-6],表明20-HETE参与到了心肌缺血再灌注损伤当中,但机制尚不清楚。本研究发现,在心肌缺血再灌注损伤进程中,应用HET0016来减少内源性20-HETE生成后,改善了由于缺血再灌注导致的心肌功能下降,再灌注结束时与A组相比,LVDP、+dP/dt、-dP/dt分 别 升 高 了 47.3%、32.9% 和36.0%,CF增加了36.7%,LVEDP降低了23.2%,同时减少了CK释放40.0%,并降低了心肌梗死面积34.5%。而外源性20-HETE(50nmol/L)显著降低了缺血后心肌功能的恢复,与A组相比,LVDP、+dP/dt、-dP/dt分别降低了50.4%、43.7%和44.4%,CF减少了25.0%,LVEDP升高了81.8%,同时增加了CK释放99.4%,并导致心肌梗死面积增加了46.0%。这些数据明确表明20-HETE具有加重心肌缺血再灌注损伤的作用,这与之前的学者研究一致。然而,20-HETE加重心肌缺血再灌注损伤、降低心肌功能的机制尚需进一步探究。
ROS在心肌缺血再灌注损伤的发病机理中起到至关重要的作用,减少ROS的生成可显著改善缺血再灌注后心肌功能的恢复,减少心肌梗死面积[14],被认为是引起缺血再灌注损伤的主要启动因子[7-8],而由于心脏中缺乏抗氧化酶,对于ROS的敏感性要高于其他组织器官。另外,有研究表明在肝细胞中CYP450可促进ROS生成,参与多种疾病的发生,如帕金森疾病、糖尿病等[15]。因此,作者首先检测了在心肌缺血再灌注损伤进程中CYP450酶代谢产物20-HETE对ROS生成的影响,发现当应用HET0016选择性抑制CYP450酶家族中CYP4A和4F的ω羟基化作用[16],减少内源性20-HETE的合成后,与A组相比,B组心脏再灌注后ROS的生成减少了31.4%,而外源性加入20-HETE(50nmol/L)心脏中 ROS生成增加了38.0%,表明在心肌缺血再灌注损伤中20-HETE有明显的促进ROS过量生成的作用。
心肌细胞内过量的ROS可以损伤亚细胞组分,并造成蛋白质过氧化损伤。有研究发现心肌缺血后与心肌收缩相关的肌钙蛋白[17]及肌动蛋白[18]均发生过氧化损伤,影响缺血后的心肌的功能。其他相关研究也支持该结论,在不同的生理病理条件下,过量生成的ROS可导致心肌收缩功能的紊乱。ROS可使蛋白质赖氨酸、精氨酸、脯氨酸等残基氧化生成羰基化蛋白产物[19],而蛋白羰基化水平是反应ROS介导的蛋白氧化损伤的主要检测指标[20]。所以本研究接下来检测了再灌注后心肌细胞内蛋白质羰基化水平的改变,研究发现与A组心脏相比,再灌注后B组心脏中蛋白质羰基化水平降低了34.7%,而外源性加入20-HETE(50nmol/L)中蛋白质羰基化水平显著升高51.1%。如上研究结果表明在心肌缺血再灌注损伤进程中,20-HETE通过促进ROS的生成增多,导致蛋白质过氧化损伤,最终加重心肌再灌注后的功能损伤。
综上研究,作者发现在心肌缺血再灌注损伤进程中,抑制内源性20-HETE的生成可明显改善心肌功能的恢复和减少梗死面积的发生,而外源性加入20-HETE则显著加重再灌注后的心肌损伤,其机制是在该进程中20-HETE诱导过量ROS的生成,导致收缩相关蛋白氧化损伤,为临床治疗缺血性心肌病提供了一定的理论依据。
[1] Capdevila J,Chacos N,Werringloer J,et al.Liver microsomal cytochrome P-450and the oxidative metabolism of arachidonic acid[J].Proc Natl Acad Sci U S A,1981,78(9):5362-5366.
[2] Wu CC,Gupta T,Garcia V,et al.20-HETE and blood pressure regulation:clinical implications[J].Cardiol Rev,2014,22(1):1-12.
[3] Ding Y,Wu CC,Garcia V,et al.20-HETE induces remodeling of renal resistance arteries independent of blood pressure elevation in hypertension[J].Am J Physiol Renal Physiol,2013,305(5):F753-763.
[4] Harder DR,Narayanan J,Gebremedhin D.Pressure-induced myogenic tone and role of 20-HETE in mediating autoregulation of cerebral blood flow [J].Am J Physiol Heart Circ Physiol,2011,300(5):H1557-1565.
[5] Nithipatikom K,Endsley MP,Moore JM,et al.Effects of selective inhibition of cytochrome P-450omega-hydroxylases and ischemic preconditioning in myocardial protection[J].Am J Physiol Heart Circ Physiol,2006,290(2):H500-505.
[6] Granville DJ,Tashakkor B,Takeuchi C,et al.Reduction of ischemia and reperfusion-induced myocardial damage by cytochrome P450inhibitors[J].Proc Natl Acad Sci U S A,2004,101(5):1321-1326.
[7] Schriewer JM,Peek CB,Bass J,et al.ROS-mediated PARP activity undermines mitochondrial function after permeability transition pore opening during myocardial ischemia-reperfusion[J].J Am Heart Assoc,2013,2(2):e000159.
[8] Seligmann C,Prechtl G,Kusus-Seligmann M,et al.A myocardial ischemia-and reperfusion-induced injury is mediated by reactive oxygen species released from blood platelets[J].Platelets,2013,24(1):37-43.
[9] Keeley EC,Boura JA,Grines CL.Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction:aquantitative review of 23randomised trials[J].Lancet,2003,361(9351):13-20.
[10]Garcia-Dorado D,Rodriguez-Sinovas A,Ruiz-Meana M,et al.Protection against myocardial ischemia-reperfusion in-jury in clinical practice[J].Rev Esp Cardiol(Engl Ed),2014,67(5):394-404.
[11]Hausenloy DJ,Yellon DM.Myocardial ischemia-reperfusion injury:a neglected therapeutic target[J].J Clin Invest,2013,123(1):92-100.
[12]Hoff U,Lukitsch I,Chaykovska L,et al.Inhibition of 20-HETE synthesis and action protects the kidney from ischemia/reperfusion injury [J].Kidney Int,2011,79(1):57-65.
[13]Marumo T,Eto K,Wake H,et al.The inhibitor of 20-HETE synthesis,TS-011,improves cerebral microcirculatory autoregulation impaired by middle cerebral artery occlusion in mice [J].Br J Pharmacol,2010,161(6):1391-1402.
[14]Perrelli MG,Pagliaro P,Penna C.Ischemia/reperfusion injury and cardioprotective mechanisms:Role of mitochondria and reactive oxygen species[J].World J Cardiol,2011,3(6):186-200.
[15]Shahabi HN,Andersson DR,Nissbrandt H.Cytochrome P450 2E1in the substantia nigra:relevance for dopaminergic neurotransmission and free radical production[J].Synapse,2008,62(5):379-388.
[16]Miyata N,Taniguchi K,Seki T,et al.HET0016,apotent and selective inhibitor of 20-HETE synthesizing enzyme[J].Br J Pharmacol,2001,133(3):325-329.
[17]Murphy AM,Kogler H,Georgakopoulos D,et al.Transgenic mouse model of stunned myocardium [J].Science,2000,287(5452):488-491.
[18]Powell SR,Gurzenda EM,Wahezi SE.Actin is oxidized during myocardial ischemia [J].Free Radic Biol Med,2001,30(10):1171-1176.
[19]Al Ghouleh I,Khoo NK,Knaus UG,et al.Oxidases and peroxidases in cardiovascular and lung disease:new concepts in reactive oxygen species signaling[J].Free Radic Biol Med,2011,51(7):1271-1288.
[20]Pradeep AR,Ramchandraprasad MV,Bajaj P,et al.Protein carbonyl:An oxidative stress marker in gingival crevicular fluid in healthy,gingivitis,and chronic periodontitis subjects[J].Contemp Clin Dent,2013,4(1):27-31.
