盐酸普拉格雷固体分散体片的制备及体外溶出度考察
2015-03-08姜伟化王环宇吕欢欢王东凯
张 欢,姜伟化,王环宇,吕欢欢,王东凯
(沈阳药科大学 药学院,辽宁 沈阳 110016)
盐酸普拉格雷固体分散体片的制备及体外溶出度考察
张 欢,姜伟化,王环宇,吕欢欢,王东凯*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的制备盐酸普拉格雷固体分散体片,提高盐酸普拉格雷的溶出度。方法用溶剂法以不同载体制备固体分散体,采用差示扫描量热法(differential scanning calorimeter,DSC)、X射线衍射法(X-ray diffraction,XRD)对制得的固体分散体进行表征;进一步制备固体分散体片,通过正交试验优化处方;并在3种溶出介质中对固体分散体片进行体外溶出度的考察。结果选择聚维酮 K30(povidone K30,PVP K30)为载体材料,药物与载体的质量比为1∶5;盐酸普拉格雷在固体分散体中以非结晶形式存在;在3种溶出介质中,制备的固体分散体片的溶出速度均明显高于自制普通片和市售片。结论制备的盐酸普拉格雷固体分散体片能够显著提高盐酸普拉格雷的溶出速度,且制备方法简单可行。
药剂学;固体分散体;溶剂法;盐酸普拉格雷;片剂;溶出度
盐酸普拉格雷(prasugrel hydrochloride)是由美国礼来公司与日本第一三共制药公司共同研制的噻吩吡啶类第三代抗血小板药。欧盟和日本于2009年2月批准盐酸普拉格雷片(Efient®)上市,美国食品药品监督管理局(FDA)于2009年7月9日批准盐酸普拉格雷片(Effient®)上市[1]。目前文献对于盐酸普拉格雷的报道主要是关于药物合成[2-3]、药物分析[4]、新药述评[5]。盐酸普拉格雷属于难溶性的生物药剂学分类系统(biopharmaceutics classification system,BCS)Ⅱ类药物,药物的溶出是吸收的限速过程。固体分散体(solid dispersion,SD)是指将药物高度分散于固体载体中形成的一种以固体形式存在的分散系统,可以增加难溶性药物的溶出,提高其生物利用度[6-7]。本文作者将盐酸普拉格雷与载体材料溶于无水乙醇中,采用溶剂法,使药物以非结晶形式高度分散于载体中,从而提高药物的溶出速度,以期提高其生物利用度。
1 仪器与材料
DZF-6020 真空干燥箱(巩义市予华仪器有限责任公司),LC-20 AT高效液相色谱仪(日本Shimadzu公司),754CP 紫外可见分光光度计(上海光谱仪器有限公司),DSC-60自动差示扫描量热仪(日本Shimadzu公司),X-射线衍射仪(日本Rigaku公司),DP30A 单冲压片机(北京国药龙立科技有限公司),CJY-2C 片剂脆碎硬度测定仪(上海黄海药检仪器有限公司),Mini-CG 1/8高速混合快速制粒机(常州杰贝机电设备有限公司),DRC-200高效包衣机(日本POWREX公司),RC-6 溶出度测定仪(天津国铭医药设备有限公司)。
普拉格雷对照品(含量质量分数为100%,美国Sigma公司,批号 052M4702V),盐酸普拉格雷原料药(含量质量分数为99.8%,沈阳沃森药物研究所,批号 20140714),盐酸普拉格雷片(商品名为Efient®,规格:以普拉格雷计10 mg,美国Lilly公司,批号 C182732),乙腈(色谱纯,美国Sigma公司),其他试剂(分析纯,市售),水为纯化水。
2 方法与结果
2.1 盐酸普拉格雷体外溶出度测定方法的建立
2.1.1 最大吸收波长的确定
精密称取普拉格雷对照品11.00 mg,置100 mL量瓶中,加乙腈2 mL超声溶解后,用溶出介质pH值4.0柠檬酸-磷酸氢二钠(柠檬酸23 mmol·L-1,磷酸氢二钠26 mmol·L-1)缓冲液稀释至刻度,摇匀,作为普拉格雷对照储备液;精密移取普拉格雷对照储备液1.0 mL,置10 mL量瓶中,用pH值4.0柠檬酸-磷酸氢二钠缓冲液稀释至刻度。按处方比例,配制相应质量浓度的空白辅料溶液。分别进行紫外-可见光扫描。
结果表明,普拉格雷在波长220 nm处有最大吸收,因此,选择220 nm作为普拉格雷在溶出介质pH值4.0柠檬酸-磷酸氢二钠缓冲液中的检测波长。
2.1.2 色谱条件
色谱柱:Dikma C18柱(150 mm×4.6 mm,5 μm);流动相:乙腈-乙酸铵溶液(称取乙酸铵1.54 g,加入400 mL水中,用冰乙酸调节pH值至4.5,加入600 mL乙腈)体积比为2∶3;检测波长:220 nm;柱温:30 ℃;进样量:40 μL;流速:1.0 mL·min-1。
2.1.3 专属性试验
按处方比例配制除盐酸普拉格雷的空白辅料溶液,结果空白辅料不干扰盐酸普拉格雷的测定。
2.1.4 标准曲线的建立
分别精密移取“2.1.1”条的普拉格雷对照储备液0.6、1.2、1.8、2.4、3.0 mL,置10 mL量瓶中,用pH值4.0柠檬酸-磷酸氢二钠缓冲液稀释成系列质量浓度的待测溶液,分别精密量取上述溶液各40 μL 注入液相色谱仪,以峰面积的对数(y)为纵坐标,进样质量的对数(χ)为横坐标进行线性回归。结果表明:普拉格雷质量浓度在7.30~36.48 mg·L-1内具有良好的线性关系,线性方程为y = 36 440χ-13 289(r =0.999 7)。
2.1.5 溶液稳定性试验
精密移取“2.1.1”条的普拉格雷对照储备液1.0 mL,置10 mL量瓶中,用pH值4.0柠檬酸-磷酸氢二钠缓冲液稀释至刻度,摇匀,作为供试溶液。将供试溶液室温放置,分别于0、1、2、4、6和8 h 精密量取40 μL 注入液相色谱仪,测得含量的RSD为0.29%(n=6),表明供试溶液在室温放置8 h内稳定性良好。
2.1.6 溶出度的测定
参考美国食品药品监督管理局(FDA)公布的盐酸普拉格雷片溶出方法和《中华人民共和国药典》2010 版二部附录ⅩC第二法[8]。取本品,以pH值4.0柠檬酸-磷酸氢二钠缓冲液900 mL(柠檬酸23 mmol·L-1,磷酸氢二钠26 mmol·L-1)为溶出介质,转速为75 r·min-1,依法操作,分别于5、10、15、20、30、45 min取样10 mL,并补充等量溶出介质,样品用0.45 μm滤膜过滤,取续滤液,分别取40 μL注入液相色谱仪,记录峰面积;另精密称取普拉格雷对照品适量,加少量乙腈超声溶解,用pH值4.0柠檬酸-磷酸氢二钠缓冲液定量稀释成质量浓度约为11.00 mg·L-1的普拉格雷对照溶液,取40 μL注入液相色谱仪,记录峰面积;以外标一点法计算各时间点的累积溶出度。
2.2 盐酸普拉格雷固体分散体的制备
2.2.1 溶剂法制备盐酸普拉格雷固体分散体
精密称取适量盐酸普拉格雷和载体材料,分别过154 μm筛,超声溶解于适量无水乙醇中,置50 ℃旋转蒸发仪上减压蒸发除尽乙醇,于45 ℃真空干燥箱中干燥24 h后置干燥器中平衡24 h,粉碎过154 μm筛,得盐酸普拉格雷固体分散体。
2.2.2 载体种类的考察
参考相关文献[9],分别以常用载体材料泊洛沙姆188(Poloxamer 188)、聚维酮K30(povidone K30,PVP K30)和聚乙二醇6000(polyethylene glycol 6000,PEG 6000)为考察对象,用“2.2.1”条方法分别制备盐酸普拉格雷固体分散体,暂定药物与载体质量比为1∶5,按“2.1.6”条所述方法分别测定盐酸普拉格雷固体分散体和盐酸普拉格雷原料药在pH值4.0柠檬酸-磷酸盐缓冲液中的累积溶出度,图1为相应的累积溶出曲线。
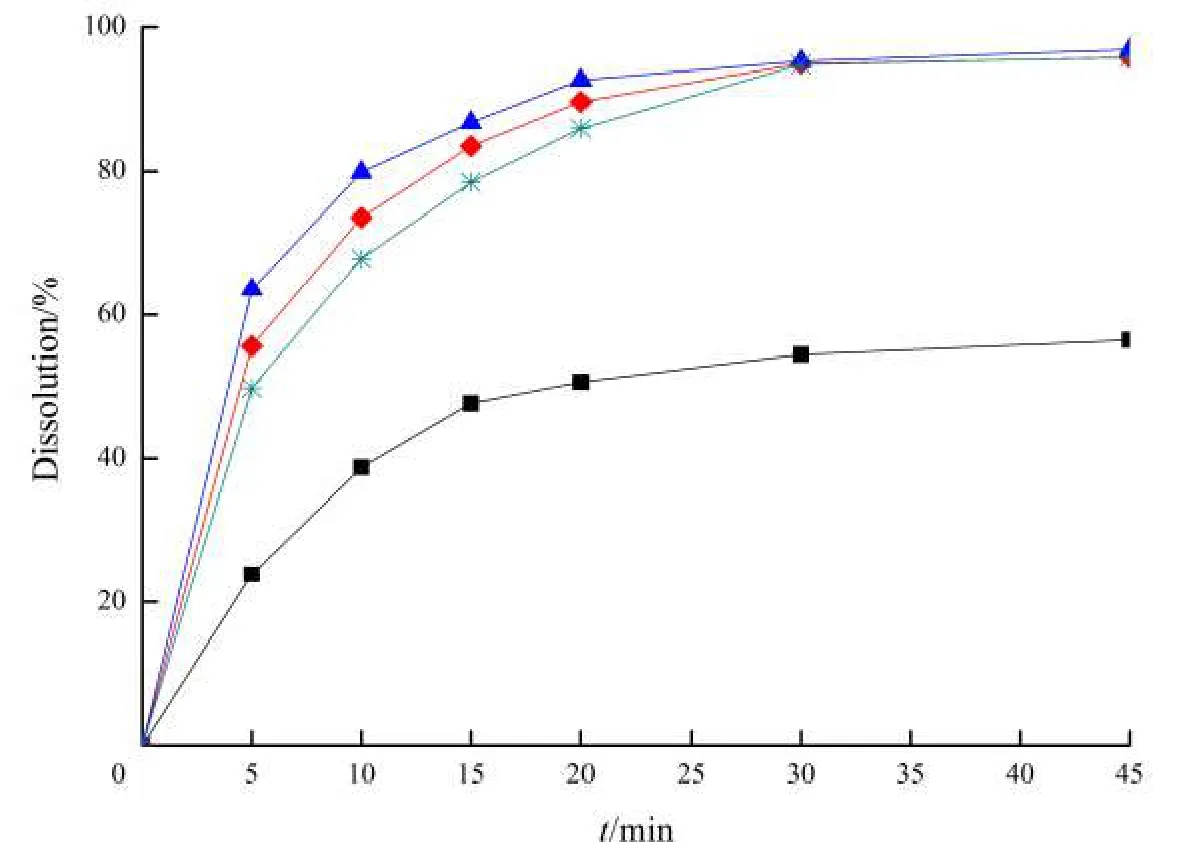
■—Prasugrel hydrochloride;*—Prasugrel hydrochloride -PEG 6000;◆—Prasugrel hydrochloride -Poloxamer 188;▲—Prasugrel hydrochloride -PVP K30Fig. 1 Dissolution profiles of prasugel hydrochloride solid dispersions with different carriers and pure prasugel hydrochloride in pH4.0 citrate-PBS图1 盐酸普拉格雷和不同载体制备的盐酸普拉格雷固体分散体在pH值4.0柠檬酸-磷酸盐缓冲液中的溶出度
由图1可知,盐酸普拉格雷在以不同载体制备的固体分散体中的溶出速度和溶出百分率均大于其原料药;以三种载体材料制备的固体分散体中,盐酸普拉格雷的溶出速度为:PVP K30>Poloxamer 188 >PEG 6000,表明以PVP K30为载体制备的固体分散体对增加盐酸普拉格雷溶出度的效果最明显。
2.2.3 载体比例的考察
以PVP K30为载体,盐酸普拉格雷-PVP K30质量比分别为1∶1、1∶3、1∶4、1∶5,按“2.2.1”条方法分别制备盐酸普拉格雷-PVP K30固体分散体,按“2.1.6”条方法分别测定制备的固体分散体、物理混合物(盐酸普拉格雷-PVP K30质量比为1∶5)和盐酸普拉格雷原料药在pH值4.0柠檬酸-磷酸盐缓冲液中的累积溶出度,图2为相应的累积溶出曲线。
■—Prasugrel hydrochloride;▲—Physical mixture;◆—m(prasugrel hydrochloride):m(PVP K30)=1∶1;*—m(prasugrel hydrochloride)∶m(PVP K30)=1∶3;×—m(prasugrel hydrochloride)∶m(PVP K30)=1∶4;★—m(prasugrel hydrochloride)∶m(PVP K30)=1∶5Fig. 2 Dissolution profiles of prasugel hydrochloride solid dispersions with different proportions of PVP K30 andpure prasugel hydrochloride in pH4.0 citrate-PBS图2 盐酸普拉格雷和不同比例PVP K30制备的盐酸普拉格雷固体分散体在pH值4.0柠檬酸-磷酸盐缓冲液中的溶出度
由图2可知,以PVP K30为载体,不同药物载体比例制备的固体分散体中,盐酸普拉格雷的溶出速度和溶出百分率均大于其物理混合物和原料药,盐酸普拉格雷-PVP K30质量比为1∶5时,溶出速度和溶出百分率最大,因此确定盐酸普拉格雷-PVP K30固体分散体药物载体的质量比为1∶5。
综上,以PVP K30为载体,且药物与载体质量比为1∶5,用溶剂法制备盐酸普拉格雷固体分散体。
2.3 盐酸普拉格雷-PVP K30固体分散体的表征
2.3.1 差示扫描量热法(differential scanning calorimetry,DSC)
测试条件:以空铝钳锅为参比物,另一铝锅中放入约3 mg样品,升温速率10 ℃·min-1,扫描范围为30~250 ℃。分别测定PVP K30、盐酸普拉格雷、处方比例的物理混合物和固体分散体的DSC图谱,结果见图3。
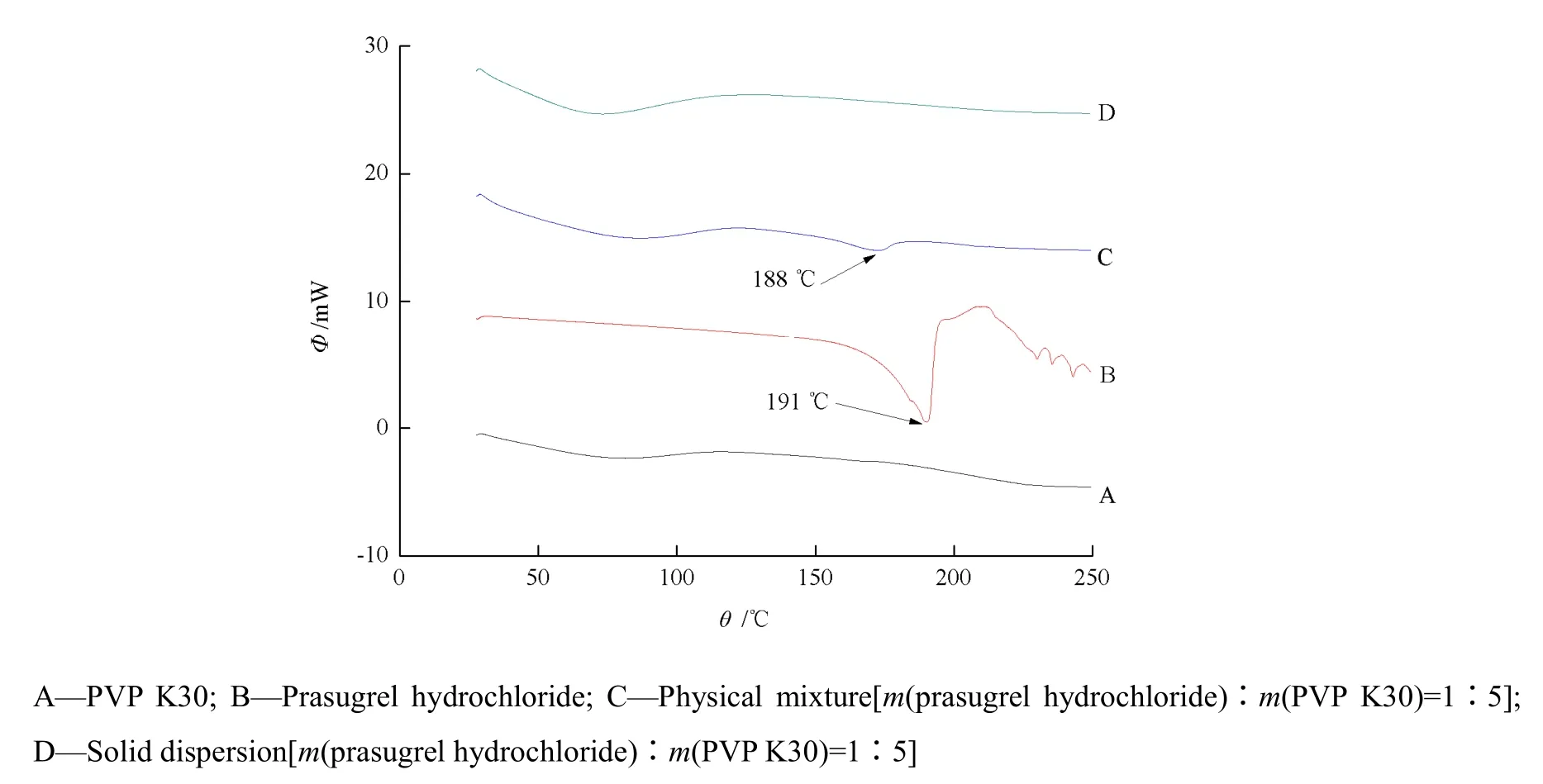
Fig. 3 DSC thermograms of the samples图3 样品的DSC图谱
由图3可知,物理混合物中的吸热峰与盐酸普拉格雷中的吸热峰相比,强度与位置并未发生明显的变化,说明在物理混合物中盐酸普拉格雷与PVP K 30并未发生本质上的作用,盐酸普拉格雷仍以晶体形式存在;而固体分散体中盐酸普拉格雷的吸热峰消失,由此说明盐酸普拉格雷与PVP K 30发生相互作用,盐酸普拉格雷主要以非结晶形式存在于固体分散体中。
2.3.2 X-射线衍射法(X-ray diffraction,XRD)
测试条件:铜靶,加速电压为40 kV,加速电流为40 mA,衍射角(2θ)4°·min-1,扫描范围为0~50°。将PVP K30、处方比例的物理混合物、盐酸普拉格雷和固体分散体分别进行X-射线衍射分析,结果见图4。
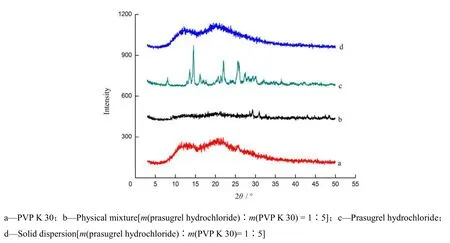
Fig. 4 X-ray diffraction spectra of the samples图4 样品的XRD 图
由图4可知,盐酸普拉格雷在2θ为13° ~ 26°内有明显的晶体衍射峰。物理混合物衍射峰强度明显减弱,可能由于PVP K30对盐酸普拉格雷具有物理包埋作用;但在2θ为29°和31°处仍可见较弱的晶体衍射峰,表明药物在物理混合物中仍以晶体形式存在。固体分散体在2θ为13.6°、14.6°、16.2°、22.0°、25.7°和25.9°的特征衍射峰都消失。X-射线衍射结果表明,盐酸普拉格雷在固体分散体中以非结晶形式存在,与DSC结果一致。
2.4 盐酸普拉格雷片的制备
2.4.1 盐酸普拉格雷-PVP K30固体分散体片的处方优化
经过预实验进行单因素初步考察,包括稀释剂种类、崩解剂种类、片剂硬度、制备方法,按“2.1.6”条所述方法测定制备的盐酸普拉格雷-PVP K30固体分散体片在pH值4.0柠檬酸-磷酸氢二钠(柠檬酸23 mmol·L-1,磷酸氢二钠26 mmol·L-1)缓冲液中的溶出度,以溶出度为主要评价指标,对自制制剂在溶出介质中的溶出行为进行考察。最终选择微晶纤维素(microcrystalline cellulose,MCC)为稀释剂,交联羧甲基纤维素钠(croscarmellose sodium,CCNa)为崩解剂;选择高速混合快速制粒机进行物料混合,粉末直接压片法进行压片,压片压力为0.9~1.2 MPa,用薄膜包衣预混剂(商品名“欧巴代®”)包薄膜衣,制得盐酸普拉格雷固体分散体片。确定影响盐酸普拉格雷固体分散体片溶出度的主要因素为稀释剂、崩解剂和润滑剂的比例,采用正交试验,对稀释剂MCC[因素A:w(MCC)/%]、润滑剂硬脂酸镁[因素B:w(magnesium stearate)/%]和崩解剂CCNa[因素C:w(CCNa)/%]的比例进行正交试验设计L9(34),进一步筛选出最优处方。正交试验各因素及水平见表1。

Table 1 L9(34) Factors and levels of orthogonal design表 1 正交设计因素与水平

Table 2 The result of orthogonal test表 2 正交试验结果
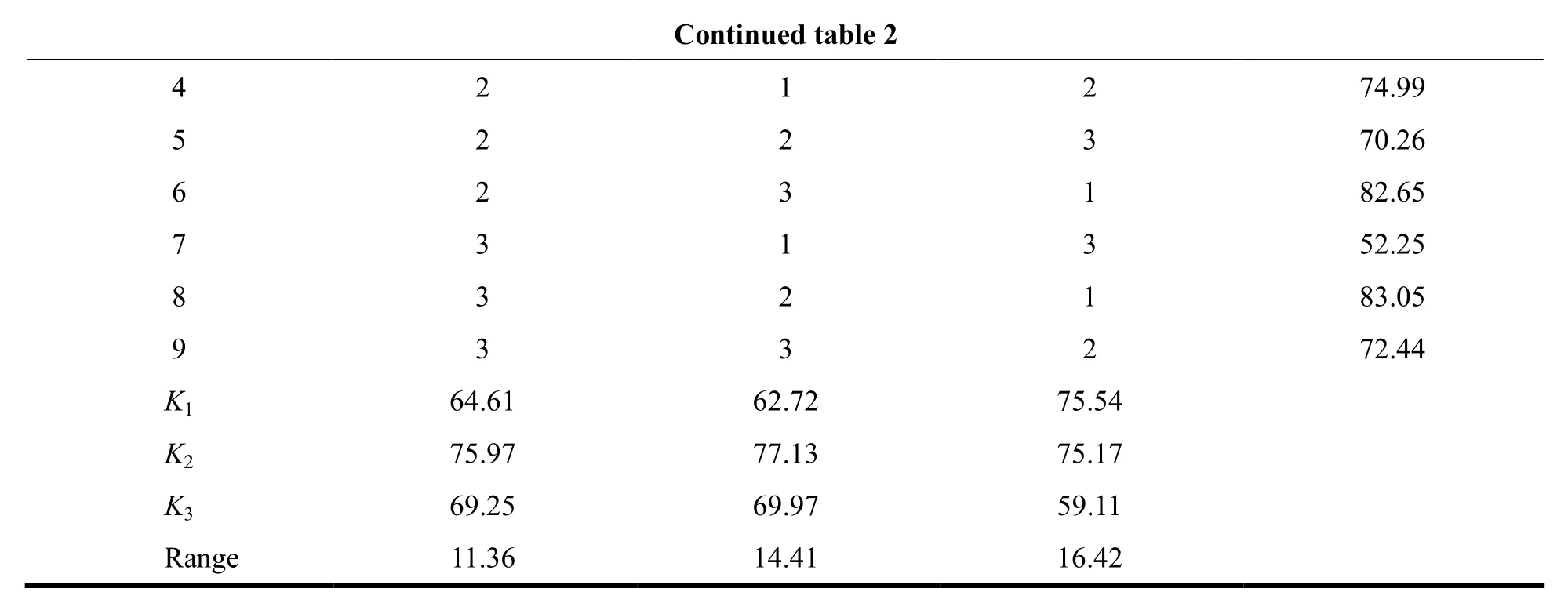
Continued table 2 4 2 1 2 74.99 5 2 2 3 70.26 6 2 3 1 82.65 7 3 1 3 52.25 8 3 2 1 83.05 9 3 3 2 72.44 K1 64.61 62.72 75.54 K2 75.97 77.13 75.17 K3 69.25 69.97 59.11 Range 11.36 14.41 16.42
由表 2的极差可知,各因素对盐酸普拉格雷固体分散体片溶出度的影响顺序为 C>B>A,即w(CCNa)>w(硬脂酸镁)>w(MCC)。各因素的最佳组合为A2B2C1,即稀释剂MCC用量质量分数为50%,润滑剂硬脂酸镁用量质量分数为0.7%,崩解剂CCNa用量质量分数为5%。
综上,最终确定盐酸普拉格雷固体分散体片的处方工艺为:精密称取盐酸普拉格雷-PVP K30固体分散体65.88 g、MCC 90.00 g、羟丙甲纤维素(hypromellose,HPMC) 13.86 g、CCNa 9.00 g、硬脂酸镁1.26 g,分别过154 μm筛,用高速混合快速制粒机进行物料混合,粉末直接压片法进行压片,压片压力为0.9~1.2 MPa,素片质量为0.18 g,用薄膜包衣预混剂(商品名“欧巴代®”)包薄膜衣,制得盐酸普拉格雷-PVP K30固体分散体片,每片含盐酸普拉格雷10.98 mg(以普拉格雷计10 mg)。
2.4.2 盐酸普拉格雷普通片的制备
按照盐酸普拉格雷固体分散体片中药物辅料的比例,精密称取盐酸普拉格雷10.98 g、PVP K30 54.90 g、MCC 90.00 g、HPMC 13.86 g、CCNa 9.00 g、硬脂酸镁1.26 g,分别过154 μm筛,用高速混合快速制粒机进行物料混合,粉末直接压片法进行压片,压片压力为0.9~1.2 MPa,素片质量为0.18 g,用薄膜包衣预混剂(商品名“欧巴代®”)包薄膜衣,制得盐酸普拉格雷普通片,每片含盐酸普拉格雷10.98 mg(以普拉格雷计10 mg)。
2.5 盐酸普拉格雷片在不同溶出介质中溶出度的测定
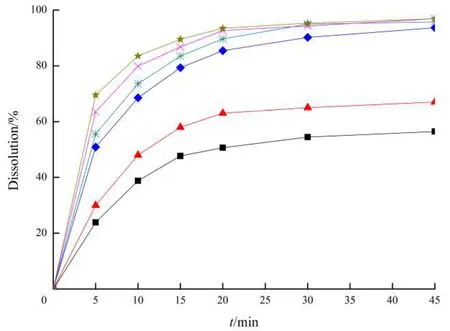
取盐酸普拉格雷市售片(Efient®)、制备的固体分散体片和普通片,分别以pH值4.0柠檬酸-磷酸氢二钠(柠檬酸23 mmol·L-1,磷酸氢二钠26 mmol·L-1)缓冲液、pH值6.8磷酸盐缓冲液、纯化水为溶出介质,按“2.1.6”条方法操作,分别测定盐酸普拉格雷市售片、自制固体分散体片和普通片在各取样时间点的累积溶出度,比较盐酸普拉格雷市售片、自制固体分散体片与自制普通片的溶出曲线。图5为盐酸普拉格雷市售片、自制固体分散体片和自制普通片在3种不同溶出介质中的溶出曲线图。
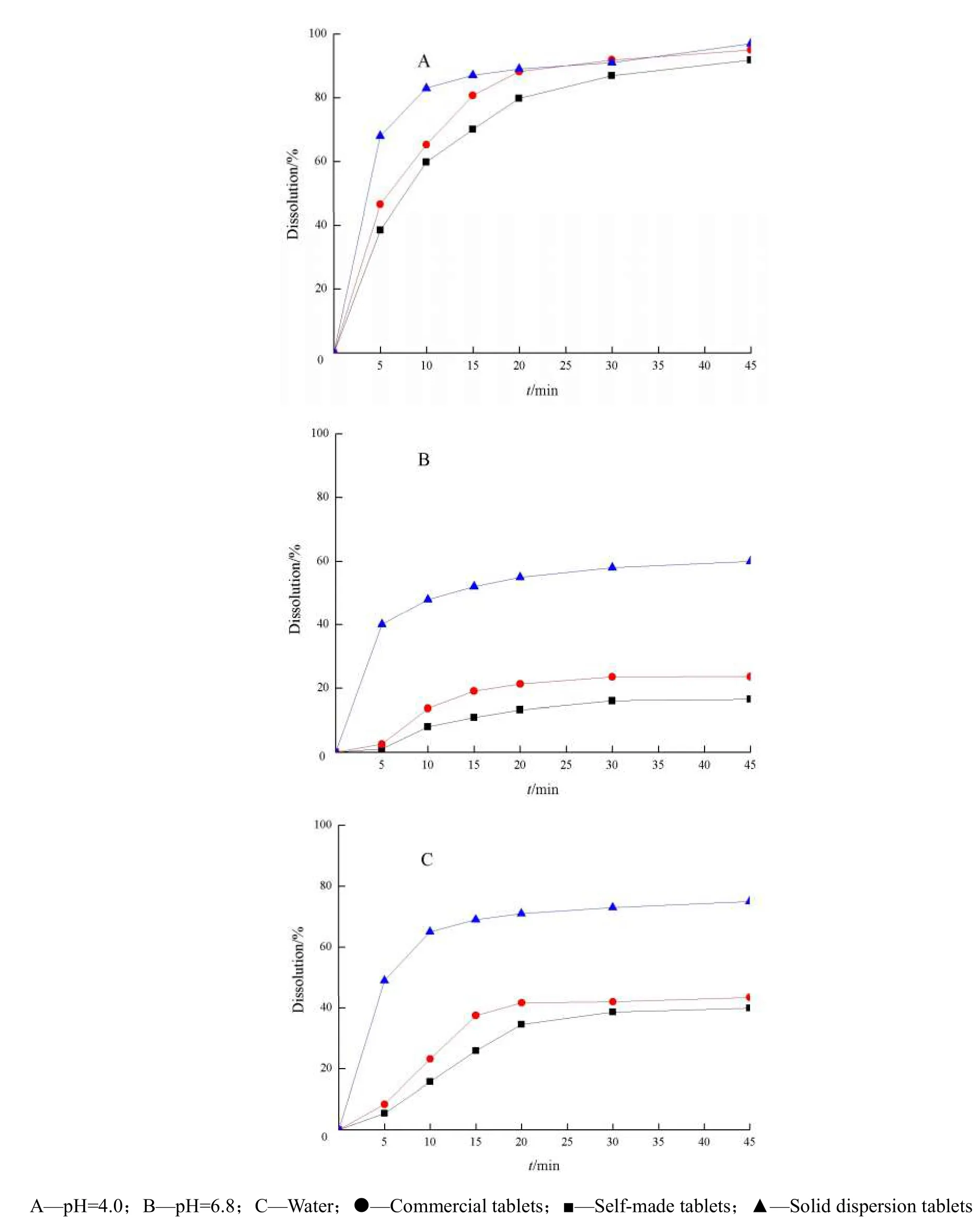
Fig. 5 Dissolution profiles of prasugel hydrochloride tablets in the media at different pH图5 盐酸普拉格雷片在不同pH值溶出介质中的溶出度
由图5可知,在pH值4.0柠檬酸-磷酸氢二钠(柠檬酸23 mmol·L-1,磷酸氢二钠26 mmol·L-1)缓冲液、pH值6.8磷酸盐缓冲液和纯化水中,自制固体分散体片的溶出速度均明显高于自制普通片和市售片;在溶出介质pH值6.8磷酸盐缓冲液和纯化水中,制备的固体分散体片中药物在45 min时的累积溶出度显著高于市售片。本文作者所制备的盐酸普拉格雷固体分散体片有效地提高了盐酸普拉格雷的溶出速度。
3 讨论
a. 盐酸普拉格雷为白色或类白色结晶性粉末。在甲醇、乙醇中易溶,在丙二醇和丙酮中微溶,在乙醚和乙酸乙酯中几乎不溶;在水中的溶解度具有pH依赖性,在pH值2.0溶液中溶解,在pH值3.0~4.0溶液中微溶,在pH值6.0~7.5溶液中几乎不溶;盐酸普拉格雷属于BCSⅡ类药物,药物的溶出是吸收的限速过程。因此,作者通过制备盐酸普拉格雷固体分散体片以提高药物的溶出速度,以期提高其生物利用度。
b. 载体PVP K 30为无定形物,在无水乙醇中以网状骨架结构存在,药物在PVP K 30中均匀分散,一方面能与药物形成分子间氢键从而抑制药物结晶[10];另一方面随着溶液黏度不断增加,抑制盐酸普拉格雷晶核的形成与成长,形成共沉淀物,盐酸普拉格雷以非结晶性形式存在。药物在制剂中的存在形式会影响药物的溶解度、溶出速率及生物利用度。无定型为无结晶结构的药物,无晶格束缚,自由能大,所以溶解速度较结晶型大[11]。一般以是否有药物晶型的存在来表征固体分散体的形成[12]。DSC和XRD结果显示,固体分散体中盐酸普拉格雷以非结晶形式存在,可能以无定形形态存在,从而提高药物的溶出速度。
c.本文作者采用溶剂法制备固体分散体,将固体分散体和辅料用高速剪切制粒机混合均匀,用粉末直接压片法压片,包衣后制得固体分散体片。制备方法简便易行,便于实现产业化。
[1] BAKER W L, WHITE C M. Role of prasugel a novel P2Y(12) receptor antagonist, in the management of acute coronary syndromes[J]. Am J Cardiovasc Drugs, 2009, 9(4): 213-229.
[2] SRIMIVAS R, JALINDAR J, SRINIVAS G, et al. Process for the preparation of 2-acetoxy(α-cycloprpylcarbonyl-2-fluorobenzyl)-4, 5, 6, 7-tetrahydrothieno[3, 2-c]pyridine: WO, 2009122440[P]. 2009-10-08.
[3] AALLA S, GILLA G, SHAMRAO D M, et al. Process improvement of prasugrel hydrochloride: an adenosine diphosphate receptor antagonist[J]. Org Process Res Dev, 2012, 16 (2): 240-243.
[4] 刘娥. 普拉格雷含量及有关物质的测定[J]. 化学与生物工程, 2014, 31(7): 76-78.
[5] 孙忠实, 朱珠. 第三代抗血小板药普拉格雷[J]. 中国新药杂志, 2010, 19(22): 2023-2026.
[6] THYBO P,KRISTENSEN J,HOVGAARD L. Characterization and physical stability of tolfenamic acid-PVPK30 solid dispersions [J]. Pharm Dev Technol, 2007, 12(1): 43.
[7] ANSARI M T,BATTY K T,IQBAL I,et al. Improving the solubility and bioavailability of dihydroartemisinin by solid dispersions and inclusion complexes[J]. Arch Pharm Res, 2011, 34(5): 757.
[8] 国家药典委员会. 中华人民共和国药典: 二部[M]. 北京: 中国医药科技出版社, 2010: 附录XC86.
[9] 潘西梅, 赵丽. 固体分散体中常用的载体[J]. 西北药学杂志, 1997, 12(6): 277-278.
[10] TANTISHAIVAKUL V, KAEWNOPPARAT N, INGKATAWORNWONG S. Properties of solid dispersion of piroxicam in polyvinylpyrrolidone[J]. Inter J Pharm, 1999, 181: 143-151.
[11] 崔福德. 药剂学[M]. 6版. 北京: 人民卫生出版社, 2008: 248.
[12] CHRISTIAN L, JENNIFER D. Improving drug solubility for oral delivery using solid dispersions[J]. Eur J Pharm Biopharm, 2000, 50: 47-60.
Preparation of prasugrel hydrochloride solid dispersion tablets and study of the dissolution behavior in vitro
ZHANG Huan, JIANG Wei-hua,WANG Huan-yu, LV Huan-huan, WANG Dong-kai* (School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo prepare prasugrel hydrochloride solid dispersion loaded tablets and increase dissolution of the tablets.MethodThe solvent method was used to prepare solid dispersion with different carriers. Differential scanning calorimetry (DSC) and X-ray diffraction (XRD) were applied to characterize the solid dispersion. Afterwards, the tablets was prepared using the preformed solid dispersion, the orthogonal design test was used to optimize the formulation. The dissolution behaviors of prasugrel hydrochloride solid dispersion tablets in three dissolution media in vitro were also studied.ResultsBy means of the influence factors test to screen for povidone K30(PVP K30) as the optimal carrier, and the weight proportion of drug and PVP K30 was 1∶5. Prasugrel hydrochloride was existed in the solid dispersion in the form of amorphous. Prasugrel hydrochloride solid dispersion tablets exhibited better dissolution than self-made tablets and commercial tablets in three kinds of dissolution medium.ConclusionThe dissolution of prasugrel hydrochloride was significantly improved by preparing prasugrel hydrochloride solid dispersion tablets, and the method was simple.
pharmaceutics; solid dispersion; solvent method; prasugrel hydrochloride; tablet; dissolution
R 94
A
(本篇责任编辑:吕向一)
(2015)03-0087-10
10.14146/j.cnki.cjp.2015.03.002
2014-12-23
张欢(1988-),女(蒙古族),内蒙古根河人,硕士研究生,E-mail 392335688@qq.com;*通讯作者:王东凯(1962-),男(汉族),辽宁沈阳人,教授,博士,博士生导师,主要从事缓控释制剂及新剂型的研究,Tel. 024-23986310,E-mail wangdksy@126.com。
