孕马尿提取物中4种化学成分的雌激素活性研究
2015-02-26毛旭文杜冠华高晓黎
毛旭文,张 莉,杜冠华,高晓黎
(1.新疆医科大学药学院,新疆乌鲁木齐 830011,2.中国医学科学院药物研究所国家药物筛选中心,北京 100050)
孕马尿提取物中4种化学成分的雌激素活性研究
毛旭文1,张 莉2,杜冠华2,高晓黎1
(1.新疆医科大学药学院,新疆乌鲁木齐 830011,2.中国医学科学院药物研究所国家药物筛选中心,北京 100050)
中国图书分类号:R-332;R329.24;R347.913;R392.11
摘要:目的 研究孕马尿提取物中4种化学成分的雌激素活性。方法 研究4种成分3β-羟基-5α-16-孕甾烷-20-酮(3β-hydroxy-5α-pregn-16-en-20-one,HP)、5β-孕甾烷-3β,16α,20α-醇(5β-pregnane-3β,16α,20α-triol,PT)、3β,16α-脱氢-5α-孕甾烷-20-酮(3β,16α-dihydroxy-5α-pregnan-20-one,DHP)、3β-羟基-5α-雄甾烷-17-酮(3β-hydroxy-5α-androstan-17-one,HA)对人乳腺癌细胞MCF-7的细胞增殖效应(E-screen实验);利用Luciferase报告基因与雌激素反应元件重组,与转染对照质粒pRL-cmv、雌激素受体ERα或ERβ质粒共同瞬时转染中国仓鼠卵巢细胞CHO,构建雌激素活性筛选模型,检测四种成分的雌激素活性。结果 E-screen实验结果显示,HP、PT、DHP、HA在1~50 μmol·L-1内均能诱导MCF-7细胞增殖,显示出雌激素活性。与雌二醇(17α-estro-diol,E2)的增殖效应(proliferative effect,PE)、相对增殖效应(relative proliferative effect,RPE)和EC50相比,HP、PT、DHP、HA的雌激素活性均小于E2的雌激素活性。Luciferase报告基因实验结果显示,HP、PT、DHP、HA在1~50 μmol·L-1内均能诱导Luciferase表达,显示雌激素活性。与E2的EC50值相比,HP、PT、DHP、HA的雌激素活性均弱于E2的雌激素活性。结论 HP、PT、DHP、HA均具有雌激素活性,与E2的雌激素活性相比,四种化合物均发挥弱雌激素效应。
关键词:雌激素活性;MCF-7;E-screen;报告基因;雌激素受体α;雌激素受体β
网络出版时间:2015-8-10 14:37 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150810.1437.024.html
孕马尿提取物(pregnant mare′s urine extract,PMUE)主要是一些雌激素的混合物,临床上主要用于缓解因雌激素不足引起的女性更年期综合征[1],预防和治疗骨质疏松症[2]、冠心病[3]以及老年痴呆症[4]。孕马尿中至少含有200种以上的化学成分[5],本课题组确定了PMUE中除主成分以外的4种成分,分别为:3β-羟基-5α-16-孕甾烷-20-酮(3β-hydroxy-5α-pregn-16-en-20-one,HP)、5β-孕甾烷-3β,16α,20α-醇(5β-pregnane-3β,16α,20α-triol,PT)、3β,16α-脱氢-5α-孕甾烷-20-酮(3β,16α-dihydroxy-5α-pregnan-20-one,DHP)、3β-羟基-5α-雄甾烷-17-酮(3β-hydroxy-5α-androstan-17-one,HA),见Fig 1。本实验利用两种体外方法评价4种成分的雌激素活性,首先考察4种成分对人乳腺癌细胞MCF-7的增殖作用(Escreen实验),其次利用雌激素反应元件与荧光素酶报告基因的重组质粒(pGM-ERE-Lucif-erase)及雌激素受体(ERα或ERβ)质粒瞬时共转染中国仓鼠卵巢细胞CHO,建立雌激素活性筛选系统,探讨四种成分的雌激素活性。
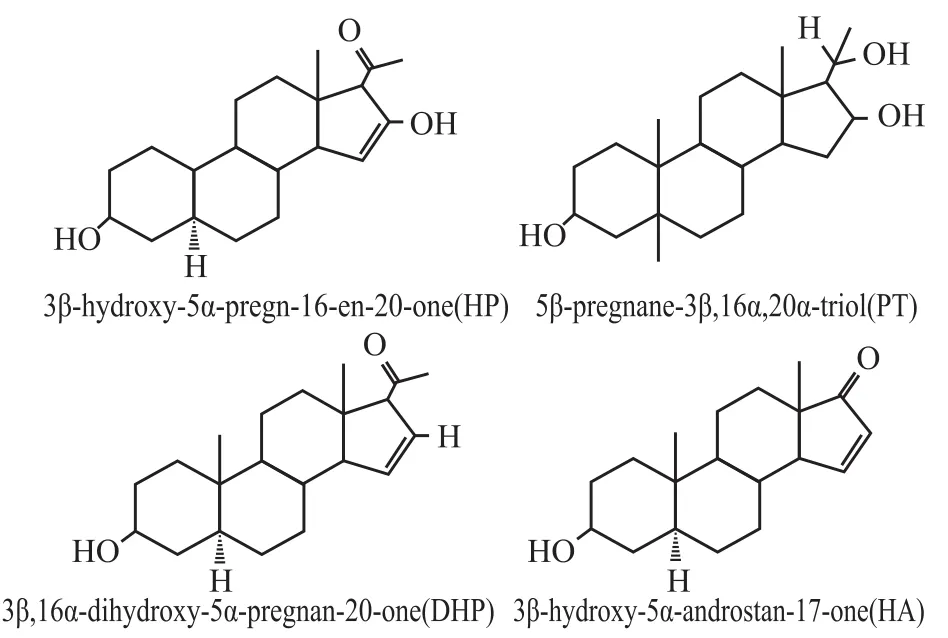
Fig 1 Structures of four kinds of chemical composition
1 材料与方法
1.1材料 人乳腺癌细胞株MCF-7、中国仓鼠卵巢细胞株CHO由中国医学科学院药物研究所国家药物筛选中心赠送。pCMV-ERα和pCMV-ERβ质粒购买于北京义翘神州生物有限公司;pGM-ERE-Luc质粒购买于上海吉满生物有限公司;pRL-CMV质粒购买于美国Promega公司。17β-雌二醇购买于中国食品药品检定研究院;HP、PT、DHP、HA均购买于Sigma-Aldrich公司,货号分别为:198886、196347、
362379、198110;孕马尿提取物为本实验室自制。RPMI 1640、DMEM无酚红培养基(石家庄宏伟生物技术有限公司);胰蛋白酶(吉诺生物技术有限公司);活性炭/葡聚糖法去除激素的胎牛血清(char-coal dextran treated FBS,CD-FBS)为自制;DMSO(北京百顺化学科技有限公司);MTT购买于Sigma-Aldrich公司;全波长多功能酶标仪(Perkin Elmer,美国);双荧光素检测系统试剂盒(碧云天生物有限公司);感受态大肠杆菌(TaKaRa公司);质粒提取试剂盒(Omega公司);Fugen-6转染试剂购买于美国Promega公司等。
1.2实验分组 (1)溶剂对照组;(2)阳性对照组:E2(10-5、10-4、10-3、10-2、10-1μmol·L-1);(3)实验药物组:HP、PT、DHP、HA均为1、5、10、20、30、40、50 μmol·L-1;PMUE(10-5、10-4、10-3、10-2、10-1mg·L-1)。
1.3细胞培养 MCF-7细胞培养在含10%CD-FBS的无酚红RPMI 1640的培养体系中,CHO细胞培养在含10%CD-FBS的无酚红DEME的培养体系中,培养体系中加入100 IU·L-1青霉素和100 mg·L-1链霉素,置于37℃、5%CO2饱和湿度孵育箱中培养,每2天更换1次培养基,培养至细胞处于对数生长期时进行实验。
1.4MCF-7细胞增殖实验(E-screen Assay) 取对数生长期的MCF-7细胞,以4×107个·L-1浓度接种于96孔板,每孔90 μL。37℃孵育24 h后,给予不同浓度的待测物,每孔10 μL,继续孵育6 d。6 d后,用MTT法检测细胞增殖率。E-screen实验用增殖效应(proliferative effect,PE)和相对增殖效应(relative proliferative effect,RPE)评价待测物的雌激素活性的强度。

1.5Luciferase报告基因实验 取对数生长期的CHO细胞,以1×108·L-1浓度接种于24孔板,每孔1 mL。转染前4 h,用PBS漂洗细胞2次,加入不含CD-FBS的无酚红DMEM培养基。将5 μL pGM-ERE-Luc、5 μL pRL-CMV、5 μL pCMV-ERα或pC-MV-ERβ质粒与转染试剂混合,室温静置15 min,将混合物加入到CHO细胞培养基中,置于37℃、5% CO2培养箱中培养24 h。转染24 h后,取出24孔板弃去培养基,PBS漂洗细胞2次,加入含10%CD-FBS的无酚红DMEM培养基,分别给予不同浓度待测物,继续培养48 h。48 h后,弃去培养液,按照双荧光素检测系统试剂盒的操作说明,用全波长多功能酶标仪测定化学发光值。Luciferase报告基因实验的评价指标为相对雌激素活性(relative estrogenic activity,REA),REA是Luciferase化学发光值与pRL-CMV的化学发光值的比值。
1.6比较E-screen实验与Luciferase报告基因实验 以estradiol equivalent quantity(EEQ)为评价指标比较两种实验检测雌激素活性的一致性与差异性。
EEQ/%=EC50(E2)/EC50(sample)×100%
2 结果
2.1E-screen实验评价雌激素活性 与空白溶剂对照组比较,HP、PT、DHP、HA和PMUE在受试浓度下均可以明显诱导MCF-7细胞增殖(P<0.01),并呈现出剂量依赖性,结果显示,HP、PT、DHP、HA和PMUE均具有雌激素的活性。见Tab 1,Fig 2。
Tab 1 PE%,RPE%and EC50values of four test compounds according to the E-screen assay(±s,n=3)
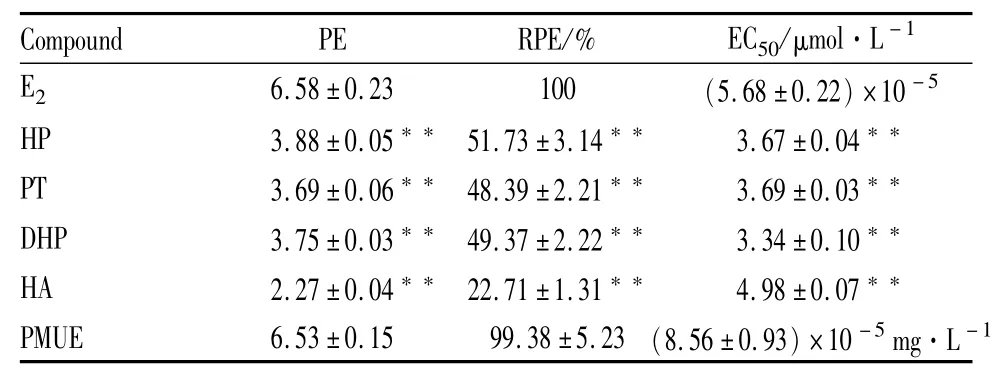
Tab 1 PE%,RPE%and EC50values of four test compounds according to the E-screen assay(±s,n=3)
**P<0.01 vs E2group.
Compound PE RPE/% EC50/μmol·L-1E2 6.58±0.23 100 (5.68±0.22)×10-5HP 3.88±0.05 51.73±3.14 3.67±0.04**PT 3.69±0.06 48.39±2.21 3.69±0.03**DHP 3.75±0.03 49.37±2.22 3.34±0.10**HA 2.27±0.04 22.71±1.31 4.98±0.07**PMUE 6.53±0.15 99.38±5.23(8.56±0.93)×10-5mg·L-1
2.2Luciferase报告基因实验评价雌激素活性与空白溶剂对照组相比,HP、PT、DHP、HA和PMUE均能诱导由ERα或ERβ介导的荧光素酶表达(P<0.01或P<0.05),并呈现出剂量依赖性,显示出雌激素活性。见Fig 3~6,Tab 2。
2.3比较E-screen实验与Luciferase报告基因检测实验 两种实验均检测到HP、PT、DHP、HA具有雌激素的活性,对比两种实验的EEQ没有明显的差异(P>0.05),说明E-screen实验与Luciferase报告基因实验结果差异无显著性。E-screen实验中EEQ均稍微高于Luciferase报告基因实验的Mean EEQ,可能由于二者的作用对象与作用时间不同,导致两种实验的检测灵敏度不同。E-screen实验的作用对象是细胞,作用时间为144 h,而Luciferase报告基因实验
的作用对象是受体,作用时间为48 h。见Tab 3。
Tab 2 EC50values of four analytes according to the Luciferease report gene assay(±s,n=3)
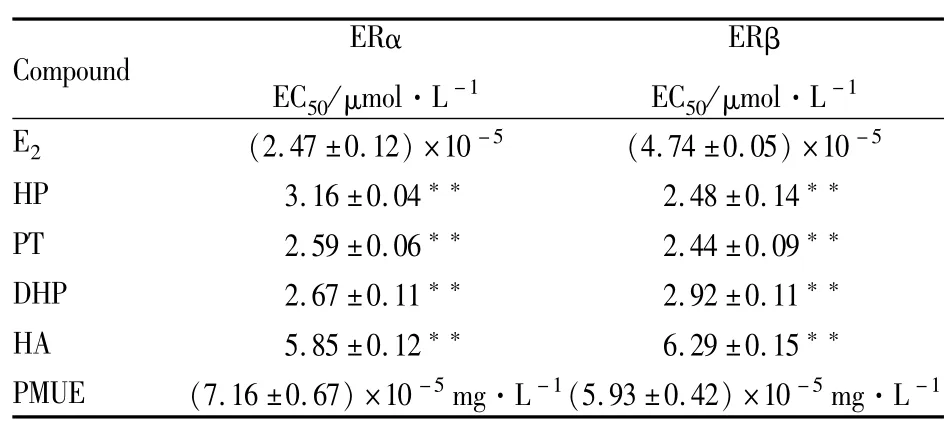
Tab 2 EC50values of four analytes according to the Luciferease report gene assay(±s,n=3)
**P<0.01 vs E2group.
Compound ERα EC50/μmol·L-1ERβ EC50/μmol·L-1E2 (2.47±0.12)×10-5 (4.74±0.05)×10-5HP 3.16±0.04 2.48±0.14**PT 2.59±0.06 2.44±0.09**DHP 2.67±0.11 2.92±0.11**HA 5.85±0.12 6.29±0.15**PMUE (7.16±0.67)×10-5mg·L-1(5.93±0.42)×10-5mg·L-1
3 讨论
Tab 3 Estrogenic activities of four test samples in MCF-7 cells(E-screen assay)and in Luciferease report gene cells(Luciferease report gene assay)(±s,n=3)
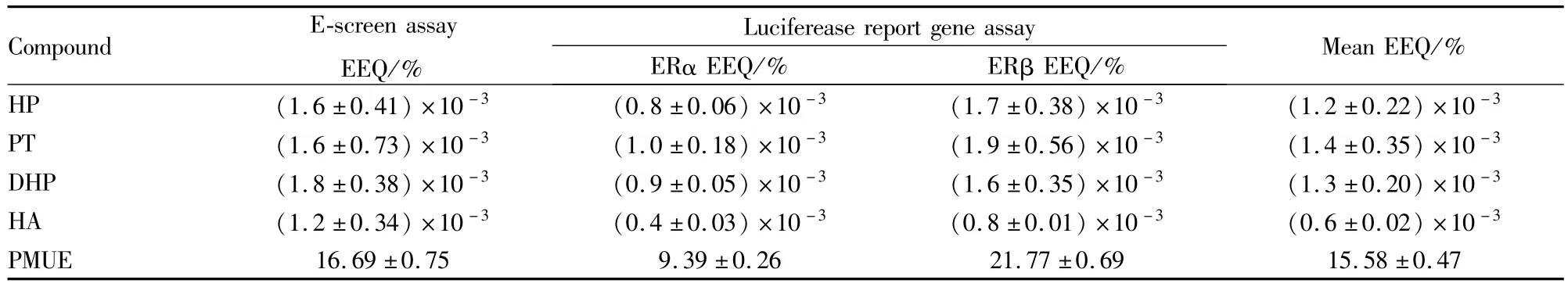
Tab 3 Estrogenic activities of four test samples in MCF-7 cells(E-screen assay)and in Luciferease report gene cells(Luciferease report gene assay)(±s,n=3)
Compound E-screen assay EEQ/% Luciferease report gene assay ERα EEQ/% ERβEEQ/%Mean EEQ/% HP (1.6±0.41)×10-3 (0.8±0.06)×10-3 (1.7±0.38)×10-3 (1.2±0.22)×10-3PT (1.6±0.73)×10-3 (1.0±0.18)×10-3 (1.9±0.56)×10-3 (1.4±0.35)×10-3DHP (1.8±0.38)×10-3 (0.9±0.05)×10-3 (1.6±0.35)×10-3 (1.3±0.20)×10-3HA (1.2±0.34)×10-3 (0.4±0.03)×10-3 (0.8±0.01)×10-3 (0.6±0.02)×10-3PMUE 16.69±0.75 9.39±0.26 21.77±0.69 15.58±0.47
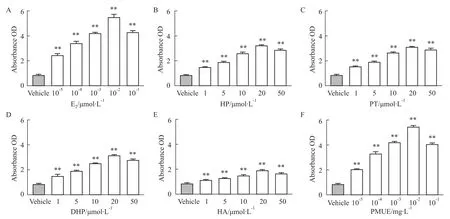
Fig 2 Proliferative effects induced by test samples in MCF-7 cells(E-screen test)(±s,n=3)
E-screen实验是由Soto等[6]最早提出,采用MCF-7细胞增殖实验评价化合物的雌激素活性,称为雌激素筛检(E-screen)实验,是一种常用的体外检测外源雌激素的方法。E-screen实验检测化合物的雌激素活性,酚红对MCF-7细胞有诱导细胞增殖作用,同时血清中的内源性雌激素对MCF-7细胞也有明显的诱导细胞增殖作用。采用活性炭/葡聚糖处理的FBS与无酚红RPMI 1640培养基培养MCF-7细胞,避免酚红和内源性雌激素对E-screen实验干扰。四种化合物与MCF-7细胞作用后,与空白溶剂对照组比较,HP、PT、DHP、HA均可以明显诱导MCF-7细胞增殖(P<0.01),增殖效应与受试浓度呈现出剂量依赖性,HP、PT、DHP、HA均在20 μmol·L-1诱导MCF-7达到最大增殖效应。与E2的EC50相比,HP、PT、DHP、HA的EC50相差105倍(P<0.01),HP、PT、DHP、HA的PE也远小于E2的PE值(P<0.01),HP、PT、DHP、HA的RPE小于100%,说明四种物质显示出的雌激素效应小于E2的雌激素效应。PMUE 的EC50与E2的EC50相比没有差异(P>0.05),其PE值与E2的PE没有差异(P>0.05),PMUE的RPE接近100%,说明PMUE的雌激素效应与E2的雌激素效应相同。HP、PT、DHP、HA的EC50与PMUE的EC50相
差105倍,其PE值均小于PMUE的PE值(P<0.01),其RPE值均小于PMUE的RPE值(P<0.01),说明PMUE显示出雌激素效应强于HP、PT、DHP、HA的雌激素效应,这是因为PMUE中含有雌二醇、雌酮、马烯雌酮等多种雌激素,且这些成分都是PMUE的主要成分。根据RPE值判断四种化合物发挥雌激素的活性由强到弱顺序为:HP>DHP>PT>HA。
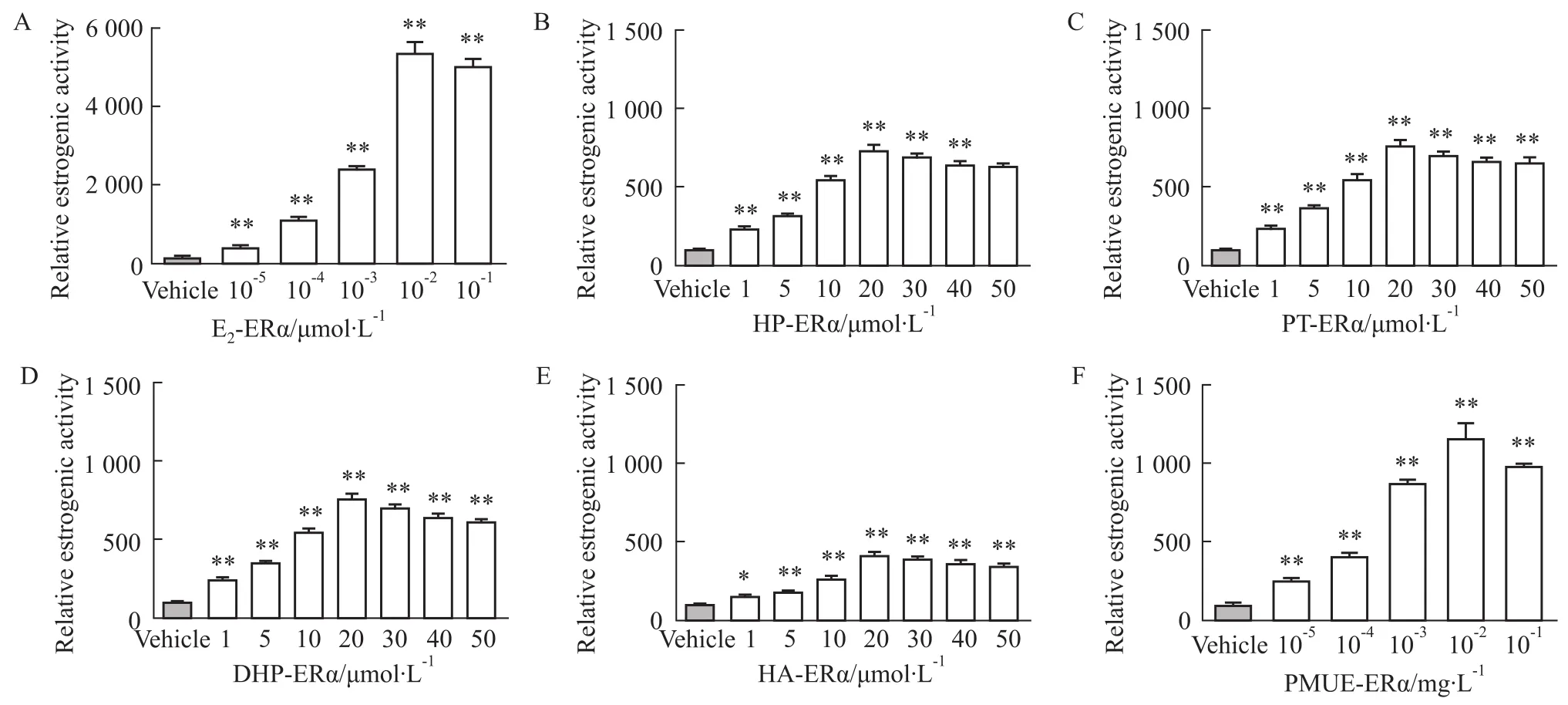
Fig 3 ERα-mediated ERE-driven transcriptional activation in CHO cells(±s,n=3)
Fig 4 Transcriptional efficiency of ERα,ERE-Luciferase(±s,n=3)
本实验将雌激素反应元件pGM-ERE-Luc、转染对照质粒pRL-CMV、雌激素受体pCMV-ERα或pC-MV-ERβ质粒瞬时共转染CHO细胞建立雌激素受体细胞筛选系统,利用此系统检测HP、DHP、PT、HA是否与ERα或ERβ结合并发挥雌激素活性。结果显示,在10-5~10-2μmol·L-1的范围内,随着E2浓度增大,荧光素酶的表达值升高,浓度增大到10-2μmol ·L-1,荧光素酶的表达值最高,当E2增大到10-1μmol·L-1时,荧光素酶的表达值下降。HP、PT、DHP、HA在1~20 μmol·L-1的浓度范围内,随着浓度的增加,荧光素酶的表达值升高,但是,当浓度增大到20 μmol·L-1时,荧光素酶的表达值最高,当浓度增大到30 μmol·L-1时,荧光素酶的表达值反而减小。以上现象可能由于雌激素受体达到饱和,待测物样品浓度继续增加,荧光素酶的表达值反而减小。E2与ERα结合的REA值比与ERβ结合的REA值
高4倍左右,说明E2与ERα结合的亲和力高于与ERβ结合的亲和力。通过比较REA值,HP、PT、DHP、HA、PMUE与ERβ结合后的REA与ERα结合后的REA无差异(P>0.05),说明HP、PT、DHP、HA 与ERβ结合的亲和力与ERα结合的亲和力相同。与E2的EC50相比,HP、PT、DHP、HA的EC50与雌二醇相差105倍(P<0.01),说明4种物质显示出的雌激素效应比雌二醇的雌激素效应弱。PMUE的EC50与E2相比差异无显著性(P>0.05),说明PMUE显示出的雌激素效应与E2的雌激素效应相同。HP、PT、DHP、HA的EC50与PMUE的EC50相差105倍,说明PMUE显示出雌激素效应强于HP、PT、DHP、HA的雌激素效应,因为PMUE中含有多种活性较强的雌激素。
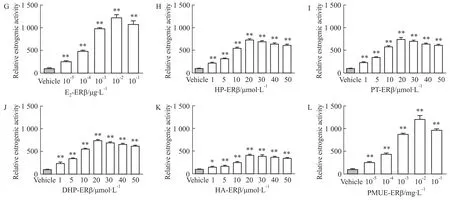
Fig 5 ERβ-mediated ERE-driven transcriptional activation in CHO cells(±s,n=3)
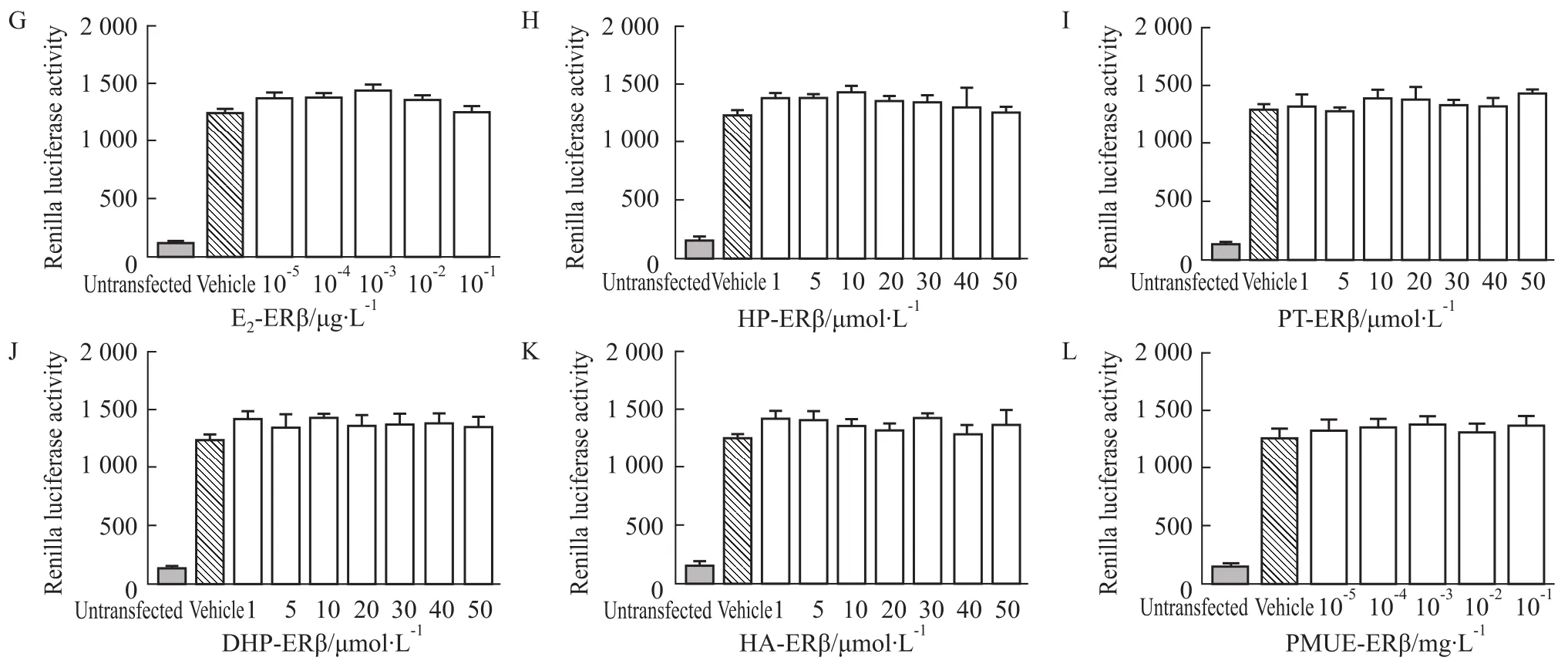
Fig 6 Transcriptional efficiency of ERβ,ERE-Luciferase(±s,n=3)
根据文献报道[6-10],E2在10-5~10-1μmol· L-1范围内显示雌激素效应,本实验在此浓度范围内考察了HP、PT、DHP、HA及PMUE的雌激素活性,发现在10-5~10-1μmol·L-1内,HP、PT、DHP、HA并未显示雌激素活性,而PMUE在10-5~10-1μmol· L-1范围内显示雌激素效应。增大浓度至1~50 μmol ·L-1,发现HP、PT、DHP、HA可以诱导luciferase表达,显示雌激素效应并呈剂量依赖性,因此实验组的剂量设置在1~50 μmol·L-1。
本实验利用两种体外检测方法:E-screen实验和luciferase报告基因实验评价HP、PT、DHP、HA的雌
激素活性,两种方法均能检测出HP、PT、DHP、HA具有雌激素活性,但是与E2的雌激素活性相比,HP、PT、DHP、HA均发挥弱雌激素活性。有机体是一个复杂的体系,体外实验结果最终需要与动物实验相结合,在未来的研究中,本课题组还要通过动物实验来考察HP、PT、DHP、HA的雌激素活性,才能使结果更加准确、可靠。
(致谢:本文实验是由新疆医科大学与中国医学科学院药物研究所国家药物筛选中心合作提供实验条件,本人对中国医学科学院药物研究所国家药物筛选中心的全体研究人员表示衷心的感谢。)
参考文献:
[1] 张兰兰,赵文军,吴雪萍,王 旭.孕马尿中甾体成分及其活性的研究现状[J].天然产物研究与开发,2003,15(4):354-8.
[1] Zhang L L,Zhao W J,Wu X P,Wang X.Advance of steroid con-tent analysis of pregnancy mares’s urine[J].Nat Prod Res Dev,2003,15(4):354-8.
[2] Mckenna M J,Frame B.Hormonal influences on osteoporosis[J].Am J Med,1987,82(1B):61-7.
[3] Chute C G,Baron J A,Plymate S R,et al.Sex hormones and coro-nary artery disease[J].Am J Med,1988,85(1):129.
[4] Goldberg R J,Gore J M,Zive M,et al.Serum estradiol and coro-nary artery disease[J].Am J Med,1987,82(1):1-4.
[5] 王 莹,高晓黎.孕马尿中化学成分的研究进展[J].新疆医科大学学报,2007,30(8):800-2.
[5] Wang Y,Gao X L.Advances in research chemical constituents in pregnancy mare’s urine[J].J Xinjiang Med Univ,2007,30(8):800-2.
[6] Soto A M,Sonnenschein C,Chung K L,et al.The E-Screen assay as a tool to identify estrogens:an update on estrogenic environmental pollutants[J].Environ Health Perspect,1995,103(suppl 7):113-22.
[7] Besse J P,Latour J F,Garric J.Anticancer drugs in surface wa-ters:what can we say about the occurrence and environmental signif-icance of cytotoxic,cytostatic and endocrine therapy drugs[J].En-viron Int,2012,39:73-86.
[8] Bielawski K,Bielawska A,Poplawska B,et al.The effect of a no-vel dinuclear platinum complex with berenil and 2-picoline ligands on growth of human breast cancer cells[J].Acta Pol Pharm,2010,67:609-14.
[9] Golden R,Gandy J,Vollmer G.A review of the estrogenic activity of parabens and implications for potential risks to human health[J].Crit Rev Toxicol,2005,35:435-58.
[10]Degrandi T H,de Oliveira I M,d′Almeida G S,et al.Evaluation of the cytotoxicity,genotoxicity and mutagenicity of diphenyl ditellu-ride in several biological models[J].Mutagenesis,2010,25(3):257 -69.
Estrogenic activities of four components from pregnant mare’s urine extract
MAO Xu-wen1,ZHANG Li2,DU Guan-hua2,GAO Xiao-li1
(1.Dept of Pharmacy,Xinjiang Medical University,Urimuqi 830011,China;2.Beijing Key Laboratory of Drug Target Identification and Drug Screening,Institute of Materia Medica,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100050,China)
Abstract:Aim To investigate the estrogenic activities of four components from pregnant mare’s urine extract.Methods The estrogenic activities of four components were assessed using two in vitro tests:the MCF-7 cell proliferation assay(E-screen test)and the luciferase transfected CHO cell gene reporter assay.In the lucifer-ase reporter gene assay,the reporter gene plasmids PGM-ERE-Luc and ERα or ERβ and a control plasmid (pRL-cmv)were transiently co-transfected into CHO cells to establish an ERα-or ERβ-cell screening system which was used to measure estrogenic activity of four compounds.Results MCF-7 cells treated with HP,DHP,PT and HA significantly proliferated,thereby of-fering in vitro evidence for the estrogenic activities of HP,DHP,PT and HA,and they showed dose-depend-ent activities.Compared EC50of PE and RPE with that of E2,HP,DHP,PT and HA exerted relatively weak estrogenic activities.The in vitro ER-mediated reporter gene assay revealed that HP,DHP,PT and HA dis-played estrogenic activities mediated by ERβ or ERα.Compared with the EC50of E2,HP,DHP,PT and HA exhibited lower estrogenic potencies.Conclusion HP,DHP,PT and HA possess weaker estrogenic activities than E2.
Key words:estrogenic activities;MCF-7;E-screen Assay;reporter gene;estrogen receptor α;estrogen re-ceptor β
作者简介:毛旭文(1986-),女,博士,研究方向:新疆地方资源药物研发,E-mail:358178217@qq.com;高晓黎(1962-),女,博士,教授,博士生导师,研究方向:新疆地方资源药物研发,通讯作者,E-mail:xli_g@sina.com
基金项目:国家十二五“重大新药创制”科技重大专项(No 2011ZXO9203);新疆维吾尔自治区重大科技专项(No 201130101)
收稿日期:2015-05-23,修回日期:2015-06-25
文献标志码:A
文章编号:1001-1978(2015)09-1304-06
doi:10.3969/j.issn.1001-1978.2015.09.024
