染料木素拮抗对氧磷诱导的大鼠胸主动脉组织p22phox表达上调
2015-02-26刘玉玲汪煜华张秀芹李冬花黄红林
刘玉玲,汪煜华,张秀芹,李冬花,黄红林
(1.湖南省高等学校药物蛋白质组学重点实验室,南华大学药物药理研究所,湖南衡阳 421001;2.娄底市卫生学校,湖南娄底 417000)
染料木素拮抗对氧磷诱导的大鼠胸主动脉组织p22phox表达上调
刘玉玲1,2,汪煜华1,张秀芹1,李冬花1,黄红林1
(1.湖南省高等学校药物蛋白质组学重点实验室,南华大学药物药理研究所,湖南衡阳 421001;2.娄底市卫生学校,湖南娄底 417000)
中国图书分类号:R-322;R322.121;R595.4;R543.5;R977.6
摘要:目的 探讨染料木素是否通过下调p22phox、Nox4的表达,抑制活性氧的生成而拮抗对氧磷损伤的血管内皮功能。方法 取♂SD大鼠胸主动脉。①溶媒对照组:用0.1%的二甲基亚砜(dimethyl sulfoxide,DMSO)处理大鼠胸主动脉30 min;②染料木素(genistein,GST)处理组:GST (100 μmol·L-1)处理大鼠胸主动脉30 min;③对氧磷(paraoxon,PO)处理组:PO(40.5 μmol·L-1)处理大鼠胸主动脉30 min;④PO+GST处理组:PO(40.5 μmol·L-1)+GST(100 μmol·L-1)处理大鼠胸主动脉30 min。RT-PCR法检测各组p22phox、Nox4 mRNA表达的变化;Western blot观察p22phox和Nox4蛋白表达的变化。结果 较之溶媒对照组,PO处理可使p22phox、Nox4 mRNA及蛋白表达明显增加;GST处理则使p22phox、Nox4 mRNA及蛋白表达明显减少;PO+GST共同处理组,Nox4 mRNA及蛋白表达增加。与PO单独处理组比较,PO+GST共同处理组p22phox mRNA及蛋白表达明显减少。结论 对氧磷可通过上调血管组织p22phox、Nox4 mRNA和蛋白的表达,导致血管内皮氧化损伤;染料木素可下调二者的表达,保护血管内皮。
关键词:染料木素;对氧磷;氧化性损伤;NADPH氧化酶;p22phox;Nox4
网络出版时间:2015-8-10 14:37 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150810.1437.022.html
氧化应激诱导机体产生大量的活性氧(ROS)。ROS是诱发心血管疾病的潜在危险因素。ROS可降解一氧化氮合酶(nitric oxide synthase,NOS),并直接灭活NO;ROS还能通过与底物的相互作用,引起内皮细胞损伤,启动炎症反应;通过激活核因子-κB(NF-κB)及转录活化因子(AP-1)而引发细胞凋亡,并进一步促进损伤的血管内皮处的炎性反应;同时ROS还能诱导血管平滑肌细胞的增殖。所有这些都可能导致血管内皮功能障碍。
体内有多种酶参与了ROS的生成,目前研究表明[1],NADPH氧化酶在多种因素刺激内皮细胞生成ROS的过程中起主要作用。NADPH氧化酶在体内主要分布于吞噬细胞,另外也分布于血管内皮细胞、平滑肌细胞、心肌细胞、成纤维细胞等非吞噬细胞。近来的研究表明,NADPH氧化酶由6种亚基构成,内皮细胞上有其主要功能亚基Nox4及p22phox亚基的表达。研究发现,异位表达的Nox4可与p22phox结合形成复合物,增加Nox4的稳定性;同时Nox4也能促进p22phox的表达,促进依赖Nox4 的ROS产生[2-3]。
对氧磷(paraoxon,PO)是有机磷酸酯类在体内的活性代谢形式。PO可引起机体产生大量过氧化物及氧自由基,抑制对氧磷酶-1(PON1)的过氧化物酶样作用,抑制SOD活性,诱发机体氧化应激,导致血管内皮细胞损伤。我们早期通过离体血管环实验也证实了PO可导致大鼠胸主动脉内皮依赖性舒张功能(EDR)损伤,引起血管舒缩功能异常[4]。
染料木素(genistein,GST)为一种植物雌激素,广泛存在于豆科植物中。很多研究都证实,GST具有抗氧化活性,可对抗DNA氧化损伤[5-6]。GST具有多羟基酚结构,可直接与超氧阴离子等自由基结合,抑制氧自由基反应及脂质的过氧化反应;GST可升高SOD的活性、谷胱甘肽(glutathione,GSH)水平,并上调谷胱甘肽过氧化物酶(GSH-Px)的水平和活性,加快氧自由基的清除[7-8];抑制NADPH氧化酶p22phox亚基的表达,抑制ROS的产生[9]。GST的抗氧化作用可避免或减轻血管内皮细胞的氧化损伤,维持血管内皮的正常功能。本实验室早期研究发现,GST可明显改善PO诱导的大鼠胸主动脉内皮依赖性舒张功能异常,维持血管正常舒缩功能[4]。
综上所述,PO引起机体氧化应激,造成血管内皮细胞氧化损伤,血管正常结构和功能受损。GST则具有抗氧化作用,减低氧化应激对血管内皮造成的损伤。结合本实验室早期大鼠胸主动脉内皮依赖
性舒张功能的实验结果,笔者推测GST通过其抗氧化作用对抗PO对血管功能的损伤。本实验旨在于探讨PO氧化损伤血管内皮,导致血管内皮功能失调及GST抗氧化、保护血管内皮功能,是否均与NADPH氧化酶分布在血管内皮上的p22phox与Nox4亚基的表达水平相关。本课题的研究将为有机磷酸酯类农药诱发心血管疾病的发生机制及GST对此类疾病可能的防治提供理论参考及实验依据。
1 材料与方法
1.1材料
1.1.1动物与试剂 ♂SD大鼠20只,体质量220 ~280 g,南华大学实验动物中心提供。对氧磷(Dr.Ehrenstorfer GmbH);染料木素(杭州浙大泛科化工有限公司);Nox4、p22phox引物[生工生物工程(上海)有限公司];β-actin(235bp)引物[英潍捷基(上海)贸易有限公司];β-actin(394bp)引物(上海捷倍思基因技术有限公司);抗p22phox鼠单克隆抗体(Santa Cruz Biotechnology);抗Nox4兔单克隆抗体(Abcam);抗β-actin鼠单克隆抗体(北京康为世纪生物技术有限公司);其余试剂均为进口或国产生物试剂。对氧磷、染料木素均用0.1%的DMSO溶解后,再用去离子水稀释至所需浓度。
1.1.2仪器 pH计(MP220型,METTLER TOLE-DO);高速低温离心机(5810R型,Eppendorf);紫外-可见分光光度计(UV2450型,SHIMADZU);PCR仪、Mini-Protean垂直板电泳槽、湿转仪(Bio-Rad);凝胶成像系统(Tanon);琼脂糖水平电泳槽(北京六一仪器厂);酶标仪(ELX 800,Bio-TEK INSTRU-MENTS.INC)。
1.2方法
1.2.1模型建立 ♂SD大鼠,颈椎脱臼处死,取出胸主动脉,置于实验当天配制的充氧(95%O2/5%CO2)的冰Kreb’s液中[4℃,Kerb′s液用高压处理后的0.1%焦碳酸二乙酯(DEPC)水配制,调pH 7.2~7.4,于超净工作台滤过除菌],剥离周围结缔组织,将胸主动脉移置含10 mL Kerb′s液的安瓿瓶内,37℃恒温,同时通入95%O2/5%CO2混合气体。实验设4组:①溶媒对照组:加入终浓度0.1% DMSO;②GST处理组:加入终浓度100 μmol·L-1的GST;③PO处理组:加入终浓度40.5 μmol·L-1的PO;④PO+GST处理组:加入终浓度40.5 μmol ·L-1的PO+终浓度100 μmol·L-1的GST。各组均于37℃下孵育血管30 min,取出,用冰PBS冲洗(0.1%DEPC水配制并高压),置于-80℃冰箱保存备用。
1.2.2RT-PCR检测大鼠胸主动脉p22phox和Nox4 mRNA的表达 各组标本分置于各研钵中,加入液氮,于冰上研磨匀浆后,按照RNA提取试剂盒说明提取组织总RNA。取适量总RNA与6×load-ing buffer按5∶1的比例混匀后,于110 V恒压下在2.0%的琼脂糖凝胶中电泳,于凝胶成像系统中观察电泳结果,若可见28S、18S、5S(此条带也有可能降解)条带,且28S条带亮度是18S条带亮度2倍左右,提取的总RNA合格,可以用于后续实验。将提取的总RNA稀释,分别于260 nm、280 nm处测定其吸光度(A),计算A260/A280,比值在2左右时,说明提取的总RNA质量合格;根据A260计算各组RNA浓度。根据计算所得各组RNA浓度,取等质量1.5 μg RNA按逆转录试剂盒说明的实验程序完成各组RNA逆转录,合成互补脱氧核糖核酸(cDNA),并以其作为模板进行PCR扩增。各引物序列及PCR反应条件见Tab 1,各组扩增目的基因的同时扩增内参照β-actin。PCR产物在2.0%的琼脂糖凝胶中电泳,恒压110 V,上样量为10 μL,于凝胶成像系统中扫描分析产物条带。将各组目的基因(p22phox、Nox4)与其内参照(β-actin)扩增条带的吸光度比值作为目的基因mRNA表达水平的相对指标。

Tab 1 p22phox,Nox4 and β-actin primer sequences and PCR reaction conditions
1.2.3Western blot检测大鼠胸主动脉p22phox和Nox4蛋白的表达 各组标本分置于各研钵中,加入液氮,研磨匀浆后,按照总蛋白提取试剂盒说明提取组织总蛋白。
1.2.3.1蛋白浓度测定 按照BCA蛋白浓度测定试剂盒说明的实验步骤,使用酶标仪于570 nm处测定并计算各组蛋白浓度。
1.2.3.2SDS-PAGE凝胶电泳 根据相关抗体说明书,目的基因p22phox蛋白条带位于26 ku位置处,Nox4蛋白条带位于63 ku位置处,β-actin蛋白条带位于43 ku位置处,10%分离胶可较好分离20
~80 ku大小的蛋白质,满足上述3种蛋白质分离要求。照凝胶配制试剂盒规定步骤制备10%分离胶,37℃恒温放置30 min,制备浓缩胶,并于37℃恒温放置40 min,待胶凝固,即可上样。根据蛋白定量结果,将各组不同浓度蛋白均稀释至同一浓度,取等质量等体积蛋白(70 μg,22 μL)按4∶1比例与5×蛋白上样缓冲液(溴酚蓝染料预染)混匀(总体积约27.5 μL),100℃煮沸5 min,即可上样、电泳。浓缩胶的电泳条件为80 V恒压,观察蛋白条带进入分离胶后即调节电压至120 V,待蛋白Marker各条带跑开,蛋白条带接近凝胶底部时,即可停止电泳。
1.2.3.3蛋白质转膜 剪下比胶略小的PVDF膜,置甲醇中活化2 min。盘内倒入适量转膜液,按转膜装置从阴极到阳极的顺序,依次放上滤纸、凝胶、PVDF膜、滤纸,每一步均需去除气泡。接通电源,恒流350 mA,3 h。
1.2.3.4免疫杂交 剪下p22phox、Nox4、β-actin所处位置PVDF膜,用TBST洗涤2次,5%封闭液封闭,置摇床上振摇1 h,TBST洗涤,分别加入用1%脱脂奶粉稀释的1∶100 p22phox一抗,1∶200 Nox4一抗,1∶500 β-actin一抗,密封,与膜共振摇1 h,置4℃冰箱过夜。取出PVDF膜,TBST洗涤3次,每次10 min,加入1∶1 500的辣根过氧化物酶标记的相应二抗,密封,于37℃放置30 min,室温振摇1 h,TBST洗涤3次,每次15 min。按照超敏ECL化学发光试剂盒说明滴加化学发光底物到PVDF膜上,观察荧光现象,压片、显影、定影。定影后的X胶片扫描至计算机,图像分析系统AlphaIm-ager 2200计算目的条带的灰度值与内参照β-actin条带灰度值的比值,作为目的蛋白表达水平的相对指标。
1.3统计学分析 采用统计软件SPSS 16.0进行统计分析,数据均以±s表示,组间差异比较采用ANOVA及Dunnett-t、S-N-K多重比较。
2 结果
2.1染料木素、对氧磷对大鼠胸主动脉p22phox 和Nox4 mRNA表达的影响 RT-PCR结果显示(Fig 1),较之溶媒对照组,PO处理引起p22phox mRNA表达明显上调(P<0.01);GST处理导致p22phox mRNA表达下调(P<0.01);PO+GST共同处理对p22phox mRNA表达的影响不大,差异无显著性。但相对于PO处理组,PO+GST共同处理可下调p22phox mRNA的表达(P<0.05)。
RT-PCR结果显示(Fig 2),相对于溶媒对照组,PO处理引起Nox4 mRNA表达明显上调(P< 0.01);GST处理导致Nox4 mRNA表达下调(P<0.05);PO+GST共同处理导致Nox4 mRNA表达上调(P<0.05)。但相对于PO处理组,PO+GST共同处理对Nox4 mRNA表达的影响不大,差异无显著性。
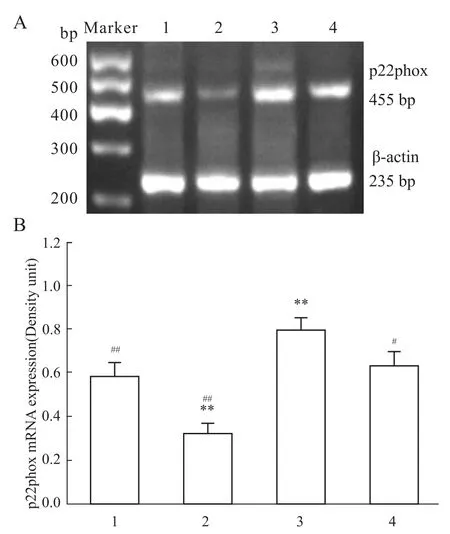
Fig 1 RT-PCR results show the effects of genistein and paraoxon on the expression of p22phox mRNA in rat thoracic aorta tissues(n=3)
2.2染料木素、对氧磷对大鼠胸主动脉p22phox 和Nox4蛋白表达的影响 Western blot结果显示(Fig 3),较之溶媒对照组,PO处理引起p22phox蛋白表达明显上调(P<0.01);GST处理导致p22phox蛋白表达下调(P<0.05);PO+GST共同处理后,较溶媒对照组,p22phox蛋白表达有所增加,但差异无显著性。但相对于PO处理组,PO+GST共同处理使p22phox蛋白表达减少(P<0.05)。
Western blot结果显示(Fig 4),与溶媒对照组比较,PO处理引起Nox4蛋白表达明显上调(P<0.01);GST处理导致Nox4蛋白表达下调(P<0.05);PO+GST共同处理导致Nox4蛋白表达上调(P<0.01);相对于PO处理组,PO+GST共同处理组Nox4蛋白表达有所降低,但差异无显著性。
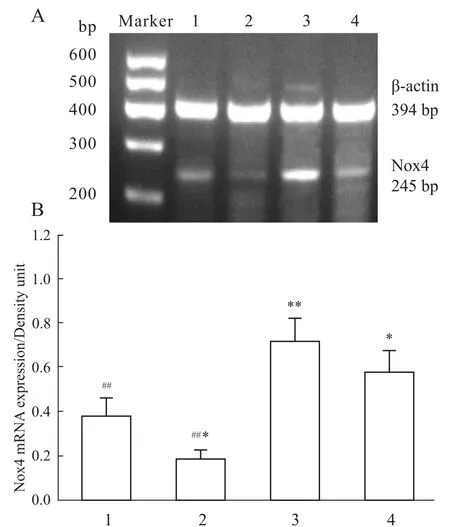
Fig 2 RT-PCR results show the effects of genistein and paraoxon on the expression of Nox4 mRNA in rat thoracic aorta tissues(±s,n=3)
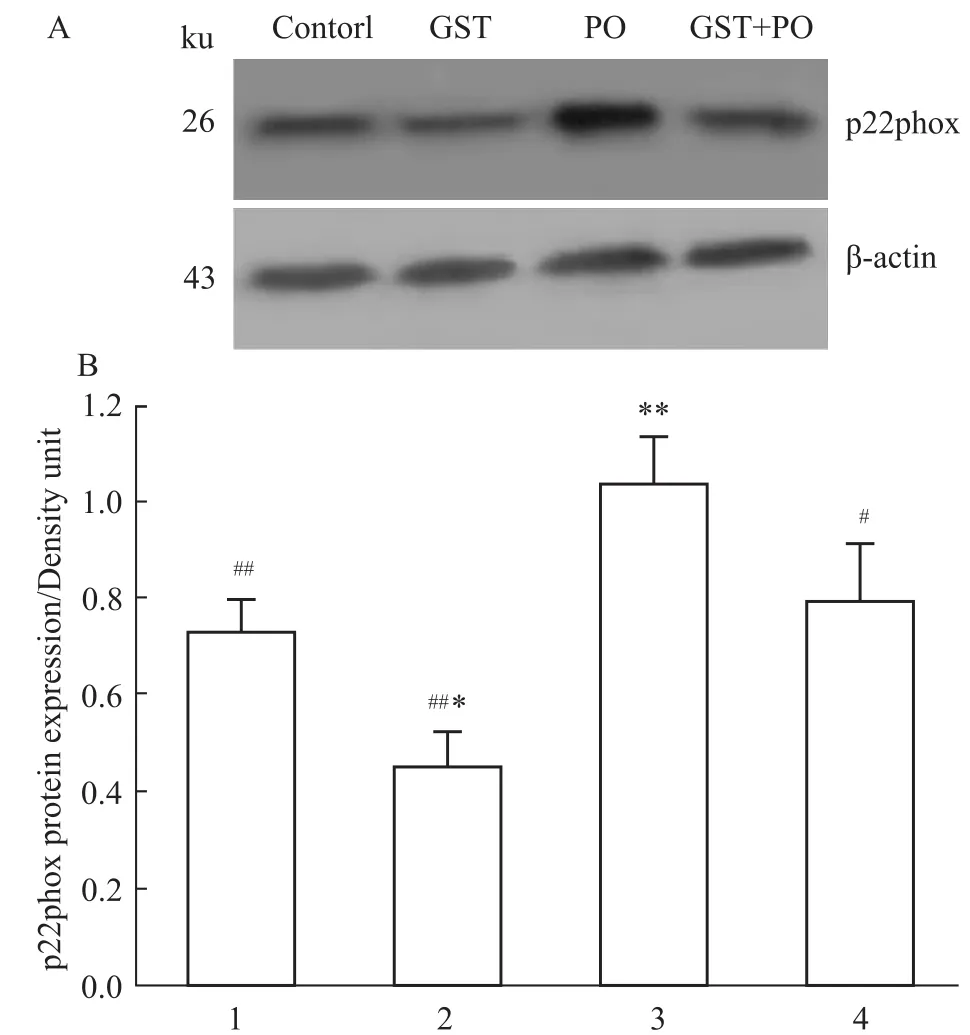
Fig 3 Western blot results show the effects of genistein and paraoxon on the expression of p22phox protein in rat thoracic aorta rings(±s,n=3)
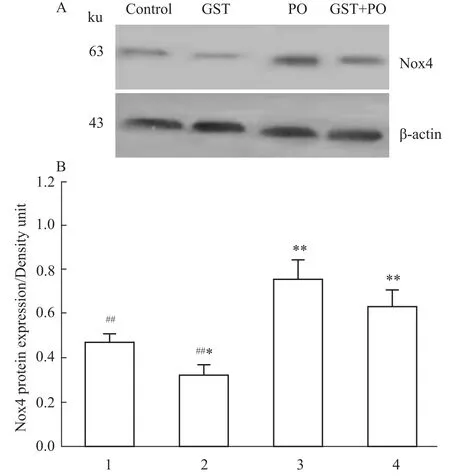
Fig 4 Western blot results show the effects of genistein and paraoxon on the expression of Nox4 protein in rat thoracic aorta rings(±s,n=3)
3 讨论
心血管疾病目前已成为影响人类健康的头号疾病,其发病机制和病理过程各异,已经证实血管内皮损伤与心血管疾病的发展密切相关。血管内皮细胞可合成、分泌多种生物活性物质,参与调节血管紧张度、维持血管正常的舒缩功能。血管内皮细胞损伤导致细胞功能障碍、血管正常舒缩功能受损,诱发一系列病理性应激反应的产生。很多心血管疾病的早期诱因均牵涉到血管内皮损伤、血管舒缩功能异常。
有机磷酸酯类(OPs)化合物是目前广泛使用的一类农药,OPs侵入机体后,在体内经肝脏P450系统代谢为具有生物活性的PO。少量的PO可进一步被PON1水解失活,随尿液排出体外。但长期或大量接触OPs,可导致机体PON1浓度及活性降低[10],PO水解排出减少。PON1具有抗氧化作用,可抑制血浆氧化物形成并清除血浆氧化物。体内PO的蓄积可诱发氧化应激,损伤血管内皮,诱发心血管疾病。已有研究表明[11],给兔长期灌胃敌百虫,可降低兔血清及肝PON1的活性,加速兔动脉粥样硬化的形成;Prozorovskiǐ等[12]研究也发现OPs可导致内皮细胞变形,并损伤内皮细胞功能;李鹏等[13]实验表明,对氧磷(0.036 3~36.3 μmol·
L-1)与人脐静脉内皮细胞(HUVEC)及血管组织共孵30 min,浓度和时间依赖性地增加了单层内皮细胞的通透性,内皮细胞活力下降,细胞萎缩;大鼠血管组织及细胞培养液中丙二醛(MDA)的含量增高、SOD活性降低、一氧化氮(NO)含量减少,血管内皮细胞损伤;且PO可浓度依赖性及时间依赖性抑制血管内皮依赖性舒张功能。
本实验室前期实验证实了PO可浓度依赖性(0.004 05~40.5 μmol·L-1)抑制大鼠胸主动脉EDR功能[4]。但PO损伤内皮细胞导致心血管疾病的发生除了与其直接毒性刺激作用及抑制机体抗氧化酶活性有关外,是否还涉及到内皮细胞ROS生成的主要酶体——NADPH氧化酶,目前尚未见报道。本实验通过建立大鼠胸主动脉PO损伤模型,检测NADPH氧化酶在血管组织中的2个主要亚基p22phox、Nox4的表达情况,发现PO能够上调p22phox、Nox4 mRNA及蛋白的表达。从机体ROS的产生途径初步探讨了PO造成血管内皮损伤的另一可能机制。
目前,实验室研究、临床试验、流行病学统计均表明摄入GST可降低心血管疾病发病率。大量研究资料表明GST具有确切的抗炎、抗氧化、保护血管内皮、维持血管正常的舒缩功能的作用[14]。GST可直接作用于血管平滑肌,浓度依赖性地降低氯化钾(KCl)诱导的血管收缩[15-16]。文献报道[17],连续给予♂糖尿病大鼠GST 31 d,发现在内皮完整的血管环,GST组对KCl、PE诱导的收缩反应明显低于糖尿病组;对ACh诱导的舒张反应明显高于糖尿病组。本实验室早期的实验也发现GST可明显抑制PO导致的血管EDR功能损伤[4]。所有这些证据均表明GST调节血管紧张度,保护血管内皮,进而改善血管内皮依赖性舒张功能。
关于GST保护心血管系统的相关机制众多。GST可降低鼠血浆中TC、LDL-C、TC/HDL-C[10,18],减轻血管结构与功能的损伤;同时,GST也可抑制TNF-α的下游因子NF-κB表达[19],快速激活p38β丝裂原蛋白激酶[20],进而对抗TNF-α诱导的内皮细胞损伤及编程性细胞死亡。然而,GST的抗氧化作用是其保护心血管系统的主要作用机制之一。研究发现,GST可升高机体SOD的活性、GSH水平,并上调GSH-Px的水平和活性,增强机体抗氧化水平[8];Vera等[21]发现,长期给予自发性高血压大鼠GST,可抑制NADPH氧化酶活性,降低ROS的产生,改善血管内皮功能紊乱;Xu等[9]也发现GST可下调大鼠p22phox亚基的表达,抑制ROS的产生。但GST对内皮细胞上NADPH氧化酶另一重要的亚基Nox4表达的影响,目前尚未见报道。本研究通过用100 μmol·L-1GST处理大鼠胸主动脉后,观察血管组织中p22phox、Nox4表达的情况,发现GST可下调p22phox、Nox4的表达。
本实验室前期实验已发现,GST与PO共同预处理血管环后,血管环EDR功能较PO单独处理血管环有了明显改善[4],GST与PO对p22phox、Nox4表达的相反的调节作用是否可以解释这一现象?GST是否可通过下调内皮细胞上NADPH氧化酶相关亚基p22phox、Nox4的表达这一途径来拮抗PO诱导的内皮细胞氧化损伤?本课题从离体组织器官水平就这些问题展开实验,发现GST可拮抗PO诱导的大鼠胸主动脉组织p22phox表达上调。对于PO诱导的Nox4表达的上调,GST具有一定拮抗效应,但该效应并不明显。这可能涉及p22phox、Nox4亚基对PO、GST的敏感性不同,Nox4对PO更为敏感;也可能涉及离体模型(大鼠胸主动脉)的建模时间及建模条件等多方面的原因。
综上所述,通过对PO与GST对血管内皮的作用及其可能机制的初探性研究,为有机磷酸酯类农药诱发心血管疾病发生的机制及GST对此类疾病可能的防治提供理论参考及实验依据。
(致谢:本文实验部分在南华大学药物药理研究所完成。在此衷心感谢导师黄红林教授及药物药理研究所全体老师、同学对本实验工作的关心、支持和帮助!)
参考文献:
[1] Garrido-Urbani S,Jaquet V,Imhof B A.ROS and NADPH oxi-dase:key regulators of tumor vascularisation[J].Med Sci(Par-is),2014,30(4):415-21.
[2] Martyn K D,Frederick L M,von Loehneysen K,et al.Functional analysis of Nox4 reveals unique characteristics compared to other NADPH oxidases[J].Cell Signal,2006,18(1):69-82.
[3] Laurindo F R,Araujo T L,Abraho T B.Nox NADPH oxidases and the endoplasmic reticulum[J].Antioxid Redox Signal,2014,20(17):2755-75.
[4] 刘玉玲,饶志威,李 震,等.染料木素对对氧磷损伤大鼠胸主动脉内皮依赖性舒张功能的保护作用[J].国际病理科学与临床杂志,2011,31(6):471-5.
[4] Liu Y L,Rao Z W,Li Z,et al.Protective effect of genistein on damages of paraoxon-induced endothelium-dependent relaxation in the rat thoracicaorta[J].Int J Pathol Clin Med,2011,31(6):471 -5.
[5] Erba D,Casiraghi M C,Martinez-Conesa C,et al.Isoflavone sup-plementation reduces DNA oxidative damage and increases O-β-N-acetyl-D-glucosaminidase activity in healthy women[J].Nutr Res,2012,32(4):233-40.
[6] Wu H J,Chan W H.Genistein protects methylglyoxal-induced ox-idative DNA damage and cell injury in human mononuclear cells [J].Toxicol In Vitro,2007,21(3):335-42.
[7] Liu H,Zhang C,Zeng W.Estrogenic and antioxidant effects of a phytoestrogen daidzein on ovarian germ cells in embryonic chickens [J].Domest Anim Endocrin,2006,31(3):258-68.
[8] 季莉莉,周 虹,李贤标,张玉梅.大豆异黄酮对动脉硬化大鼠的抗氧化作用研究[J].中国预防医学杂志,2006,7(1):1-4.
[8] Ji L L,Zhou H,Li X B,Zhang Y M.Effect of soy isoflavones on anti-oxidative enzyme and lipid peroxide in rat[J].China Prev Med,2006,7(1):1-4.
[9] Xu J W,Ikeda K,Yamori Y.Genistein inhibits expressions of NADPH oxidase p22phox and angiotensin II type 1 receptor in aor-tic endothelial cells from stroke-prone spontaneously hypertensive rats[J].Hypertens Res,2004,27(9):675-83.
[10]赵绿英,刘玉玲,李金兰,等.染料木素对大鼠食饵性高脂血症PON1及CRP的影响[J].中国药理学通报,2012,28(4):567 -72.
[10]Zhao L Y,Liu Y L,Li J L,et al.Effect of genistein on paraoxo-nase and C-reactive protein of the rats with food-induced hyperlipi-demia[J].Chin Pharmacol Bull,2012,28(4):567-72.
[11]熊小明,周寿红,胡 敏,刘立英.敌百虫加重高脂饮食致兔动脉粥样硬化作用与降低对氧磷酶活性有关[J].中国动脉硬化杂志,2009,17(3):172-6.
[11]Xiong X M,Zhou S H,Hu M,Liu L Y.Effect of organophospho-rus insecticide to aggravate hyperlipidemic diet inducing athero-sclerosis ralated to decrease of paraoxonase activity in rabbits[J].Chin J Arterioscler,2009,17(3):172-6.
[12]Prozorovskiǐ V B,Skopichev V G.Finding cholinesterase in endo-theliocytes:cholinesterase inhibition by organophosphorus com-pounds leads to endotheliocyte deformation[J].Eksp Klin Farma-kol,2005,68(3):64-7.
[13]李 鹏,刘立英,周寿红,吴树金.对氧磷对血管内皮细胞的损伤作用及机制探讨[J].中国动脉硬化杂志,2007,15(9):666 -70.
[13]Li P,Liu L Y,Zhou S H,Wu S J.Paraoxon-induced injuries of vascular endothelial cell and exploration of potential mechanisms [J].Chin J Arterioscler,2007,15(9):666-70.
[14]Zhou X,Yuan L,Zhao X,et al.Genistein antagonizes inflamma-tory damage induced by β-amyloid peptide in microglia through TLR4 and NF-κB[J].Nutrition,2014,30(1):90-5.
[15]Je H D,Sohn U D.Inhibitory effect of genistein on agonist-in-duced modulation of vascular contractility[J].Mol Cells,2009,27(2):191-8.
[16]Seok Y M,Baek I,Kim Y H,et al.Isoflavone attenuates vascular contraction through inhibition of the RhoA/Rho-Kinase signaling pathway[J].J Pharmacol Exp Ther,2008,326(3):991-8.
[17]Baluchnejadmojarad T,Roghani M.Chronic administration of genistein improves aortic reactivity of streptozotocin-diabetic rats:mode of action[J].Vascul Pharmacol,2008,49(1):1-5.
[18]Ae Park S,Choi M S,Cho S Y,et al.Genistein and daidzein modulate hepatic glucose and lipid regulating enzyme activities in C57BL/KsJ-db/db mice[J].Life Sci,2006,79(12):1207-13.
[19]Li H Q,Luo Y,Qiao C H.The mechanisms of anticancer agents by genistein and synthetic derivatives of isoflavone[J].Mini Rev Med Chem,2012,12(4):350-62.
[20]Si H,Liu D.Isoflavone genistein protects human vascular endo-thelial cell against tumor necrosis factor-alpha-induced apoptosis through the p38beta mitogen-activated protein kinase[J].Apopto-sis,2009,14(1):66-76.
[21]Vera R,Sánchez M,Galisteo M,et al.Chronic administration of genistein improves endothelial dysfunction in spontaneously hyper-tensive rats:involvement of eNOS,caveolin and calmodulin ex-pression and NADPH oxidase activity[J].Clin Sci,2007,112 (3):183-91.
Genistein antagonizes paraoxon-induced high expressions of NADPH oxidase p22phox and Nox4 in rat thoracic aorta tissues
LIU Yu-ling1,2,WANG Yu-hua1,ZHANG Xiu-qin1,LI Dong-hua1,HUANG Hong-lin1
(1.Learning Key Laboratory for Pharmacoproteomics of Hunan Province,Institute of Pharmacy and Pharmacology,University of South China,Hengyang Hunan 421001,China;2.Loudi Health School,Loudi Hunan 417000,China)
Abstract:Aim To investigate whether genistein pro-tects paraoxon-induced vascular endothelial dysfunction through down-regulating p22phox and Nox4 expressions as well as inhibiting the generation of ROS.Methods
In this study,thoracic aortas were isolated from the male Sprague-Dawley(SD)rats and were divided into the following groups:①control group,the thoracic a-ortas were incubated with dimethyl sulfoxide(DMSO,0.1%)for 30 min;②genistein group,the thoracic a- ortas were incubated with genistein(100 μmol·L-1)for 30 min;③paraoxon group,the thoracic aortas were incubated with paraoxon at the concentration of 40.5 μmol·L-1for 30 min;④paraoxon plus genistein groups,the thoracic aortas were incubated with paraoxon(40.5 μmol·L-1)plus genistein(100 μmol·L-1)for 30 min.The expressions of p22phox and Nox4 mRNA were detected by RT-PCR and the protein expressions of p22 phox and Nox4 were detected
by Western blot.Results Compared with the control group,the expressions of p22phox and Nox4 were markedly increased in the paraoxon group.In the genistein group,the expressions of p22phox and Nox4 were significantly repressed.When treated with genistein plus paraoxon,there was a marked increase in the expression of Nox4(P<0.05),but no signifi-cant difference in the expression of p22phox.The ex-pression of p22phox in the paraoxon plus genistein group was significantly decreased(P<0.05)as com-pared with paraoxin group,but there was no significant difference in the expression of Nox4.Conclusion Paraoxon may result in oxidative damage of vascular endothelium through up-regulating p22phox and Nox4 expressions,genistein may down-regulate the expres-sions of both and protect vascular endothelium.
Key words:genistein;paraoxon;oxidative damage;NADPH oxidase;p22phox;Nox4
作者简介:刘玉玲(1978-),女,硕士,主管药师,讲师,研究方向:心血管药理学,E-mail:18373822991@163.com;黄红林(1963-),女,教授,硕士生导师,研究方向:心血管药理学,通讯作者,E-mail:huanghonglinhui@aliyun.com
基金项目:湖南省十二五重点学科建设项目;湖南省中医药管理局重点项目资助(No 201314)
收稿日期:2015-05-02,修回日期:2015-06-10
文献标志码:A
文章编号:1001-1978(2015)09-1292-07
doi:10.3969/j.issn.1001-1978.2015.09.022
