拟黑多刺蚁醇提物抗抑郁作用研究
2015-02-26韦桂宁楚世峰苏启表卢文杰陆国寿黄周锋曾宪彪韦宝伟陈乃宏
韦桂宁,楚世峰,苏 华,何 飞,苏启表,卢文杰,陆国寿,黄周锋,谭 晓,林 霄,曾宪彪,韦宝伟,陈乃宏
(1.广西中医药研究院药理所,广西南宁 530022;2.湖南中医药大学中医学院,湖南长沙 410208;3.广东药学院健康学院,广东广州 510006,4.湖南中医药大学药学院,湖南长沙 410208)
拟黑多刺蚁醇提物抗抑郁作用研究
韦桂宁1,楚世峰2,苏 华1,何 飞1,苏启表3,卢文杰1,陆国寿1,黄周锋1,谭 晓1,林 霄1,曾宪彪1,韦宝伟1,陈乃宏4
(1.广西中医药研究院药理所,广西南宁 530022;2.湖南中医药大学中医学院,湖南长沙 410208;3.广东药学院健康学院,广东广州 510006,4.湖南中医药大学药学院,湖南长沙 410208)
中国图书分类号:R-332;R284.1;R384.9;R971.43
摘要:目的 观察拟黑多刺蚁醇提物抗抑郁作用,并对其作用机制进行初步分析。方法 拟黑多刺蚁醇提物通过乙醇提取得到。采用悬尾试验、强迫游泳试验等行为绝望模型和利血平诱导的抑郁模型观察拟黑多刺蚁醇提物抗抑郁作用。结果 拟黑多刺蚁醇提物8、4 g·kg-1剂量组均能明显缩短小鼠在TST和FST的悬尾不动时间和游泳不动时间(P<0.05);拟黑多刺蚁醇提物8 g·kg-1剂量组可提高抑郁症大鼠体温和糖水摄取量(P<0.05);拟黑多刺蚁醇提物8、2 g ·kg-1剂量组可拮抗利血平大鼠眼睑下垂,减少运动不能时间(P<0.05,P<0.01);拟黑多刺蚁醇提物8 g·kg-1可明显提高抑郁症大鼠血清、海马组织、大脑皮层的5-羟色胺、去甲肾上腺素水平及超氧化物歧化酶的活性(P<0.05);拟黑多刺蚁醇提物对所述正常组各指标无影响。结论 拟黑多刺蚁醇提物具有明显的抗抑郁作用,可能通过对神经递质代谢及对神经细胞抗氧化作用的调节来实现。
关键词:拟黑多刺蚁;抑郁;作用机制;5-羟色胺;去甲肾上腺素;超氧化物歧化酶
网络出版时间:2015-8-10 14:37 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150810.1437.020.html
抑郁症是一种以明显而持久的心境低落为主要特征的情感性精神障碍综合征,主要临床表现为情绪低落,运动迟缓,内疚、自责自罪,很严重状态下会有轻生、自杀倾向等症。近年来,抑郁症的发病率呈上升趋势,严重威胁患者的健康,影响到家庭和社会的和谐[1-2]。抑郁症的发病机制复杂,发生机制至今不明。生物胺假说是最具代表性的假说之一,即抑郁的发生与脑内去甲肾上腺素和五羟色胺等单胺水平低下密切相关,阻断特定单胺的重摄取进入神经末鞘、抑制MAO增加单胺存储与释放、阻断突触前膜α2自身受体增加单胺递质释放,可明显改善抑郁症状。
拟黑多刺蚁(Polyrhachis vicina Roger),也称拟黑多翅蚁。味咸、酸,性平;归肝、肾经;具补肾益精,通经活络,解毒消肿之功效;主治肾虚头晕耳鸣,失眠多梦,阳痿遗精,风湿痹痛,中风偏瘫,手足麻木,红斑狼疮,毒蛇咬伤等症。拟黑多刺蚁全身含有多种氨基酸、维生素及微量元素等多种营养成分,号称“动物营养宝库”。拟黑多刺蚁作为药食两用的昆虫类药材,长期以来,多用米酒制成酒剂,广泛用于保健或治疗类风湿性关节炎等疾病。在我们的相关实验中,拟黑多刺蚁的醇提取物具有抗痛风作用,疗效与乙醇的浓度有关,醇提物主要以脂肪酸为主,特别是不饱和脂肪酸[3-4]。根据民间的临床使用经验,我们对拟黑多刺蚁的提取物进行抗抑郁研究,初步的结果表明,拟黑多刺蚁的醇提物具有抗抑郁作用,且也与乙醇的浓度有关,95%乙醇的提取物效果最佳。
鉴于抑郁症的高发病率、高危害性,目前缺乏安全有效抗抑郁药物的现状,结合拟黑多刺蚁药性及其现代研究进展,本研究考察了黑蚂蚁95%乙醇的醇提物的抗抑郁作用,以期为其作为抗抑郁药物的应用提供实验基础。
1 材料
1.1药物与药品 拟黑多刺蚁醇提物(Ethyl alco-hol extract of Polyrhachis vicina Roger,EAPR),由广西中医药研究院药理所提供。利血平注射液,天津金耀氨基酸有限公司,批号:1203241;盐酸氟西汀胶囊,礼来苏州制药有限公司,批号:1037A;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒,南京建成生物工程研究所,批号:20140118;丙二醛(malon-dialdehyde,MDA)试剂盒,南京建成生物工程研究
所,批号:20140117;5-羟色胺(5-hydroxytryptamine,5-HT)试剂盒,Cusabio Biotech CO.,LTD,批号:C0601800187;去甲肾上腺素(noradrenaline,NA)试剂盒,Cusabio Biotech CO.,LTD,批号:B18011310。
1.2动物 昆明种小鼠,8周龄,体质量18~22 g,SPS级;Wistar大鼠,9周龄,体质量180~220 g,SPS级,均由广西医科大学实验动物中心提供,动物质量合格证证号:SCXK桂2009-0002。动物观察室:温度25℃±1℃,相对湿度60%±10%。
1.3主要仪器 13960型iMark酶标仪(Japan Bio-rad公司);TDL-5000B型低速冷冻离心机(上海安亭科学仪器厂);FA1004电子天平(上海精科天平仪器厂)。
2 方法
2.1EAPR溶液制备 取拟黑多刺蚁粉1 000 g,用95%乙醇浸泡,水浴回流提取3次,合并回流液,水浴浓缩至无醇味,得178 g棕褐色稠膏(得膏率为17.8%)。用吐温-80乳化,配成所需的浓度,其中吐温-80含量为0.3%。
2.2悬尾实验 (tail suspension test,TST)采用昆明种♂小鼠,体质量18~22 g,每组10只。分别为对照组、阳性对照药氟西汀组(3.6 mg·kg-1)、EA-PR高、中、低剂量组(分别相当于药材8、4、2 g·
kg-1,下同)。对照给予同等体积的含0.3%吐温-80的蒸馏水,各组均连续灌胃(ig)给药10 d,末次给药1 h后测试。测试方法如下。
参照文献[5-6]的方法,将单个小鼠尾端(在距尾尖部约2cm处)用医用胶布粘于悬尾箱(30 cm×30 cm×25 cm)上部支架上,使成倒挂状态,头部离箱底约5 cm。悬挂时间为6 min,统计后4 min内累计不动时间(不动状态即小鼠停止挣扎不动或无任何活动)。
2.3强迫游泳实验 (forced swimming,FST)采用♂昆明小鼠,体质量18~22 g,分组、给药同“2.2”。测试方法如下。
参考文献[5-6]报道的方法,将小鼠单独放人高20 cm、直径14 cm的圆柱形玻璃缸中,缸内水深10 cm,水温25℃±2℃,从小鼠入水后计时6 min,记录后4 min内游泳累计不动时间(指小鼠在水中停止挣扎,或显示漂浮状态,仅有微小的肢体运动以保持头部浮在水面)。
2.4EAPR对利血平引起的抑郁症大鼠的影响[5-6]
2.4.1动物分组与处理 ♂Wistar大鼠70只,体质量180~220 g,喂养适应1周后,按空腹体重随机分为7组,即对照组、模型组(利血平组)、阳性药氟西汀+利血平组、EAPR高剂量组+利血平组、EA-PR低剂量+利血平组,EAPR高剂量组、EAPR低剂量组,每组10只,组间体重水平无明显差异,每周记录体重1次,根据体重给药。空白对照组大鼠每天腹腔注射生理盐水0.5 ml·kg-1,其余各组大鼠每天腹腔注射利血平0.5 mg·kg-1造模,通过运动抑制观察确定模型成功后,改生理盐水及利血平隔天腹腔注射0.25 mg·kg-1维持模型,连续10 d。各组开始造模起,阳性药氟西汀组给予氟西汀1.8 mg· kg-1,EAPR高剂量+利血平组给予EAPR 8.0 g· kg-1,EAPR低剂量+利血平组给予EAPR 2.0 g· kg-1,EAPR高剂量给予EAPR 8.0 g·kg-1,EAPR低剂量组给予EAPR 2.0 g·kg-1,每天1次。
2.4.2对体温、上睑下垂、运动抑制的影响 于实验d 10时记录肛门体温值,记录各组大鼠上睑下垂、运动抑制等情况。上睑下垂观察时,将大鼠放在支架上,观察大鼠眼睑不能睁开1/2的动物只数,计算对抗率,对抗率/%=(1-上睑下垂大鼠/组内动物总数)×100%;运动抑制观察时,将动物放于直径40 cm的圆形白板的中心位置观察30 s,观察不同组中大鼠呆在圈内的时间。
2.4.3对糖水摄入量的影响 于实验的d 8,首先给予大鼠质量分数为1%的蔗糖溶液,预适应24 h后,大鼠禁食禁水12 h,之后每只大鼠单笼饲养给予两只相同的水平,分别装有质量分数为1%的蔗糖水和正常饮用水,统计1 h内大鼠摄入的蔗糖溶液和饮用水量,计算出蔗糖消耗百分比[蔗糖消耗百分比=蔗糖溶液摄入量/(蔗糖溶液摄入量+饮用水摄入量)]。
2.4.4对血清、大脑皮层、海马中5-HT、NA、SOD、MDA的影响 腹主动脉取血,离心取血清。处死后取脑组织,即刻分离皮层组织与海马组织,-70℃冻存,检测前加生理盐水制备组织匀浆液。检测血清、海马组织和大脑皮层中5-HT、NA、SOD、MDA水平。
2.5统计学方法 统计学分析采用SPSS 16.0统计软件,实验结果以±s表示,各组间采用One-way ANOVA进行统计学分析。
3 结果
3.1EAPR对小鼠TST不动时间的影响 与对照组比较,EAPR(8、4 g·kg-1)连续ig给予小鼠10 d,均可明显缩短悬尾不动时间,差异有统计学意义(P <0.05,Tab 1)。
3.2EAPR对小鼠FST不动时间的影响 与对照组比较,EAPR(8、4 g·kg-1)连续ig给予小鼠10 d,
均可明显缩短游泳不动时间,差异有统计学意义(P <0.05)。结果如Tab 2。
Tab 1 Effect of EAPR on murine immobility in TST of mice(±s,n=10)

Tab 1 Effect of EAPR on murine immobility in TST of mice(±s,n=10)
*P<0.05,**P<0.01 vs control animals
Group Immobility time/s Control 102.90±19.67 Fluoxetine(3.6mg·kg-1) 17.90±15.44**EAPR(8 g·kg-1) 67.90±41.08*EAPR(4 g·kg-1) 70.50±40.77*EAPR(2 g·kg-1)78.60±51.57
Tab 2 Effect of EAPR on murine immobility in FST of mice(±s,n=10)

Tab 2 Effect of EAPR on murine immobility in FST of mice(±s,n=10)
*P<0.05,**P<0.01 vs control animals
Group Immobility time/s Control 65.33±38.38 Fluoxetine(3.6mg·kg-1) 22.89±20.94**EAPR(8 g·kg-1) 29.11±28.89*EAPR(4 g·kg-1) 31.89±25.58*EAPR(2g·kg-1)65.56±40.72
3.3EAPR对利血平诱导的抑郁症大鼠的影响
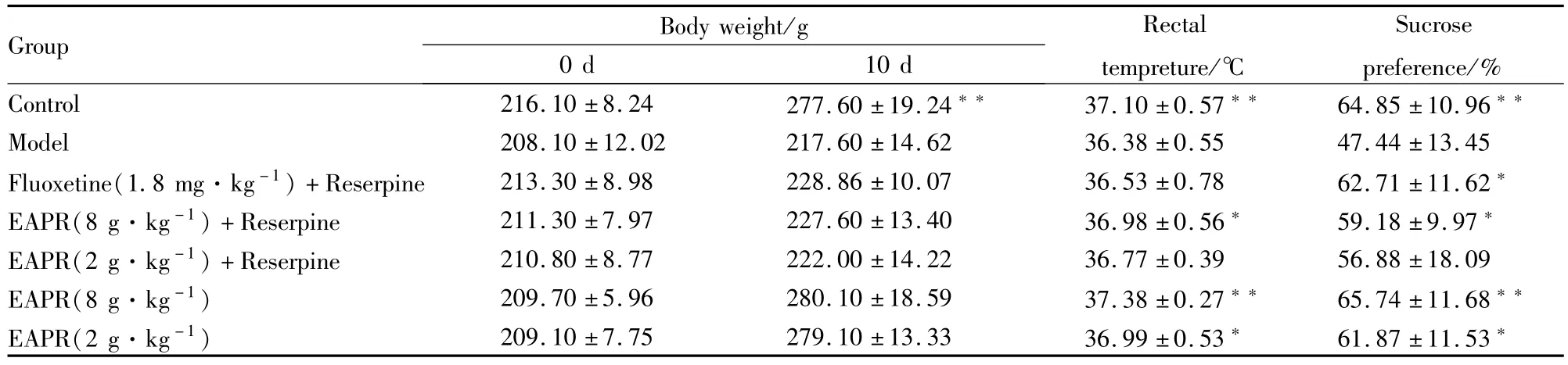
3.3.1EAPR对利血平诱导的抑郁症大鼠体重、体温和糖水消耗的影响 在造模前各组大鼠的体重差异无统计学意义;从给药开始至实验结束前,利血平诱导的抑郁症大鼠各组大鼠体重与对照组相比,体重均下降,差异有统计学意义(P<0.01)。开始给予利血平腹腔注射各组大鼠肛温有所下降,且差异有统计学意义(P<0.01);至实验结束前,EAPR 8.0 g·kg-1+利血平组抑郁大鼠肛温有所回升,差异有统计学意义(P<0.05);EAPR 8.0 g·kg-1+利血平组抑郁大鼠糖摄取量明显提高,差异有统计学意义(P<0.05),EAPR对正常大鼠体重、体温和糖水消耗无明显影响(Tab 3)。
3.3.2EAPR对抑郁症大鼠行为学的影响 末次利血平腹腔注射及给药后12 h,空白对照组大鼠没有眼睑下垂现象;模型组有8只出现眼睑下垂,与空白对照组相比差异有统计学意义(P<0.01);氟西汀组有3只出现眼睑下垂,与模型组相比差异有统计学意义(P<0.01);EAPR 8.0 g·kg-1+利血平组、EAPR 2.0 g·kg-1+利血平组分别有4只、2只出现眼睑下垂,与模型组相比差异有统计学意义(P <0.01)。末次利血平腹腔注射及给药后1 h后,和对照组比较,圈内保留时间明显增高,差异有统计学意义(P<0.01);和模型组比较,EAPR 8.0 g·kg-1+利血平组、EAPR 2.0 g·kg-1+利血平组圈内保留时间明显减少,差异有统计学意义(P<0.01);EAPR对正常大鼠圈内保留时间和对抗率均无明显影响(Tab 4)。
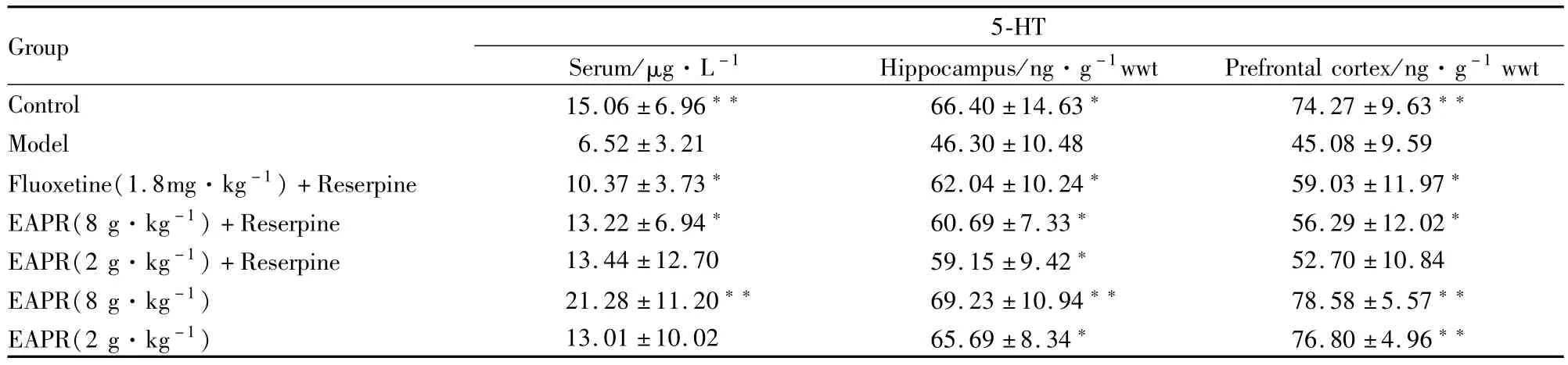
3.3.3EAPR对抑郁症大鼠血清、海马组织和大脑皮层中5-HT水平的影响 与对照组比较,模型组大鼠血清、海马组织和大脑皮层中5-HT水平明显下降,差异有统计学意义(P<0.01);与模型组相比,EAPR 8.0 g·kg-1+利血平组抑郁大鼠血清、海马组织和大脑皮层5-HT水平明显增高,差异有统计学意义P<0.05);EAPR对正常大鼠海马组织和大脑皮层5-HT水平无明显影响(Tab 5)。
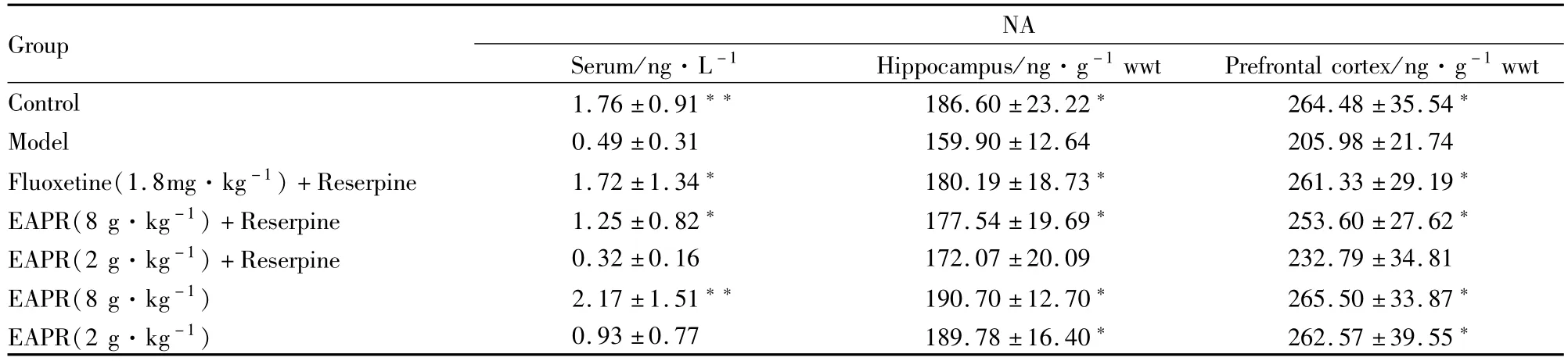
3.3.4EAPR对抑郁症大鼠血清、海马组织和大脑皮层中NA水平的影响 与对照组比较,模型组大鼠血清、海马组织和大脑皮层中NA水平明显下降,差异有统计学意义(P<0.01);与模型组相比,EA-PR 8.0 g·kg-1+利血平组抑郁大鼠血清、海马组织和大脑皮层NA水平明显增高,差异有统计学意义P<0.05);EAPR对正常大鼠海马组织和大脑皮层NA水平无明显影响(Tab 6)。
Tab 3 Effect of EAPR on body weight,rectal temperature and sugar water intake of depression rats(±s,n=10)
Tab 3 Effect of EAPR on body weight,rectal temperature and sugar water intake of depression rats(±s,n=10)
*P<0.05,**P<0.01 vs model animals
Group Body weight/g 0 d 10 d Rectal tempreture/℃Sucrose preference/% Control 216.10±8.24 277.60±19.24 37.10±0.57 64.85±10.96**Model 208.10±12.02 217.60±14.62 36.38±0.55 47.44±13.45 Fluoxetine(1.8 mg·kg-1)+Reserpine 213.30±8.98 228.86±10.07 36.53±0.78 62.71±11.62*EAPR(8 g·kg-1)+Reserpine 211.30±7.97 227.60±13.40 36.98±0.56 59.18±9.97*EAPR(2 g·kg-1)+Reserpine 210.80±8.77 222.00±14.22 36.77±0.39 56.88±18.09 EAPR(8 g·kg-1) 209.70±5.96 280.10±18.59 37.38±0.27 65.74±11.68**EAPR(2 g·kg-1) 209.10±7.75 279.10±13.33 36.99±0.53 61.87±11.53*
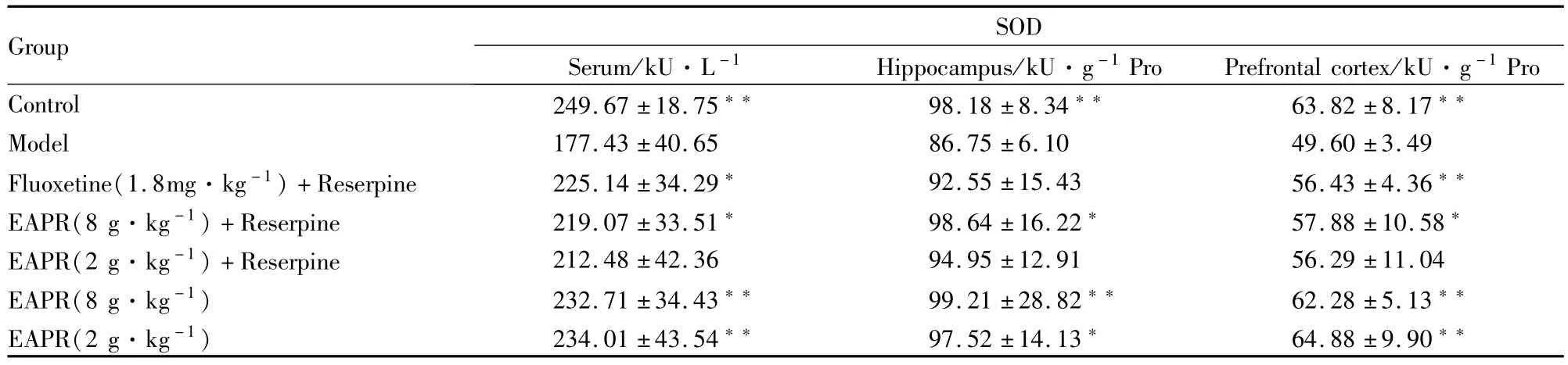
3.3.5EAPR对抑郁症大鼠血清、大脑皮层、海马组织等的SOD的活性的影响 与对照组比较,在连续给大鼠腹腔注射0.5 mg·kg-1利血平注射液以后,血清、大脑皮层、海马组织等的SOD的活性明显降低,差异有统计学意义(P<0.05)。和模型组比较,EAPR 8.0 g·kg-1+利血平组的血清、大脑皮层、海马组织SOD的活性明显提高,差异有统计学
意义(P<0.05);EAPR对正常大鼠血清、大脑皮层、海马组织SOD的活性无明显影响(Tab 7)。
Tab 4 Effect of EAPR on akinesia of depression rats(±s,n=10)

Tab 4 Effect of EAPR on akinesia of depression rats(±s,n=10)
*P<0.05,**P<0.01 vs model animals
Group Rest time/s Control 5.44±1.59**Model 28.30±2.91 Fluoxetine(1.8mg·kg-1)+Reserpine 23.90±5.76*EAPR(8 g·kg-1)+Reserpine 22.60±7.89*EAPR(2 g·kg-1)+Reserpine 23.50±8.44 EAPR(8 g·kg-1) 5.80±2.78**EAPR(2 g·kg-1) 4.11±2.62**
3.3.6EAPR对抑郁症大鼠血清血清、大脑皮层、海马组织等的MDA的活性的影响 与对照组比较,在连续给大鼠腹腔注射0.5 mg·kg-1利血平注射液以后,血清、大脑皮层、海马组织等的MDA水平无明显影响,差异没有统计学意义(P>0.05)。和模型组比较,EAPR各剂量组对血清、大脑皮层、海马组织MDA的水平无明显影响,差异没有统计学意义(P>0.05,Tab 8)。
4 讨论
TST、FST是两种种经典而又能快速评价抗抑郁药物药效的方法。TST利用小鼠悬尾后企图逃脱但又无法逃脱,从而放弃挣扎,进入特有的抑郁不动状态;FST通过将实验动物置于一个局限的环境中(如水中),动物在该环境中拼命挣扎试图逃跑又无法逃脱,从而提供了一个无可回避的压迫环境,一段时间的实验后,动物即表现出典型的“不动状态”,反映“行为绝望状态”。拟黑多刺蚁醇提物可缩短TST和FST小鼠悬尾不动时间和游泳不动时间,显示出良好的抗抑郁作用。TST、FST涉及神经中枢5-HT、NA系统的敏感性[7-8],因此拟黑多刺蚁醇提物抗抑郁作用,可能与神经中枢的5-HT、NA调节系统有关。
Tab 5 Effect of EAPR on the concentration of 5-HT in serum,hippocampus and prefrontal cortex of depression rats(±s,n=10)
Tab 5 Effect of EAPR on the concentration of 5-HT in serum,hippocampus and prefrontal cortex of depression rats(±s,n=10)
*P<0.05,**P<0.01 vs model animals
Group 5-HT Serum/μg·L-1 Hippocampus/ng·g-1wwt Prefrontal cortex/ng·g-1wwt Control 15.06±6.96 66.40±14.63 74.27±9.63**Model 6.52±3.21 46.30±10.48 45.08±9.59 Fluoxetine(1.8mg·kg-1)+Reserpine 10.37±3.73 62.04±10.24 59.03±11.97*EAPR(8 g·kg-1)+Reserpine 13.22±6.94 60.69±7.33 56.29±12.02*EAPR(2 g·kg-1)+Reserpine 13.44±12.70 59.15±9.42 52.70±10.84 EAPR(8 g·kg-1) 21.28±11.20 69.23±10.94 78.58±5.57**EAPR(2 g·kg-1) 13.01±10.02 65.69±8.34 76.80±4.96**
Tab 6 Effect of EAPR on the concentration of NA in serum,hippocampus and prefrontal cortex of depression rats(±s,n=10)
Tab 6 Effect of EAPR on the concentration of NA in serum,hippocampus and prefrontal cortex of depression rats(±s,n=10)
*P<0.05,**P<0.01 vs model animals
Group NA Serum/ng·L-1 Hippocampus/ng·g-1wwt Prefrontal cortex/ng·g-1wwt Control 1.76±0.91 186.60±23.22 264.48±35.54*Model 0.49±0.31 159.90±12.64 205.98±21.74 Fluoxetine(1.8mg·kg-1)+Reserpine 1.72±1.34 180.19±18.73 261.33±29.19*EAPR(8 g·kg-1)+Reserpine 1.25±0.82 177.54±19.69 253.60±27.62*EAPR(2 g·kg-1)+Reserpine 0.32±0.16 172.07±20.09 232.79±34.81 EAPR(8 g·kg-1) 2.17±1.51 190.70±12.70 265.50±33.87*EAPR(2 g·kg-1) 0.93±0.77 189.78±16.40 262.57±39.55*
Tab 7 Effect of EAPR on the activity of SOD in serum,hippocampus and cerebral cortex of depression rat(±s,n=10)
Tab 7 Effect of EAPR on the activity of SOD in serum,hippocampus and cerebral cortex of depression rat(±s,n=10)
*P<0.05,**P<0.01 vs model animals
Group SOD Serum/kU·L-1 Hippocampus/kU·g-1Pro Prefrontal cortex/kU·g-1Pro Control 249.67±18.75 98.18±8.34 63.82±8.17**Model 177.43±40.65 86.75±6.10 49.60±3.49 Fluoxetine(1.8mg·kg-1)+Reserpine 225.14±34.29 92.55±15.43 56.43±4.36**EAPR(8 g·kg-1)+Reserpine 219.07±33.51 98.64±16.22 57.88±10.58*EAPR(2 g·kg-1)+Reserpine 212.48±42.36 94.95±12.91 56.29±11.04 EAPR(8 g·kg-1) 232.71±34.43 99.21±28.82 62.28±5.13**EAPR(2 g·kg-1) 234.01±43.54 97.52±14.13 64.88±9.90**
囊泡单胺转运体是重要的神经递质载体,将递质储存在囊泡中并运送到细胞膜表面,随后释放到
突触间隙。如果囊泡单胺转运体的形成、功能受到抑制或损害,突触前神经末梢产生的去甲肾上腺素、5-羟色胺、多巴胺等物质,在未受保护的情况下被细胞质中的MAO以及儿茶酚邻位甲基转移酶(COMT)代谢,因而永远无法到达突触后膜,使脑内NA、5-HT等神经递质耗竭可诱发抑郁症。利血平不可逆抑制囊泡单胺转运体,使脑内NA、5-HT等神经递质耗竭。在长期连续给大鼠腹腔注射利血平注射液后,大鼠出现体温下降、体重减轻、眼睑下垂、糖水摄取量下降、运动不能等抑郁表征,同时血清、海马组织、大脑皮层的NA、5-HT水平下降。拟黑多刺蚁醇提物可提高抑郁大鼠体温,提高糖水摄取量,逆转抑郁大鼠快感消失的症状,可拮抗利血平大鼠眼睑下垂、减少运动不能时间,恢复抑郁大鼠运动能力,明显提高血液、海马组织、大脑皮层的NA、5-HT水平,而对正常大鼠体温、体重、糖水摄取量、眼帘下垂、运动不能时间,血液、海马组织、大脑皮层的NA、5-HT水平无影响。提示拟黑多刺蚁醇提物可能通过调节体内NA、5-HT水平达到抗抑郁的作用。
Tab 8 Effect of EAPR on the activity of MDA in serum,hippocampus and cerebral cortex of depression rats(±s,n=10)
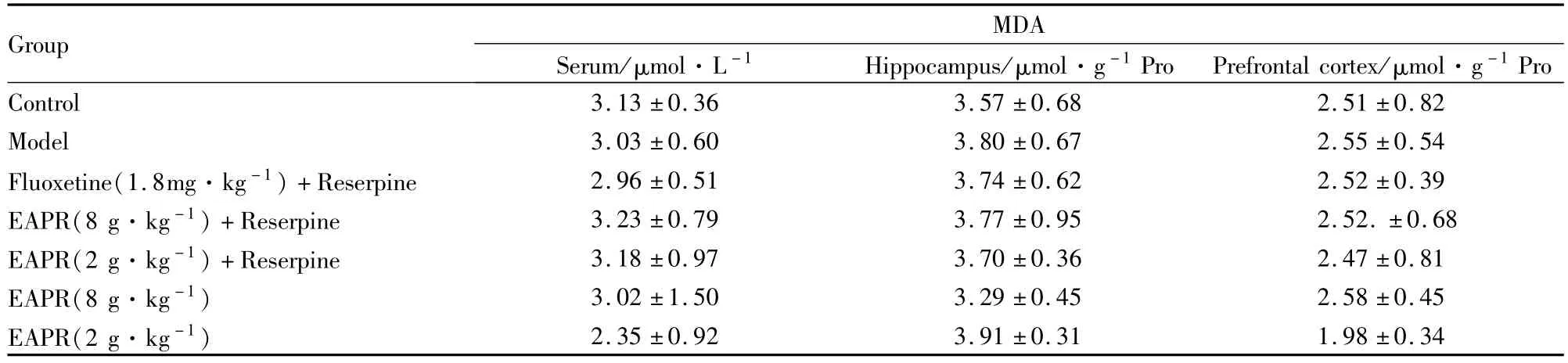
Tab 8 Effect of EAPR on the activity of MDA in serum,hippocampus and cerebral cortex of depression rats(±s,n=10)
Group MDA Serum/μmol·L-1 Hippocampus/μmol·g-1Pro Prefrontal cortex/μmol·g-1Pro Control 3.13±0.36 3.57±0.68 2.51±0.82 Model 3.03±0.60 3.80±0.67 2.55±0.54 Fluoxetine(1.8mg·kg-1)+Reserpine 2.96±0.51 3.74±0.62 2.52±0.39 EAPR(8 g·kg-1)+Reserpine 3.23±0.79 3.77±0.95 2.52.±0.68 EAPR(2 g·kg-1)+Reserpine 3.18±0.97 3.70±0.36 2.47±0.81 EAPR(8 g·kg-1) 3.02±1.50 3.29±0.45 2.58±0.45 EAPR(2 g·kg-1)2.35±0.92 3.91±0.31 1.98±0.34
海马、大脑皮层是与情绪行为和学习记忆功能密切相关的重要脑区,受到诸多病理因素的影响时,会受氧化应激影响。当发生重度抑郁时,下丘脑-垂体-肾上腺轴受到影响,使海马的毒素-皮质醇增多而阻止其神经元的再生[9-11]。研究表明,抑郁者的海马产生明显的病理学改变,包括体积减小,神经元变性、坏死,大脑或血清中的MDA的含量较正常组增高,SOD的活性下降[12-13]。拟黑多刺蚁醇提物可提高海马、皮层组织、血清的SOD的活性,说明黑多刺蚁醇提物能提高机体抗氧化能力,提高抑郁症大鼠机体清除自由基能力,减小细胞受损程度,保护神经细胞,最终缓解抑郁症状。这和我们先前的研究结果,黑多刺蚁醇提物可提高亚急性衰老小鼠海马和脑皮层组织SOD活性[14],有相似之处,显示出良好的抗氧化活性。
拟黑多刺蚁富含不饱和脂肪酸,以十八碳烯酸、十六碳烯酸为主。回瑞华等[15]研究表明,黑蚂蚁抗氧化的的IC%为0.43 g·L-1,当浓度为2.0 g·L-1时,抗氧化性为89.39%,具有较强的抗氧化性能。在我们的前期研究中发现,拟黑多刺蚁可提高亚急性衰老小鼠血清GSH含量,提高亚急性衰老小鼠海马和脑皮层组织SOD活力、提高脑皮层组织GSH含量水平[14]。最近报道ω-不饱和脂肪酸具有明显的抗抑郁作用[16-18]。虽然,我们还不能确定拟黑多刺蚁抗抑郁作用的物质基础是不饱和脂肪酸,但是基于抑郁症和氧化应激的关系,拟黑多刺蚁不饱和脂肪酸的药理活性值得我们关注。
抑郁症的发生机制至今不明,相关的神经递质包括5-HT、NA、DA为代表的单胺递质和以谷氨酸、γ-氨基丁酸、促糖皮质激素释放因子、细胞因子为代表的非单胺类递质,相关的细胞内信号通路包括cAMP-CREP通路、有丝分裂原激活的蛋白激酶通路、PKC信号通路、糖原合成酶激酶-3β、细胞存活通路等[19-24]。拟黑多刺蚁醇提物可使5-HT、NA水平升高趋于正常,同时增强机体抗氧化能力,对抑郁症起着明显的防治作用,提示黑多刺蚁醇提物对抑郁症的作用可能具有多靶点和多环节特征。黑多刺蚁醇提物复杂的作用机制和作用的物质基础,需要进一步研究。
[1] Wulsin L,Alterman T,Timothy Bushnell P P,et al.Revalence rates for depression by industry:a claims database analysis[J].Soc Psychiatry Psychiatr Epidemiol,2014,49(11):1805-21.
[2] 刘佳莉,苑玉和,陈乃宏.抑郁症的治疗研究进展[J].中国药理学通报,2011,27(9):1193-6.
[2] Liu J L,Yuan Y H,Chen N H.Advances in the treatment of de-pression[J].Chin Pharmacol Bull,2011,27(9):1193-6.
[3] 韦桂宁,苏启表,曾宪彪,等.拟黑多刺蚁乙醇提取物中降低小鼠血清尿酸水平活性部位的筛选与化学成分分析[J].中国药理学与毒理学杂志,2013,27(4):673-7.
[3] Wei G N,Su Q B,Zeng X B,et al.Screening and chemical compo-nent analysis of anti-hyperuricemic active fraction of ethanol extract from Polyrhachisvicina Roger in Guangxi in hyperuricemia model mice[J].Chin J Pharmacol Toxicol,2013,27(4):673-7.
[4] 韦桂宁,苏启表,曾宪彪,等.拟黑多刺蚁乙醇提取物石油醚部位抗痛风作用及物质基础研究[J].中药药理与临床,2013,29
(1):99-103.
[4] Wei G N,Su Q B,Zeng X B,et al.The study on the efficacy of the petroleum ether fraction of ethanol extracts of polyrhachisvicina Roger in the treatment of gout and the major constituents[J].Pharmacol Clin Chin Mater Med,2013,29(1):99-103.
[5] 黄 倩,楚世峰,张均田,等.人参皂苷Rgl的抗抑郁作用及对突触超微结构的影[J].中国药理学通报,2013,29(8):1124-7.
[5] Huang Q,Chu S F,Zhang J T,et al.Effects of Ginsenoside Rg1 on anti-depression and synaptic ultrastructure[J].Chin Pharmacol Bull,2013,29(8):1124-7.
[6] Lucyna A M,Agnieszka W,Edyta M,et al.Antidepressant-like effect of tetrahydroisoquinoline amines in the animal model of de-pressive disorder induced by repeated administration of a low dose of reserpine:behavioral and neurochemical studies in the rat[J].Neurotox Res,2014,26:85-98.
[7] Lambas-Senas L,Mnie-Filali O,Certin V,et al.Functional corre-lates for 5-HT(1A)receptors in maternally deprived rats displa-ying anxiety and depression-like behaviors[J].Prog Neuropsycho-pharmacol Biol Prosychiatry,2009,33(2):262-8.
[8] Shahzad N,Ahmad J,Khan W,et al.Interactions of atenolol with alprazolam/escitalopram on anxiety,depression and oxidative stress[J].Pharmacol Biochem Behav,2014,117:79-84.
[9] Bijanki K R,Hodis B,Brumm M C,et al.Hippocampal and left subcallosal anterior cingulate atrophy in psychotic depression[J].PLoS One,2014,9(10):e110770.
[10]Malkov A,Ivanov A I,Popova I,et al.Reactive oxygen species in-itiate a metabolic collapse in hippocampal slices:potential trigger of cortical spreading depression[J].J Cereb Blood Flow Metab,2014,34(9):1540-9.
[11]陈 姣,楚世峰,李 婧,等.FK560 binding protein 51参与糖皮质激素介导的抑郁样行为的发生[J].中国药理学通报,2014,30(3):407-12.
[11]Chen J,Chu S F,Li J,et al.FK506 binding protein 51 is involved in the depression-like behaviors induced by glucocorticoids[J].Chin Pharmacol Bull,2014,30(3):407-12.
[12]Rybka J,Ke′dziora-Kornatowska K,Bana′s-Le·zańska P,et al.In terplay between the pro-oxidant and antioxidant systems and proin-flammatory cytokine levels,in relation to iron metabolism and the erythron in depression[J].Free Radic Biol Med,63:187-94.
[13]Papiez M A,Dybala M,Sowa-Kucma M,et al.Evaluation of oxi-dative status and depression-like responses in Brown Norway rats with acute myeloid leukemia[J].Prog Neuropsychopharmacol Biol Psychiatry,2009,33(4):596-604.
[14]苏启表,何 飞,曾宪彪,等.黑蚂蚁醇提物石油醚部位对亚急性衰老小鼠血清和脑组织抗氧化作用的研究[J].中华中医药杂志,2014,29(6):2020-2.
[14]Su Q B,He F,Zeng X B,et al.Research on the anti-oxidative effect of petroleum ether extraction of polyrhachisvicina roger alco-hol extract in serum and brain tissue of subacute aging model mice [J].Chin J Tradit Chin Med Pharm,2014,29(6):2020-2.
[15]回瑞华,侯冬岩,刘 晓,等.黑蚂蚁的脂肪酸及抗氧化性能的分析[J].分析实验室,2008,27(5):54-6.
[15]Hui R H,Hou D Y,Liu X,et al.Analysis of fatty acids and antioxi-dative effect for black ants[J].Anal Lab,2008,27(5):54-6.
[16]Grosso G,Galvano F,Marventano S,et al.Omega-3 fatty acids and depression:scientific evidence and biological mechanisms [J].Oxid Med Cell Longev,2014:313570.
[17]Stefanescu C,Ciobica A.The relevance of oxidative stress status in first episode and recurrent depression[J].J Affect Disord,2012,143(1-3):34-8.
[18]Papiez M A,Dybala M,Sowa-Kucma M,et al.Evaluation of oxi-dative status and depression-like responses in Brown Norway rats with acute myeloid leukemia[J].Prog Neuropsychopharmacol Biol Psychiatry,2009,33(4):596-604.
[19]Choi M,Wang S E,Ko S Y,et al.Overexpression of human GA-TA-1 and GATA-2 interferes with spine formation and produces depressive behavior in rats[J].PLoS One,2014,9(10):e109253.
[20]Moraga-Amaro R,Gonzalez H,Pacheco R,et al.Dopamine recep-tor D3 deficiency results in chronic depression and anxiety[J].Be-hav Brain Res,2014,274:186-93.
[21]Zubenko G S,Hughes HB 3rd,Jordan R M,et al.Differential hip-pocampal gene expression and pathway analysis in an etiology-based mouse model of major depressive disorder[J].Am J Med Genet B Neuropsychiatr Genet,2014,165B(6):457-66.
[22]Coelho J E,Alves P,Canas P M,et al.Overexpression of adeno-sine A2A receptors in rats:effects on depression,locomotion,and anxiety[J].Front Psychiatry,2014,5:67.
[23]Naumenko VS,Popova NK,Lacivita E,et al.Interplay between serotonin 5-HT1A and 5-HT7 receptors in depressive disorders [J].CNS Neurosci Ther,2014,20(7):582-90.
[24]Gupta D,Radhakrishnan M,Kurhe Y,et al.5HT3 receptor antag-onist(ondansetron)reverses depressive behavior evoked by chron-ic unpredictable stress in mice:modulation of hypothalamic-pitui-tary-adrenocortical and brain serotonergic system[J].Pharmacol Biochem Behav,2014,124:129-36.
Antidepressive-like effect of alcoholic extract of Polyrhachis vicina Roger
WEI Gui-ning1,CHU Shi-feng2,SU Hua1,HE Fei1,SU Qi-biao3,LU Wen-jie1,LU Guo-shou1,HUANG Zhou-feng1,TAN Xiao1,LIN xiao1,ZENG Xian-biao1,WEI Bao-wei1,CHEN Nai-hong4
(1.Dept of Pharmaocology,Guangxi Institute of Chinese Medicine and Pharmaceutical Science,Nanning 530022,China;2.TCM School,Hunan University of Chinese Medicine,Changsha 410208,China;3.College of Health Science,Guangdong Pharmaceutical University,Guangzhou 510006,China;4.Pharmacy College,Hunan University of Chinese Medicine,Changsha 410208,China)
Abstract:Aim To investigate the antidepressive-like effect of ethyl alcohol extract of Polyrhachis vicina Rog-er(EAPR),and its mechanism.Methods EAPR was prepared by ethanol extraction.Its anti-depressive effect was investigated by tail suspension test(TST)and forced swimming test(FST).Furthermore,repeated
doses of reserpine was used for preparing the depres-sive rats.Results EAPR has definitely anti-depres-sive effect,as evidenced by the decreased immobility time in FST and TST at the doses of 8 and 4 g·kg-1(P<0.05).In the repeated reserpine evoked depres-sive rats,EAPR antagonized the symptoms induced by monoamines depletion and attenuated the anhedonia,as manifested by reversed hypothermia,akinesia and sucrose consumption at the doses of 8 and 2 g·kg-1(P<0.05,P<0.01).Neuro-chemical studies showed that AFPR significantly increased the concentration of monoamines,including 5-hydroxytryptamine(5-HT) and noradrenaline(NA)at the dose of 8 g·kg-1(P<0.05),and had no effect on normal rats.Furthermore,EAPR increased the activity of superoxide dismutase (SOD)in serum,hippocampus and cerebral cortex at the dose of 8 g·kg-1(P<0.05).Conclusion EA-PR possesses the definite antidep ressive properties,connected with the regulation of neurotransmitter me-tabolism and the nerve cells antioxidant effect.
Key words:Polyrhachis vicina Roger;depression;mechanism;5-hydroxytryptamine;noradrenaline;su-peroxide dismutase
作者简介:韦桂宁(1973-),男,硕士,副主任药师,研究方向:中药药理学,Tel:0771-5869102,E-mail:weiguining2004@163.com;陈乃宏(1961-),男,博士,研究员,博士生导师,研究方向:神经系统疾患创新药物开发及作用机制,通讯作者,E-mail:chennh@imm.ac.cn
基金项目:国家自然科学基金资助项目(No 81360653,81560663);广西自然科学基金资助项目(No 2011GXNSFA018258);广西中医药民族医药继承创新工程课题(No GZPT13-29)
收稿日期:2015-05-20,修回日期:2015-06-23
文献标志码:A
文章编号:1001-1978(2015)09-1280-07
doi:10.3969/j.issn.1001-1978.2015.09.020
