竹叶黄酮的酶促酰化、分离与结构鉴定
2015-02-15孙元奎逯与运晏日安
孙元奎,马 祥,刘 柳,逯与运,晏日安
(暨南大学食品科学与工程系,广东广州 510632)
竹叶黄酮的酶促酰化、分离与结构鉴定
孙元奎,马 祥,刘 柳,逯与运,晏日安*
(暨南大学食品科学与工程系,广东广州 510632)
研究了固定化脂肪酶B(Novozmy 435)在低水分含量的叔戊醇溶剂中催化竹叶黄酮与硬脂酸的酰化反应。反应条件:竹叶黄酮与硬脂酸酸摩尔比1∶5,脂肪酶用量50g/L,机械搅拌转速200r/min,反应温度50℃,反应时间72h。后经液液萃取,薄层层析(TLC,UV 254nm),硅胶柱层析分离纯化,薄层层析展开剂配比为氯仿/甲醇/冰乙酸(7∶1∶0.05,v/v/v),柱层析洗脱剂配比为氯仿/甲醇/冰乙酸(10∶1∶0.05,v/v/v);洗脱液合并相同组分,得到两种黄酮苷酰化物单体。对纯化后的组分采用红外光谱(IR)、质谱(ESI-MS)、核磁共振(1H-NMR、13C-NMR)进行结构鉴定和表征,确定产物分别为异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯,说明反应表现出高度选择性。
固定化脂肪酶B,竹叶黄酮,酰化,薄层层析,硅胶柱层析
竹叶黄酮是我国近年来研究和开发的一种新型植物黄酮制剂,具有中国本土资源特色和自主知识产权。竹叶黄酮主要是4种碳苷黄酮:荭草苷、异荭草苷、牡荆苷、异牡荆苷[1]。近年的研究表明,竹叶黄酮具有较好的抗自由基、抗氧化、抗突变和保护心脑血管等多种医疗功效[2-4]。因此,目前对竹叶黄酮类物质的制备与功能作用的研究已成为一个热点。
天然黄酮类化合物一般以游离态或糖苷的形式存在,脂溶性较差,限制了其在食品中的应用[5-6]。酰化是黄酮苷中糖基或其母核上的羟基官能团与脂肪酸的酯化过程,分为生物酶法和化学法两种[7]。黄酮类化合物经过酰化修饰后,其亲脂性明显提高,并且可以改善它们的生物利用度。与化学酰化相比,酶促酰化稳定性好,选择性专一,反应条件温和,更符合绿色化学的要求。目前,酰化主要使用的生物酶是固定化脂肪酶B[8-9],并且脂肪酶B对黄酮苷糖基上的6″-羟基表现出高度的选择性[10-11]。本文以硬脂酸为酰基供体对竹叶黄酮进行酰化修饰,应用薄层层析、硅胶柱层析分离纯化后得到两种酰化产物,采用高效液相色谱分析两酰化产物得到较好分离,采用IR、ESI-MS、1H-NMR、13C-NMR等方法对其进行了结构鉴定,确定两种酰化产物为异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯,是两种新合成化合物。同时测定并比较了两种酰化产物的正辛醇/水体系分配系数,结果表明两种产物亲脂性明显提高。
1 材料与方法
1.1 材料与仪器
鲜竹叶抗氧化物(竹叶黄酮总含量约为40%) 深圳金色盆地生物科技有限公司;异荭草苷、荭草苷、异牡荆苷、牡荆苷对照品 法国Extrasynthese公司;435脂肪酶(固定化南极假丝酵母脂肪酶) 诺维信(中国)投资有限公司;硬脂酸 上海晶纯实业有限公司;4A分子筛 天津福晨化学试剂厂;柱层析硅胶(200~300目)、薄层层析板 青岛海洋化工厂;乙酸乙酯、乙腈、正己烷 天津市富宇精细化工有限公司;氘代二甲基亚砜(DMSO) 美国剑桥同位素公司。
RE-52AAB型旋转蒸发器 上海嘉鹏科技有限公司;SHZ-DIII型循环水式真空泵 巩义宁于华仪器有限责任公司;DZF-6030A型真空干燥箱 上海一恒科学技术有限公司;Essentia LGE-UV高效液相色谱仪 日本岛津公司;EQUINOX-55型红外光谱仪 布鲁克光谱仪器公司;4000Q Trap质谱仪 AB SCIEX公司;AVANCEIII型核磁共振波谱仪(500MHz) 瑞士布鲁克公司。
1.2 实验方法
1.2.1 竹叶黄酮HPLC分析 精密称取干燥至恒重的异荭草苷、荭草苷、异牡荆苷、牡荆苷标品适量,用甲醇溶解并定容至50mL;将鲜竹叶抗氧化物样品置于50℃烘箱中干燥至恒重,精密称取样品1.0g用甲醇定容至50mL。色谱分析时,稀释10倍,经0.45μm滤膜滤过,取2μL进样。色谱条件:Synthesis C18色谱柱(250mm×4.6mm,5μm);流动相:乙腈/0.5%冰醋酸(14∶86,v/v);流速1mL/min,检测波长340nm,柱温:40℃[12]。
1.2.2 竹叶黄酮的酰化 将竹叶黄酮置于50℃真空干燥箱50min,放于干燥器中备用;将已活化的4A分子筛(300~400℃,3h)放入叔戊醇中,分子筛/叔戊醇=1∶10(g/mL),静置24h,反应前抽滤使用。取500mL叔戊醇于1000mL三口烧瓶中,后加入5.02g竹叶黄酮,6.40g硬脂酸(竹叶黄酮/硬脂酸≈1∶5(mol/mol),50℃下常压回流,200r/min机械搅拌。原料充分溶解后,加入435脂肪酶25.00g,开始反应。反应24h后加入4A分子筛25.06g,之后每24h加入10.00g分子筛,继续反应48h[13-14]。反应结束后抽滤滤液,旋转蒸发,得8.24g混合物。
1.2.3 酰化产物的纯化与分离 反应产物用乙腈/正己烷(2∶5,v/v)溶解,于50℃下萃取20min,分液,取乙腈层旋转蒸干;后将蒸干物用乙酸乙酯/水(2∶5,v/v)溶解,于60℃下萃取20min,分液,取乙酸乙酯层旋转蒸干,得2.18g粗产物[15]。TLC确定较优的展开剂比例:氯仿/甲醇/冰乙酸(7∶1∶0.05,v/v/v),将确定的展开剂比例适当调低极性用于硅胶柱层析(200~300目,35mm×700mm玻璃柱)分离,洗脱剂:氯仿/甲醇/冰乙酸(10∶1∶0.05,v/v/v),恒定流速洗脱,每20mL收集一份洗脱液。洗脱液经归类,旋蒸除去溶剂,得两单体产物。
1.2.4 酰化产物的结构鉴定
1.2.4.1 高效液相色谱分析 酰化反应后的混合物和经硅胶柱层析分离得到的两酰化产物分别进行高效液相色谱分析,流动相为乙腈(A)和水(B)。色谱条件:COSMOSIL 5C18-MS-Ⅱ色谱柱(4.6ID×250mm);采用梯度洗脱的方法,流动相配比为0min:A∶B=60∶40(v/v),20min:A∶B=100∶0(v/v),35min:A∶B=100∶0(v/v);流速:1mL/min;柱温:40℃;检测器:紫外检测器;检测波长:340nm[16]。
1.2.4.2 红外光谱分析 柱层析获得的两分离单体直接涂抹在红外测定仪的透光镜上测量,扫描范围4000~500cm-1。
1.2.4.3 分离产物的ESI-MS,1H-NMR和13C-NMR测定条件 柱层析两分离单体采用色谱级甲醇溶解,溶液浓度为10mg/mL。质谱条件:电喷雾ESI离子源,电子能量70eV,传输线温度275℃,离子源温度200℃,采用负离子模式,激活电压1.5V,质量扫描范围0~1000m/z。以四甲基硅为内标、氘代二甲基亚砜(DMSO-d)为溶剂,1H-NMR和13C-NMR在30℃采用500MHz频率分别对分离纯化的两单体进行扫描。
1.2.5 酰化产物的亲脂性 100μmol的物质溶解于10mL的正辛醇(水饱和)中,加入10mL的水(正辛醇饱和),2000r/min下离心10min,静置分液,分别旋转蒸干,测定正辛醇层和水层中物质含量,计算分配系数,平行测定3次,取平均值[17]。结果以logP表示,方程式如下:
P=C0/Cw
C0:平衡时物质在正辛醇相中的浓度。Cw:平衡时物质在水相中的浓度。
1.2.6 数据处理 数据采用Origin8.0和MestReNova软件处理解析,结构式采用Chemdrw10.0版本绘制。
2 结果与讨论
2.1 竹叶黄酮的HPLC分析
鲜竹叶抗氧化物(竹叶黄酮总含量约为40%)用甲醇溶解定容,经0.45μm滤膜滤过除杂,进行高效液相色谱分析。由图1标准品定位可知,1为异荭草苷,2为荭草苷,3为牡荆苷,4为异牡荆苷。由图2可知,经HPLC分析,竹叶黄酮中的四种黄酮苷得到了较好分离。按外标法以峰面积计算,四种竹叶黄酮的含量分别为:异荭草苷58.51%,荭草苷16.79%,牡荆苷4.34%,异牡荆苷18.36%;即四种黄酮苷的含量异荭草苷>异牡荆苷>荭草苷>牡荆苷。

图1 四种黄酮苷标品的高效液相色谱图Fig.1 HPLC chromatogram of four Flavonoid Glycosides 注:1:异荭草苷;2:荭草苷;3:牡荆苷;4:异牡荆苷,图2同。

图2 竹叶黄酮的高效液相色谱图Fig.2 HPLC chromatogram of Flavonoid Glycosides from Bamboo Leaf
2.2 高效液相色谱分析
酰化产物混合物经液液萃取,去除未反应的黄酮苷和脂肪酸等杂质;后经硅胶柱层析分离纯化,TLC检测归类,得两种酰化产物。由图3、图4可知,反应产物经过水和正己烷的多次萃取除杂之后,保留时间在16~25min间有明显的吸收峰,其中23.19min峰为异牡荆苷-6″-硬脂酸酯,21.35min峰为异荭草苷-6″-硬脂酸酯,其余峰经质谱鉴定均非目标产物。由于荭草苷和异荭草苷以及牡荆苷和异牡荆苷为两对同分异构体,黄酮苷糖基上均有6″-羟基,理论上讲,产物不应只有两种已酰化的黄酮苷。但目前通过硅胶柱层析分离和高效液相色谱分析,只分离纯化得到以上两种酰化产物。

图3 酰化产物的高效液相色谱图Fig.3 HPLC chromatogram of reaction product注:1:异荭草苷-6″-硬脂酸酯;2:异牡荆苷-6″-硬脂酸酯,图4同。

图4 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的高效液相色谱图Fig.4 HPLC chromatogram of isoorientin-6″-stearate and isovitexin-6″-stearate
2.3 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的红外图谱分析
纯化酰化产物的红外图谱如图5所示:分析可知,吸收峰3391.32cm-1和3401.94cm-1分别为酚羟基、糖基上的羟基峰;羰基的伸缩振动区域在1900~1500cm-1,吸收峰1653.53cm-1和1651.14cm-1为黄酮羰基峰;1600~1450cm-1区域是芳环的骨架振动区,吸收峰1450,1500,1600cm-1附近为苯环骨架振动峰,以上均与黄酮类化合物吸收峰一致[18];而2924,2854cm-1左右峰为烷烃饱和C-H伸缩振动的特征吸收峰,1726.33,1717.96cm-1为酯基的特征吸收峰,1249.02,1270.95cm-1处为酯基中C-O伸缩振动吸收峰[19],综合红外图谱分析,符合竹叶黄酮酯化产物的结构特征。

图5 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的红外图谱Fig.5 FT-IR spectra of isoorientin-6″-stearate and isovitexin-6″-stearate
2.4 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的ESI-MS分析
酰化产物用甲醇溶解,ESI-MS二级图谱如图6所示,已知异牡荆苷硬脂酸酯和异荭草苷硬脂酸酯的分子量M=698、714;M1=697.7、713.6分别为去氢[M-H]-峰,M2=679.8、695.7分别为去水[M1-18]-([M1-H2O]-)峰,M3=413.3、429.4分别为去硬脂酸[M1-284]-([M1-C18H36O2]-)峰;酰化产物黄酮苷部分异牡荆苷和异荭草苷分子量M4=432、448,M5=341.3、357.5分别为[M4-H-90]-([M4-H-C3H6O3]-)峰,M6=311.3、327.3分别为[M4-H-120]-([M4-H-C4H8O4]-)峰,M7=269.0、285.4为苷元芹菜素和木犀草素离子[M4-163]-([M4-C6H11O5]-)峰,以上碎片峰与文献黄酮碳苷的裂解特征一致[20]。

图6 异牡荆苷-6″-硬脂酸酯(A)和异荭草苷-6″-硬脂酸酯(B)的ESI-MS二级图谱Fig.6 Second class ESI-MS chromatogram of isoorientin-6″-stearate (A) and isovitexin-6″-stearate(B)
2.5 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的1H-NMR和13C-NMR分析

图7 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的1H-NMR图谱Fig.7 1H-NMR spectra of isoorientin-6″-stearate and isovitexin-6″-stearate
为进一步表征并区分两分离单体的结构,将纯化后的单酯溶于氘代二甲基亚砜(DMSO-d),核磁共振仪扫描。由图7、图8及表1、表2的1H-NMR、13C-NMR分析可知,酯基上的-αCH2-C=O为δ1H=2.25,酯基上的-βCH2-为δ1H=1.45、1.48,酯基上的-(CH2)8-在δ1H=1.16、1.22,酯基上的CH3-为δ1H=0.83,δ13C=173.36、173.39为C=O,说明酰化反应成功。此外,与异荭草苷和异牡荆苷1H-NMR、13C-NMR对比分析[21],确定酰化物物为异牡荆苷硬脂酸酯和异荭草苷硬脂酸酯;同时,6″位的碳的化学位移向低场偏移(δ13C=61.57、61.61→64.68、64.69),按文献,同样说明酰化位置在6″-羟基上[13]。最终确定分离得到的酰化物为异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯,结构式如下:
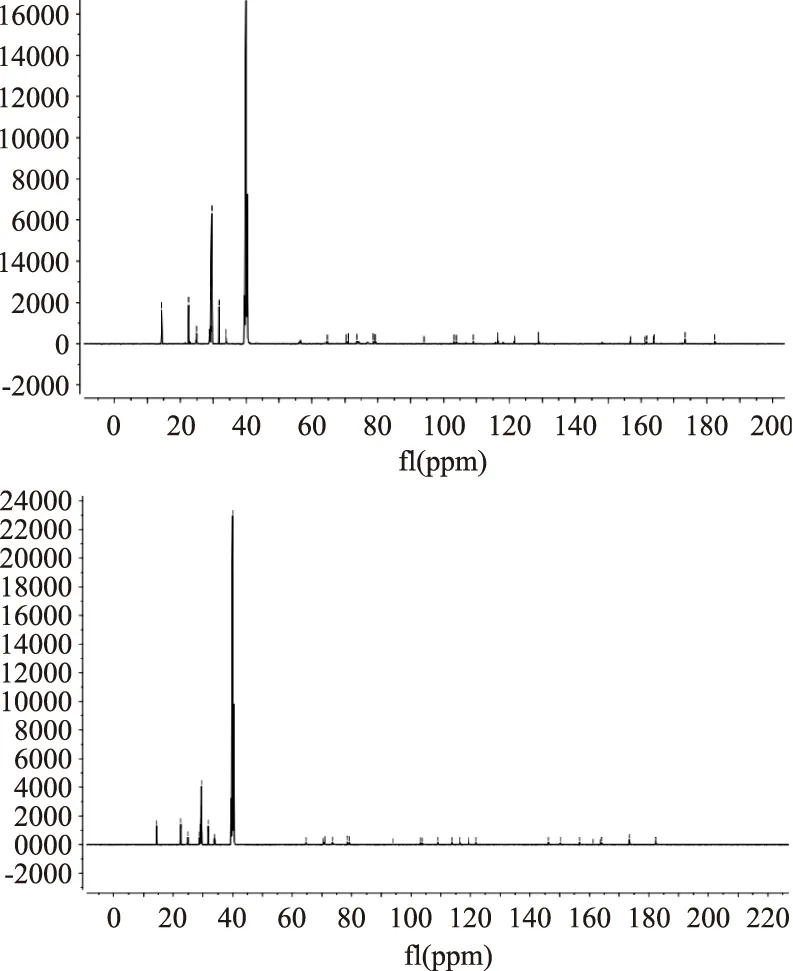
图8 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的13C-NMR图谱Fig.8 13C-NMR spectra of isoorientin-6″-stearateand isovitexin-6″-stearate

表1 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的1H-NMR分析Table1 1H-NMR data of isoorientin-6″-stearate and isovitexin-6″-stearate

表2 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的13C-NMR分析Table2 13C-NMR data of isoorientin-6″-stearate and isovitexin-6″-stearate
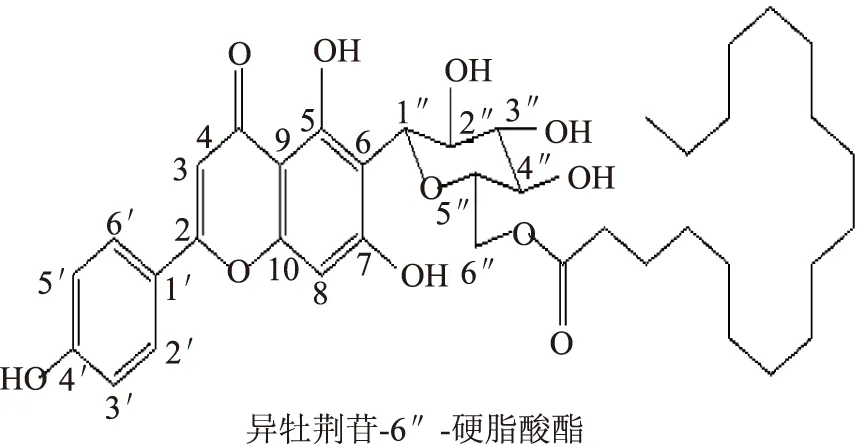
图9 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的结构式Fig.9 Structures of isoorientin-6″-stearate and isovitexin-6″-stearate
2.6 异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯的亲脂性分析
异牡荆苷和异荭草苷在正辛醇/水体系lgP通过Chemdraw 7.0软件分析分别为-0.72、-1.11,而经实验测定异牡荆苷-6″-硬脂酸酯和异荭草苷-6″-硬脂酸酯logP分别为9.36、8.74,表明经过酰化后物质的亲脂性得到了较大提高。
3 结论
本文以固定化脂肪酶B催化竹叶黄酮与硬脂酸反应,合成并纯化得到了两个竹叶黄酮的新单酯产物。采用薄层层析和硅胶柱层析对酰化产物进行分离纯化,经 IR、ESI-MS、NMR鉴定,确定两组分别为异牡荆苷-6″-硬脂酸酯异荭草苷-6″-硬脂酸酯,测定并比较了两种酰化产物的正辛醇/水体系分配系数,结果表明两种产物亲脂性明显提高,达到预期目标。
[1]Zhang Y,Jiao J J,Zhang Y, et al. Isolation and Purification of Four Flavone C-glycosides from Antioxidant of Bamboo Leaves by Macroporous Resin Column Chromatography and Preparative High-performance Liquid Chromatography[J]. Food Chemistry,2008,107:1326-1336.
[2]Zhang Y,Luo Z,Shao Z P,et al. Effects of Antioxidants of Bamboo Leaves and Flavonoids on 2-Amino-1-methyl-6-phenylimidazo[4,5-b]pyridine(PhIP)Formation in Chemical Model Systems[J]. Food Chemistry,2014,62(20):4798-4802.
[3]Zhang S,Chen J,Sun A D,et al. Protective Effects and Antioxidant Mechanism of Bamboo Leaf Flavonoids on Hepatocytes Injured by CCl4[J]. Food and Agricultural Immunology,2014,25(3):386-396.
[4]Lu B Y,Wu X Q,Shi J Y,et al. Toxicology and Safety of Antioxidant of Bamboo Leaves. Part 2:Developmental Toxicity Test in Rats with Antioxidant of Bamboo Leaves[J]. Food and Chemical Toxicology,2006,44(10):1739-1743.
[5]Salem J H,Humeau C,Chevalot I,et al. Effect of Acyl Donor Chain Length on Isoquercitrin Acylation and Biological Activities of Corresponding Esters[J]. Process Biochemistry,2010,45:382-389.
[6]张红城,吴正双,高文宏,等.黄酮类化合物改性方法的研究进展[J].食品科学,2011,32(3):256-261.
[7]Enaud E,Humeau C,Piffaut B,et al. Enzymatic synthesis of new aromatic esters of phloridzin[J].Journal of Molecular Catalysis B:Enzymatic,2004,27:1-6.
[8]Zhang X,Li L,Huang J R,et al. Enzymatic Synthesis of Naringin Palmitate[J]. Adv Mater Res,2012:1350-1356.
[9]Chebil L,Humeau C,Falcimaigne A,et al. Enzymatic Acylation of Flavonoids[J]. Process Biochemistry,2006,41(11):2237-2251.
[10]Kyriakou E,Primikyri A,Charisiadis P,et al. Unexpected Enzyme-catalyzed Regioselective Acylation of Flavonoid Aglycones and Rapid Product Screening[J]. Org.Biomol.Chem.,2012,10:1739-1742.
[11]Ardhaoui M,Falcimaigne A,Engasser J M,et al. Acylation of Natural Flavonoids Using Lipase of Candida Antarctica as Biocatalyst[J]. Mol. Catal. B:Enzym.,2004,29:63-67.
[12]龚金炎,吴晓琴,张英,等.RP-HPLC法测定竹叶提取物中黄酮类和酚酸类成分[J].中草药,2010,41(1):63-65.
[13]Ma X,Yan R A,Yu S Q,et al. Enzymatic Acylation of Isoorientin and Isovitexin from Bamboo-Leaf Extracts with Fatty Acids and Antiradical Activity of the Acylated Derivatives[J]. Journal of Agricultural and Food Chemistry,2012,60(43):10844-10849.
[14]Duan Y,Du Z,Yao Y,et al. Effect of Molecular Sieves on Lipase-catalyzed Esterification of Rutin with Stearic Acid[J]. Journal of Agricultural and Food Chemistry,2006,54(17):6219-6225.
[15]Ardhaoui M,Falcimaigne A,Ognier S,et al. Effect of acyl donor chain length and substitutions pattern on the enzymatic acylation of flavonoids[J]. Journal of Biotechnology,2004,110:265-271.
[16]Foteini M,Heleni L,Haralambos S,et al. Enzymatic esterification of flavonoids with unsaturated fatty acids:Effect of the novel esters on vascular endothelial growth factor release from K562 cells[J]. Process Biochemistry,2006,41:2029-2034.
[17]Kajiya K,Kumazawa S,Nakayama,T. Steric Effects on Interaction of Tea Catechins with Lipid Bilayers[J]. Biosci Biotechnol Biochem,2001,65(12):2638-2643.
[18]杨念云,段金廒,李萍,等.金钱草中黄酮类化合物的分离与结构鉴定[J].中国药学杂志,2006,41(21):1621-1624.
[19]Latifa C,Julie A,Catherine H,et al. Enzymatic Acylation of Flavonoids:Effect of the Nature of the Substrate,Origin of Lipase,and Operating Conditions on Conversion Yield and Regioselectivity[J]. Journal of Agricultural and Food Chemistry,2007,55:9496-9502.
[20]Li X Q,Xiong Z L,Ying X X, et al. A Rapid Ultra-performance Liquid Chromatography-electrospray Ionization Tandem Mass Spectrometric Method for the Qualitative and Quantitative Analysis of the Constituents of the Flower of Trollius ledibouri Reichb[J]. Analytica Chimica Acta,2006,580(2):170-180.
[21]Nicole K,Marcus A. Characterization of Phenolic Compoundsin Rooibos Tea[J]. Journal of Agricultural and Food Chemistry,2008,56(9):3368-3376.
Enzymatic acylation,isolation and identification of flavonoid glycosides from bamboo leaves
SUN Yuan-kui,MA Xiang,LIU Liu,LU Yu-yun,YAN Ri-an*
(Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China)
ImmobilisedCandidaAntarcticalipase B(Novozmy 435)was used to acylate flavonoid glycosides from bamboo leaves intert-amyl alcohol,with stearic acid as acyl donors at low moisture content. The optimum reaction condition was as follows:a molar ratio of flavonoid glycosides from bamboo leaves to Stearic acid of 1∶5,50g/L lipase,stirring speed was 200r/min,50℃ and reaction time was 72h. After Liquid-liquid extraction,the products of esterification reactions were subjected to thin-layer chromatography(TLC,UV 254nm),a silica gel column(700mm×35mm,i.d.),the developing solvent ratio was chloroform/methanol/acetic acid(7∶1∶0.05,v/v/v),and eluted with chloroform/methanol/acetic acid(10∶1∶0.05,v/v/v). Then combine fractions had the same value of retardation factor Rf,two types of acylated flavonoids were obtained. The purified products were analyzed by IR,ESI-MS,1H-NMR and13C-NMR and the two types of acylated flavonoids were isoorientin-6″-stearate and isovitexin-6″-stearate. The enzyme showed strong selectivity for acylation of glycosides.
immobilised lipase B;flavonoid glycosides;Acylation;TLC;Silica gel chromatography
2014-07-23
孙元奎(1988-),男,硕士研究生,研究方向:食品添加剂的制备与应用
*通讯作者:晏日安(1962-),男,博士,教授,研究方向:食品添加剂的制备与应用。
广东省自然科学基金(S2013010012931)。
TS202.3
A
:1002-0306(2015)09-0096-06
10.13386/j.issn1002-0306.2015.09.012
