我国部分地区樱桃病毒病害初步调查和病原检测
2015-02-14卢美光张志想陈冉冉李世访
卢美光, 吴 冰, 高 蕊, 张志想, 肖 红, 陈冉冉, 李世访
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
我国部分地区樱桃病毒病害初步调查和病原检测
卢美光, 吴 冰, 高 蕊, 张志想, 肖 红, 陈冉冉, 李世访*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
对山东泰安、辽宁大连和北京的樱桃病毒病发生情况进行调查,发现8个果园/栽培区均有病毒病发生,主要症状为叶片皱缩、畸形、卷叶、花叶、植株矮缩等。采集20份样品,利用12种病毒的引物进行RT-PCR检测。结果表明,在样品中扩增出与樱桃病毒A(Cherry virus A,CVA)、李属坏死环斑病毒(Prunus necrotic ringspot virus,PNRSV),李矮缩病毒(Prune dwarf virus,PDV)、李树皮坏死与茎痘伴随病毒(Plumbark necrosis stem pitting-associated virus,PBNSPaV)、樱桃绿环斑驳病毒(Cherry green ring mottle virus,CGRMV)、樱桃小果病毒-1(Little cherry virus-1,LCh V-1)预期大小一致的目的片段;序列分析表明,与GenBank中注册所测的病毒核苷酸序列均具有较高的一致性。其中,大连、泰安和北京样品均检测到CVA;大连和北京样品中检测到PNRSV和PDV;北京样品中检测到PBNSPaV;大连苗木样品枝条中检测到CGRMV和LCh V-1。这是在我国樱桃上首次检测到LCh V-1。
樱桃; 病毒病; 病原检测; LCh V-1
栽培樱桃具有较高经济效益,近几年在我国各地发展较快。甜樱桃(Prunus aviumL.)又名大樱桃,是我国目前主要栽培种类,包括‘红灯’,‘红艳’,‘美早’,‘萨米脱’,‘拉宾斯’等品种。大樱桃在山东、辽宁、河北、北京、山西、江苏、安徽、河南、甘肃、新疆等地均有栽培种植,主要集中在山东烟台、辽宁大连、河北秦皇岛等地。近年来,病毒病呈日益加重的趋势,成为影响樱桃产量和品质的重要因素。据国外报道,侵染大樱桃的病毒约有34种,比较常见主要有20种[1]。我国已报道的侵染樱桃的病毒有11种,包括苹果花叶病毒(Apple mosaic virus,Ap MV)[2],李属坏死环斑病毒(Prunus necrotic ringspot virus,PNRSV)[2-3],李矮缩病毒(Prune dwarf virus,PDV)[3-4],苹果褪绿叶斑病毒(Apple chlorotic leafspot virus,ACLSV)[4],樱桃锉叶病毒(Cherry rasp leaf virus,CRLV)[5],樱桃病毒A(Cherry virusA,CVA)[6],黄瓜花叶病毒(Cucumber mosaic virus,CMV)[7],樱桃绿环斑驳病毒(Cherry green ring mottle virus,CGRMV)[8],李树皮坏死与茎痘伴随病毒(Plum bark necrosis stem pitting-associated virus,PBNSPaV)[9],樱桃小果病毒-2(Little cherry virus-2,LChV-2)[10],樱桃坏死锈状斑驳病毒(Cherry necrotic rusty mottle virus,CNRMV)[11]。在已报道的樱桃病毒检测研究中,或对某些地区,某一个或几个病毒进行检测和鉴定,陆续报道检测到了这11种病毒,其中在我国检出率较高、发生较普遍的樱桃病毒主要有PNRSV、CVA和PDV。
2014年4-7月,我们依据已有研究进展并结合在生产实践中对樱桃病毒病鉴定的要求,对我国部分樱桃主产区(环渤海地区的山东泰安、辽宁大连和北京)病毒病发生情况进行调查和采样检测。对这11种樱桃病毒及可能发生的LCh V-1进行RT-PCR检测,以期为病毒病的发生情况和病原鉴定提供更加全面的依据,为及早进行综合防治提供参考。
1 材料和方法
1.1 材料
1.1.1 供试植物
有病毒病害症状和无症状樱桃叶片和枝条样品共20份,于2014年4-5月分别采自山东泰安、辽宁大连和北京的樱桃园内不同樱桃植株,样品清单如表1。对采集区樱桃园的病毒病发生情况进行调查,记录发病症状并拍照。

表1 从山东、辽宁和北京采集的樱桃样品Table 1 Cherry samples collected from Shandong,Liaoning and Beijing
1.1.2 主要试剂和仪器
多糖多酚植物总RNA提取试剂盒(Polysaccharides&Polyphenolics-rich RNAprep Pure)购自天根生物技术(北京)公司;AxyPrep DNA凝胶回收试剂盒购自Axygen试剂公司;其他仪器包括Bio-Rad PCR仪、KCBIO-2800凝胶成像系统和中国DYY-6B型稳压电泳仪。
1.2 方法
1.2.1 田间调查和采样
于2014年4-5月对山东泰安、辽宁大连和北京的8个樱桃园/栽培区的樱桃植株进行随机调查,观察田间发病症状和发病情况,并进行拍照;对疑似病毒病和无发病症状的植株,采集其枝梢幼嫩部位叶片或枝条并标号(表1),用于室内RT-PCR的病原检测,综合分析樱桃病毒病发生情况。
1.2.2 植物总RNA提取
采用多糖多酚植物总RNA提取试剂盒提取植物总RNA,具体操作步骤按操作指南。得到RNA溶液于-80℃冰箱中保存,待用。
1.2.3 RT-PCR检测
用于检测的12个病毒的相关引物设计参考国内外已报道文献和本实验室设计(表2)。
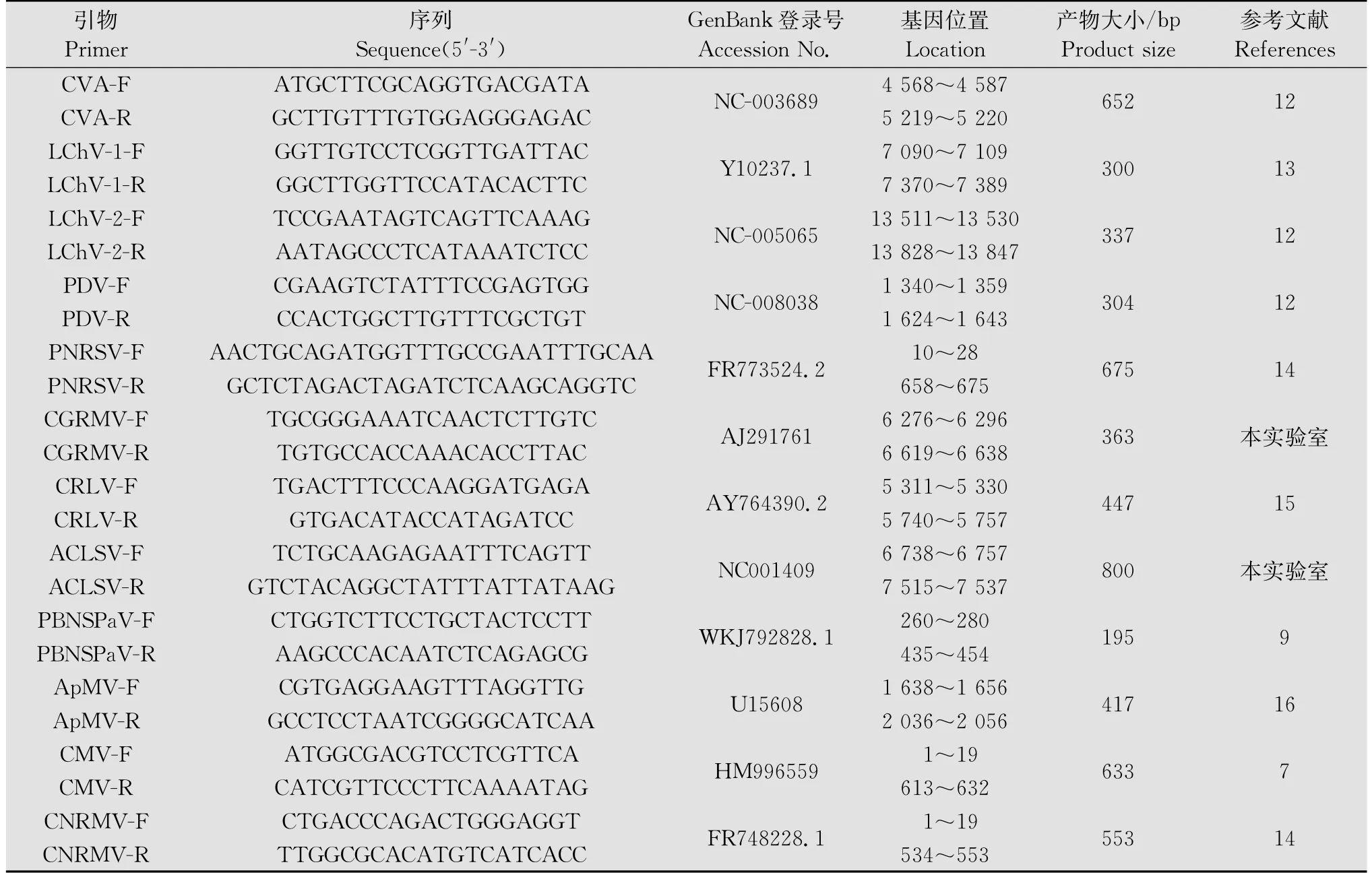
表2 RT-PCR反应所用特异性引物Table 2 Virus-specific detection primers used in RT-PCR assay
反转录体系为10μL:d NTPs(2.5 mmol/L)2μL,5×M-MLV buffer 2μL,M-MLV(200 U/μL)0.5μL,RNase inhibitor(40 U/μL)0.5μL,R-特异引物或随机六聚引物和Oligo(d T)18引物各0.5μL,植物总RNA 1μL,用无菌双蒸水补足到10μL,混匀,室温放置10 min,42℃温育1 h,然后进行PCR。为保证检测结果的可靠性,其中,LCh V-1、LCh V-2、CRLV、Ap MV、CMV、CNRMV用R-特异引物取代随机六聚引物和Oligo(d T)18引物作进一步检测。PCR反应体系为15μL:反转录产物1.2μL,2×TaqPCR mix 7.5μL,正、反向引物各0.5μL(CGRMV,ACLSV,PNRSV各为20μmol/L,其他正、反向引物各为15μmol/L),用无菌双蒸水补足到15μL。PCR反应循环参数;94℃预变性5 min;94℃变性30 s,50~55℃退火30 s,72℃延伸40 s,循环35次;最后72℃延伸10 min。4℃保存。PCR产物用1.5%琼脂糖凝胶电泳进行分析,在DYY-6B型稳压电泳仪,100V下电泳30 min左右,电泳胶于KCBIO-2800凝胶成像分析仪中照相,分析电泳结果。
1.2.4 PCR产物克隆及序列分析
PCR产物的纯化、连接转化和克隆筛选:按试剂盒操作指南,使用AxyPrep DNA凝胶回收试剂盒进行扩增产物的纯化。分别将CVA、CGRMV、PDV、PNRSV、LCh V-1、PBNSPaV、LCh V-2、CNRSV的8个PCR纯化产物连接至克隆载体p MD18-T,转化大肠感菌DH5α感受态细胞,筛选白色单菌落置于1 mL LB(含氨苄青霉素Amp)培养基中培养,通过菌液PCR检测来鉴定重组质粒。
目的片段的序列测定和分析:经菌液PCR,每个病毒各筛选3个阳性菌液送至金唯智生物科技(北京)有限公司进行序列测定。用DNAMAN软件对所得基因序列进行分析。通过BLAST(http:∥www. ncbi.nlm.nih.gov/)与相关序列进行比对分析,从而鉴定检测的目的片段。
2 结果与分析
2.1 我国部分地区樱桃病毒病害的初步调查
2014年4-5月对我国环渤海地区的山东泰安、辽宁大连和北京的8个樱桃园/栽培区樱桃病毒病发生情况进行随机调查发现,各个果园/栽培区均有病毒病发生,主要症状表现为叶片皱缩、卷叶、褪绿、花叶、叶片细长、畸形、碎叶、植株矮缩、严重的不结果等(图1)。其中,病毒引起的叶片皱缩畸形、褪绿症状较为普遍。由于有些病毒侵染植物后不表现症状,为潜隐性危害,必须通过采样进行病毒检测来进一步明确樱桃病毒病的发生情况。

图1 被病毒侵染的樱桃叶片症状Fig.1 The symptoms of cherry leaves infected by virus
2.2 侵染樱桃的几种病毒的RT-PCR检测及分析
对山东泰安、辽宁大连和北京的20份樱桃样品进行12种樱桃病毒的RT-PCR检测,结果表明:从泰安、大连和北京的12份样品(DL-3、DL-4、DL-5、DL-6、DL-7、DL-9、TA-10、TA-11、TA-12、BJ-14、BJ-17、BJ-18)中扩增出652 bp大小的CVA基因组基因(GenBank登录号:NC-003689)部分片段(图2a);其检出率最高,达60%;从大连和北京的7份样品(DL-1、DL-4、DL-9、BJ-14、BJ-15、BJ-16、BJ-17)中扩增到691 bp大小的PNRSV的CP基因片段(图2c),检出率为35%,仅次于CVA;有3份样品(DL-6、DL-7、BJ-18)扩增到304 bp大小的PDV基因组(GenBank登录号:NC-008038)CP基因的片段(图2b),检出率为15%;BJ-16、BJ-20样品扩增到195 bp的PBNSPaV的CP基因片段(图2d),检出率为10%;而来自大连的‘美早’(DL-2,从河北引种)中同时检测到300 bp的LCh V-1的复制酶基因片段(图2e)和363 bp的CGRMV的RNA解旋酶基因片段(图2f),检出率各为5%。20份样品中均未检测到CRLV、ACLSV、Ap MV、CMV、CNRMV、LCh V-2等6种病毒(表3),而CVA与PDV、CVA与PNRSV、RNRSV与PBNSPaV,LCh V-1与CGRMV存在复合侵染现象。

表3 樱桃样品病毒的RT-PCR检测结果Table 3 Virus infection in cherry orchards based on RT-PCR analysis
为进一步验证RT-PCR检测结果的可靠性,分别对CVA、PDV、PNRSV、PBNSPaV和LChV-1的PCR产物的纯化、克隆和测序,并与GenBank中注册的相关病毒的核苷酸序列进行对比,结果表明,扩增出的CVA、PDV、PNRSV、PBNSPaV、CGRMV和LChV-1片段分别与登录号为X82547.1、GU066793.1、 KF135203.1、KJ792822.1、HQ539657.1和D659615.1相应片段的核苷酸序列一致性最高,分别为98%、98%、99%、99%、99%和98%。扩增出的300 bp大小的LCh V-1,与GenBank中注册的其他LChV-1复制酶基因核苷酸序列一致性为96%~98%,这是在我国首次检测到LChV-1。

图2 樱桃病毒RT-PCR产物电泳检测图谱Fig.2 Electrophoresis assay of RT-PCR products of cherry viruses
3 讨论
由于近年来樱桃栽培在我国发展较快,栽培面积不断扩大以及栽培中的苗木引种和调运、无性繁殖代数增多等因素,加快了樱桃病毒病的传播。目前,樱桃病毒病在我国已经广泛发生。
在已报道检出的11种樱桃病毒中,PNRSV、PDV和CVA在我国发生较为普遍。在我国大连、北京和山东等地樱桃上检测到PNRSV和PDV感病植株,其中山东地区甜樱桃上PNRSV感染率为38%[17-18]。王文文等于2013年对山东和辽宁地区甜樱桃‘红灯’进行了CVA、LCh V-2和LCh V-1的调查,结果表明,CVA、LCh V-2的检出率较高,分别为60.8%和43.1%,未检测到LChV-1[19]。作者对大连、北京和山东三地的‘红灯’、‘红艳’、‘拉宾斯’等多个樱桃品种进行田间病毒病调查和采样检测,PNRSV的总检出率为35%,PDV的总检出率为15%,CVA的总检出率为60%,PDV、PNRSV引起了田间樱桃叶片褪绿斑驳、花叶、叶片细长畸形、植株矮缩等症状,与已报道结果基本一致;可能是由于检测的‘红灯’占检测样品总数的比例不大,未检测到LCh V-2。樱桃小果病(little cherry disease,LChD)主要与长线形病毒科(Closteroviridae)的两个成员LCh V-1、LCh V-2有关,LCh V-2属于长线形病毒科的葡萄卷叶病毒属(Ampelovirus),而LCh V-1属于长线形病毒科的尚未定名的病毒种。在意大利、美国等国家已报道检测到LChV-1[13],本研究在辽宁大连樱桃苗木‘美早’(从河北引种)中检测到LCh V-1,并且检测到与CGRMV复合侵染同一植株,这是在我国首次检测到LCh V-1,因此应加强我国樱桃病毒的检测预防工作,防止新病毒在我国的传播和流行。
已有报道CVA为潜隐性危害,本文检测结果表明该病毒发生普遍,在未表现症状和有缩叶畸形症状的叶片中均检测到CVA,并在一些样品中检测到CVA与PDV、CVA与PNRSV的复合侵染,使症状表现较为复杂。观察到的症状与CVA的关系有待进一步研究确定,如,表现的症状是否与CVA的潜伏期有关,是否与存在不同株系有关,是否还存在其他未知樱桃病毒与CVA的复合侵染,有待进一步深入的研究。
本研究对我国环渤海地区的山东泰安、辽宁大连和北京样品同时进行了12种病毒的系统检测,为了解病毒病的发生情况和病原鉴定提供了更加全面的依据。由于检测的病毒较多,在RT-PCR逆转录中用Oligo-d T和随机六聚体引物混合检测,不仅提高逆转录的效率,同时,一个逆转录样品可用于几种病毒的检测,大大节省了检测时间和成本。
目前,对樱桃病毒病的防治尚无有效的化学药剂,建立快速有效的检测方法,加强对我国樱桃病毒病的发生种类、分布和危害的调查,加强对樱桃苗木引种和调运过程中的病原检疫检测工作,加快樱桃脱毒优良品种的培育,建立无病毒苗木良种繁育体系,对控制我国樱桃病毒病的传播和樱桃病毒病的及时防治具有重要意义。
[1] 董薇,宋雅坤,吴明勤,等.大樱桃病毒病研究进展[J].中国农学通报,2005,21(5):332 336.
[2] Zhou Y Y,Ruan X F,Wu C L,et al.First report ofSweetcherry virusesin China[J].Plant Disease,1996,80(12):1429.
[3] 李青,覃兰英,李明福,等.酶联免疫法检测核果果树病毒[J].北京农业科学,1996,14(4):33 35.
[4] 阮小凤,杨勇.甜樱桃病毒病的ELISA检测研究[J].山东农业大学学报(自然科学版),1998,29(3):277 282.
[5] 谭海东,李树英,赵姝华,等.樱桃锉叶病毒的初鉴定和防治[J].北方果树,2002(3):6 8.
[6] Rao W L,Zhang Z K,Li R.First report ofCherry virus Ain sweet cherry trees in China[J].Plant Disease,2009,93(4):425.
[7] Tan H D,Li S Y,Du X F,et al.First report ofCucumbermosaic virusin sweet cherry in the People’s Republic of China[J].Plant Disease,2010,94(11):1378
[8] Zhou J F,Wang G P,Kuang R F,et al.First report ofCherry green ring mottle viruson cherry and peach grown in China[J].Plant Disease,2011,95(10):1319.
[9] Cui H G,Hong N,Xu W X,et al.First report ofPlumbark necrosis stem pitting-associated virusin stone fruit trees in China[J].Plant Disease,2011,95(11):1483.
[10]Rao W L,Li F,Zuo R J,et al.First report ofLittle cherry virus2 in flowering and sweet cherry trees in China[J].Plant Disease,2011,95(11):1484.
[11]Zhou J F,Wang G P,Qu L N,et al.First report ofCherry necrotic rusty mottle viruson stone fruit trees in China[J]. Plant Disease,2013,97(2):290.
[12]宗晓娟,王文文,王甲威,等.SYBR GreenⅠ实时定量RTPCR技术在甜樱桃病毒定量分析中的应用[J].植物保护学报,2012,39(6):497 502.
[13]Bajet,N B,Unruh T R,Druffel K L,et al.Occurrence of two little cherry viruses in sweet cherry in Washington State[J]. Plant Disease,2008,92:234 238.
[14]Noorania M S,Awasthia P,Sharmab M P,et al.Simultaneous detection and identification of four cherry viruses by two step multiplex RT-PCR with an internal control of plant nad5 mRNA[J].Journal of Virological Methods,2013,193(1):103 107.
[15]James D,Upton C.Genome segment RNA-1 of a flat apple isolate ofCherry rasp leaf virus:nucleotide sequence analysis and RT-PCR detection[J].Archives of Virology,2005,150:1469 1476.
[16]Sánchez-Navarro J A,Aparicio F,Herranz M C,et al.Simultaneous detection and identification of eight stone fruit viruses by one-step RT-PCR[J].European Journal of Plant Pathology,2005,111:77 84.
[17]李明福,张永江,黄冲,等.北京怀柔地区樱桃上发现李属坏死环斑病毒[J].植物病理学报,2005,35(6):552 554.
[18]王文文,宗晓娟,陈立伟,等.中国甜樱桃病毒病及其检测技术研究进展[J].湖北农业科学,2012,51(18):3929 3933.
[19]王文文,宗晓娟,王甲威,等.环渤海湾地区甜樱桃小果病毒及樱桃病毒A的鉴定与调查[J].植物保护,2013,39(2):128 133.
Preliminary investigation on cherry virus diseases and detection of the pathogens in some regions of China
Lu Meiguang, Wu Bing, Gao Rui, Zhang Zhixiang, Xiao Hong, Chen Ranran, Li Shifang
(State Key Laboratory for Biology of Plant Diseases and Insect Pests,Institute of Plant Protection,
Chinese Academy of Agricultural Sciences,Beijing100193,China)
Virus diseases were investigated in some orchards or cultivated areas in Shandong,Liaoning provinces and Beijing of China.The symptoms mainly included leaves shrivel,deformity,roll leaf,yellow and green mottle,plant dwarf,etc.Twenty leaves or stems samples were collected from these orchards.A protocol of RT-PCR was used for the detection of 12 viruses infecting cherry.RT-PCR amplification and sequence analysis showed that amplified products with the expected sizes ofCherry virus A(CVA),Prunus necrotic ringspot virus(PNRSV),Prune dwarf virus(PDV),Plum bark necrosis stem pitting-associated virus(PBNSPaV),Cherry green ring mottle virus(CGRMV)andLittle cherry virus-1(LCh V-1)were obtained.The amplified fragments had high identity with the corresponding nucleotide sequence reported in GenBank.CVA positive samples were detected in samples from Dalian,Liaoning Province,Taian,Shandong Province and Beijing.PNRSV and PDV positive samples were detected in Dalian and Beijing.PBNSPa V positive samples were detected in Beijing.CGRMV and LCh V-1 positive sample were detected in Dalian and this is the first report on the dectetion of LCh V-1 in cherry in China.
cherry; virus diseases; pathogens detection; LCh V-1
S 436.629
A
10.3969/j.issn.0529 1542.2015.01.019
2014 08 19
2014 10 17
公益性行业(农业)科研专项(201203076);国家自然科学基金(31471752)
致 谢:感谢大连市农科院果树研究所关海春研究员;山东农业大学彭福田教授和山东农业科学院果树研究所张安宁副研究员在采集样品中提供的帮助。
*通信作者 E-mail:sfli@ippcaas.cn
