基于groEL基因序列鉴定丹毒丝菌属菌种
2015-02-13杨振龙吾鲁木汗那孜尔别克恩特马克布拉提白
杨振龙,吾鲁木汗·那孜尔别克,2,恩特马克·布拉提白,2
(1.吉首大学生物资源与环境科学学院,湖南 吉首 416000;2.伊犁师范学院生物与地理科学学院,新疆 伊宁 835000)

基于groEL基因序列鉴定丹毒丝菌属菌种
杨振龙1,吾鲁木汗·那孜尔别克1,2,恩特马克·布拉提白1,2
(1.吉首大学生物资源与环境科学学院,湖南 吉首 416000;2.伊犁师范学院生物与地理科学学院,新疆 伊宁 835000)
对4株红斑丹毒丝菌的16S rRNA基因和groEL基因进行测序及系统发育分析,探讨groEL基因序列分析法在丹毒丝菌属菌种分类鉴定中的应用.测序结果表明,4株红斑丹毒丝菌groEL基因长度为1 614 bp,编码由537个氨基酸残基组成热休克蛋白HPS60,与红斑丹毒丝菌ATCC19414株和扁桃体丹毒丝菌ATCC43339株groEL基因的同源性分别为99%和86%,而16S rRNA基因长度为1 351 bp,与红斑丹毒丝菌ATCC19414株和扁桃体丹毒丝菌ATCC43339株的同源性均为99%.系统发育分析结果表明,groEL基因比经典的16S rRNA基因序列分析分辨率高,可适用于红斑丹毒丝菌和扁桃体丹毒丝菌的分类鉴定.
红斑丹毒丝菌;扁桃体丹毒丝菌;16S rRNA基因;groEL基因;分类鉴定
丹毒丝菌属(Erysipelothrix)包括红斑丹毒丝菌(E.rhusiopathiae)和扁桃体丹毒丝菌(E.tonsillarum)2个种,前者有16种血清型,后者有7种血清型.[1-2]红斑丹毒丝菌能感染猪、鸟类和鱼类等并导致畜禽的死亡,给养殖业带来重大损失[3].临床研究表明,大约75%以上猪源分离菌株属于血清型1和2红斑丹毒丝菌,而其余血清型的红斑丹毒丝菌在猪败血症、荨麻疹、关节炎淋巴结炎和心内膜炎中偶尔出现[4-5].国外学者从猪、牛、鸡、鱼的扁桃体、淋巴结、脾脏等器官组织中分离得到扁桃体丹毒丝菌,但其对猪或鸡没有致病性[6-8].因此,建立红斑丹毒丝菌和扁桃体丹毒丝菌的简便、快速、准确的鉴定方法,显得十分重要.
目前,用细菌分离培养、生理生化试验和血清学试验等常规方法分离和鉴定丹毒丝菌属菌种,但这些方法存在实验步骤繁琐、费时和费力等缺点.近几年来,国内外学者用多重PCR、DNA杂交和脉冲场电泳等分子生物学技术准确地区分红斑丹毒丝菌和扁桃体丹毒丝菌,但这些方法通常需要种特异性引物、杂交探针或多种限制性核酸内切酶,并且不能做到同时鉴定[9-11].研究发现,细菌rpoA,pyrH,gapA,topA和groEL等看家基因具有高度的保守性,同时,不同种属细菌之间又存在相对稳定的变异性,广泛被用于细菌的种系发生学和分类学的鉴定上.因此,本研究基于groEL基因序列对4株红斑丹毒丝菌、2株模式菌株和2株已完成全基因组测序的参考菌株进行分类鉴定,并与16S rRNA基因序列分析法比较,评价groEL基因序列分析法用于红斑丹毒丝菌和扁桃体丹毒丝菌分类鉴定的可能性.
1 材料与方法
1.1 试验材料
1.1.1 试验菌株 本研究所用供试菌C43065,C43311,C43309和C43001均购自中国兽医微生物菌种保藏管理中心.据中国兽医微生物菌种保藏管理中心提供的信息,这4株菌均分离自猪丹毒的血清型2的红斑丹毒丝菌.
1.1.2 培养基和主要试剂 脑心浸出液肉汤(BHI)培养基和BHI固体培养基均为Difco公司产品,细菌基因组DNA提取试剂盒、PCR试剂盒、胶回收试剂盒、DL2000 DNA Marker和pMD18-T载体均购自大连TaKaRa公司.
1.2 试验方法
1.2.1 菌株基因组DNA的提取 用含体积分数0.1% Tween 80的BHI液体培养基(BHI-T)活化菌株,然后将菌株接种于新鲜BHI-T培养基培养18 h,离心收集菌体,按照细菌基因组DNA提取试剂盒的使用说明书提取基因组DNA.
1.2.2 16S rRNA基因的PCR扩增 使用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),经PCR从4株红斑丹毒丝菌细菌的基因组DNA中分别扩增出16S rRNA基因片段,琼脂糖凝胶电泳检测PCR扩增产物.
1.2.3groEL基因的PCR扩增和克隆 根据红斑丹毒丝菌Fujisawa全基因组序列(Accession No.AP012027)中groEL基因序列设计引物GroEL-F(5′-ATGGCTAAAGATGTACGTTATGGAC-3′)和引物GroEL-R(5′-TTAATACATTGGCGGCATTTCAG-3′).PCR反应程序:94 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1.6 min,共循环35次;72 ℃延伸10 min.通过琼脂糖凝胶电泳检测PCR产物,用切胶回收试剂盒纯化目的DNA片段,将其克隆到pMD18-T载体上,转化大肠杆菌DH5α,采用PCR鉴定重组质粒pMD18-groEL.
1.2.4 DNA测序及Blast分析 将16S rRNA基因的PCR扩增产物和重组质粒pMD18-groEL送上海生工生物工程有限公司进行测序,运用Blast软件对目的基因序列进行同源性分析.
1.2.5系统发育树的构建 通过Blast软件分析从GenBank数据库中下载与供试菌株16S rRNA基因序列和groEL基因序列同源性较高的模式菌株和参考菌株相应基因序列,采用ClustalW软件对比,并用MEGA4.0软件计算进化距离,运用Neighhor-Joining法分别构建16S rRNA基因和groEL基因的系统发育树.
2 结果与讨论
2.1 红斑丹毒丝菌16S rRNA基因和groEL基因的PCR扩增结果
琼脂糖凝胶电泳结果显示,用16S rRNA基因引物从4株红斑丹毒丝菌基因组DNA中扩增出1.5 kb左右的PCR产物(图1),而用groEL基因引物从4株红斑丹毒丝菌基因组中扩增出大小约为1.6 kb的PCR产物(图1),与预期的目的基因片段大小相符.
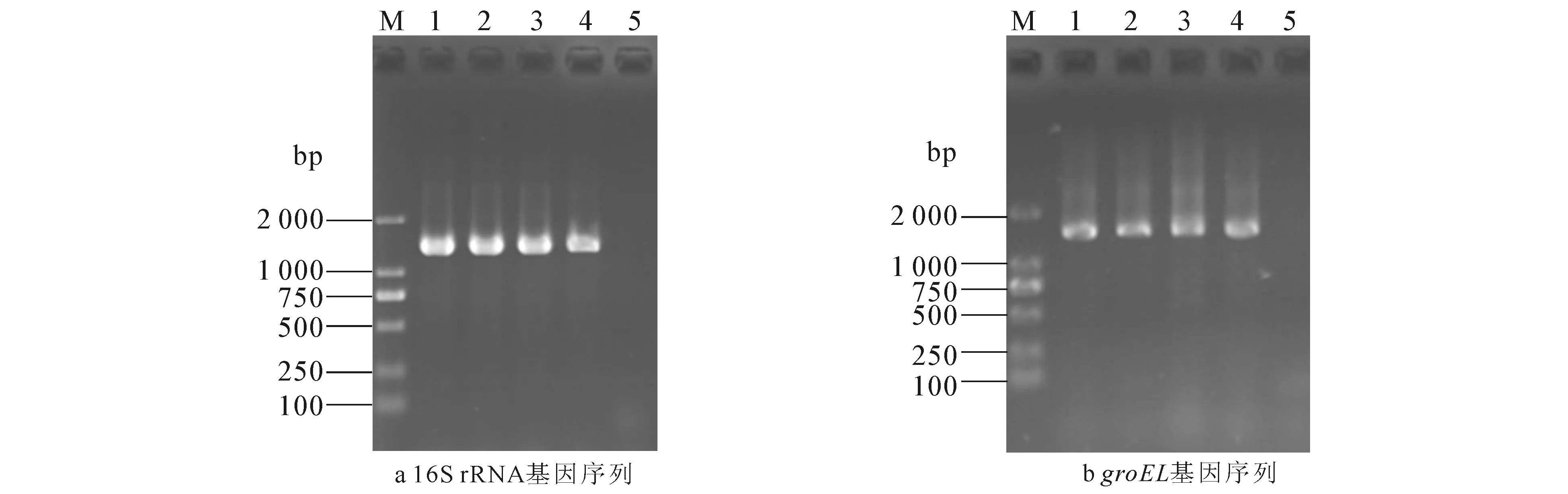
M—DNA分子量标准DL2000;1—C43065;2—C43309;3—C43311;4—C43001;5—阴性对照.
2.2 16S rRNA基因序列的同源性比较及系统发育分析
测序结果表明,4株红斑丹毒丝菌(C43065,C43309,C43311和C43001)16S rRNA基因序列长度均为1 351 bp,与红斑丹毒丝菌模式菌株ATCC19414和扁挑体丹毒丝菌模式菌株ATCC43339的相似度均为99%.系统发育分析结果显示,C43065,C43309,C43311,C43001与红斑丹毒丝菌参考菌株SY1027位于一个大分支,其中C43065和中国分离菌株SY1027[12]的亲缘关系最近(图2).但是,红斑丹毒丝菌Fujisawa和ATCC19414与扁桃体丹毒丝菌ATCC43339和JPS251209S位于一个大分支,其中红斑丹毒丝菌Fujisawa和ATCC19414的亲缘关系最近(图2).本试验结果表明,单纯采用16S rRNA基因序列分析的方法,有可能使得红斑丹毒丝菌和扁桃体丹毒丝菌的鉴定不够准确.
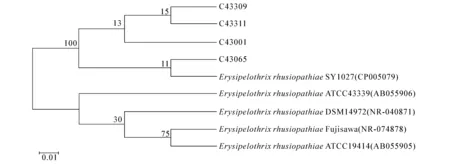
图2 丹毒丝菌属菌种16S rRNA基因序列系统发育树
2.3 groEL基因序列的同源性比较及系统发育分析
测序结果表明,4株红斑丹毒丝菌groEL基因序列长度均为1 614 bp,与红斑丹毒丝菌Fujisawa和扁桃体丹毒丝菌 ATCC43339的相似度分别为98%和86%,说明红斑丹毒丝菌和扁桃体丹毒丝菌在groEL基因序列上存在较大的变异.系统发育分析结果显示,C43065,C43309,C43311和C43001与红斑丹毒丝菌ATCC19414,SY1027和Fujisawa位于一个大的分支,其中中国红斑丹毒丝菌SY1027和日本红斑丹毒丝菌Fujisawa的亲缘关系最近(图3).但4株供试菌株、1株红斑丹毒丝菌模式菌株和2株参考菌株与扁桃体丹毒丝菌ATCC43339不再位于同一个分支上,说明它们之间的亲缘关系较远(图3).本试验结果表明,与16S rRNA基因序列分析相比,groEL基因序列分析能够较好地运用于红斑丹毒丝菌和扁桃体丹毒丝菌的鉴定.

图3 丹毒丝菌属菌种groEL基因序列系统发育树
3 分析
红斑丹毒丝菌是一种人畜共患传染病的致病菌,能引起猪丹毒、鸡败血症、人类心内膜炎、鱼类脏器出血和肾脏肿大等疾病,给世界养猪业造成重大损失,也给世界食品安全带来威胁[13-15].随着规模化养猪发展,猪丹毒似乎逐渐淡出了人们的视线,急性典型的临床病例发生比例越来越低,很多猪场已经停止使用猪丹毒的弱毒疫苗.但是近年来,在湖南省、广东省、安徽省、江西省等地区连续发生猪丹毒病[16-20],猪丹毒似乎又有卷土重来的趋势.因此,建立红斑丹毒丝菌的简便、快速、准确的鉴定方法,能为猪丹毒病的防治提供十分重要的线索.
Makino S等[19]根据红斑丹毒丝菌ATCC19414株16S rRNA基因序列设计引物M0101和M0102,用其经PCR从红斑丹毒丝菌和扁桃体丹毒丝菌基因组DNA中均能扩增出407 bp的DNA片段,但从芽孢杆菌、肠球菌、猪链球菌、乳酸乳球菌、李斯特单核细胞增生菌和金黄色葡萄球菌等革兰氏阳性菌基因组DNA中不能扩增任何DNA片段,说明基于16S rRNA基因的407 bp核苷酸序列只能鉴定丹毒丝菌,但不能区分红斑丹毒丝菌和扁桃体丹毒丝菌.Shimoji Y等[9]根据16S rRNA,23S rRNA和5S rRNA下游非编码序列设计4对种特异性引物,用引物ER1F和ER1R从红斑丹毒丝菌中扩增出399 bp的DNA片段,用引物ER2F和ER2R从扁桃体丹毒丝菌中扩增出384 bp的DNA片段,用引物ER3F和ER3R从丹毒丝菌属血清型13菌株中扩增出289 bp的DNA片段,而用引物ER4F和ER4R从丹毒丝菌属血清型18菌株中扩增出387 bp的DNA片段,表明用这4对引物经PCR可以区分和鉴定红斑丹毒丝菌和扁桃体丹毒丝菌以及血清型13和18的菌株.后来Yamazaki Y[11]用引物ERY-1F和ERY-2R从红斑丹毒丝菌基因组DNA中扩增出2 210 bp的DNA片段,但从扁桃体丹毒丝菌基因组中没有扩增出任何片段,而用引物M0101和ERS-1R从红斑丹毒丝菌和扁桃体丹毒丝菌基因组DNA中均能扩增出719 bp的DNA片段,说明用这2对引物经多重PCR可以区分红斑丹毒丝菌和扁桃体丹毒丝菌.Gupta R S[20]报道热休克蛋白HSP60是一种高度保守的蛋白质,其编码基因groEL是生物进化中的保守成分,因此groEL基因适宜作为细菌系统发育的标志物.Kwok A Y等[21]的研究表明,groEL基因比DNA-DNA杂交和16S rRNA基因分析分辨率高,可适用于葡萄球菌属菌种的分类鉴定研究.
笔者利用16SrRNA和groEL基因序列对红斑丹毒丝菌和扁桃体丹毒丝菌进行了生物信息学分析.同源性分析结果显示,4株红斑丹毒丝菌groEL基因与已报道的红斑丹毒丝菌ATCC19414和扁桃体丹毒丝菌ATCC43339的同源性分别为99%和86%,而4株红斑丹毒丝菌16S rRNA基因与红斑丹毒丝菌ATCC19414和扁桃体丹毒丝菌ATCC43339的同源性均为99%,表明groEL基因比16S rRNA基因序列分析具有更高的分辨率.从groEL基因系统发育树可以看出,菌株C43065,C43309,C43311和C43001与已报道红斑丹毒丝菌模式菌株和参考菌株聚在一个大的分支上,而4株供试菌株、红斑丹毒丝菌模式菌株和参考菌株与扁桃体丹毒丝菌模式菌株不在同一个分支上,表明红斑丹毒丝菌和扁桃体丹毒丝菌的亲缘关系较远.从16S rRNA基因系统发育树可以看出,4株供试菌株与中国分离的红斑丹毒丝菌参考菌株SY1027聚在一个大的分支上,而已报道的扁桃体丹毒丝菌ATCC43339和DSM14972与红斑丹毒丝菌ATCC19414和Fujisawa聚在另一个分支上,其中菌株菌株ATCC19414和Fujisawa的亲缘关系最近.研究结果表明,groEL基因比16S rRNA基因分析分辨率高,可适用于红斑丹毒丝菌和扁桃体丹毒丝菌的分类鉴定.
[1] TAKAHSHI T,FUJISAWA T,UMENO A,et al.A Taxonomic Study onErysipelothrixby DNA-DNA Hybridization Experiments with Nummerous Strains Isolated from Extensive Origins[J].Microbiology Immunology,2008,52(10):469-478.[2] FTHENAKIS G,CHRISTODOULOPOULOS G,LEONTIDES L,et al.Abortion in Ewes Associated withErysipelothrixRhusiopathiae[J].Small Ruminant Research,2006,63(1/2):183-188.
[3] ERIKSSON H,JANSSON D S,JOHANSSON K E,et al.Characterization ofErysipelothrixRhusiopathiaeIsolates from Poultry,Pigs,Emus,The Poultry Red Mite and Other Animals[J].Veterinary Microbiology,2009,137(1/2):98-104.[4] OPRIESSNIG T,HOFFMAN L J,HARRIS D L,et al.ErysipelothrixRhusiopathiae:Genetic Characterization of Midwest US Isolates and Live Commercial Vaccines Using Pulsed-Field Gel Electrophoresis[J].Journal of Veterinary Diagnostic Investigation,2004,16(2):101-107.
[5] TAKAHASHI T,NAGAMINE N,KIJIMA M,et al.Serovars ofErysipelothrixStrains Isolated from Pigs Affected with Erysipelas in Japan[J].Journal Veterinary Medical Science,1996,58(6):587-589.
[6] TAKAHASHI T,TAKAGI M,YAMAOKA R,et al.Comparison of the Pathogenicity for Chickens ofErysipelothrixRhusiopathiaeandErysipelothrixTonsillarum[J].Avian Pathology,1994,23(2):237-245.
[7] COLAVITA G,VERGARA A,IANIERI A.Deferment of Slaughtering in Swine Affected by Cutaneous Erysipelas[J].Meat Science,2006,72(2):203-205.
[8] HASSANEIN R,SAWADA T,KATAOKA Y,et al.Pathogenicity for Mice and Swine ofErysipelothrixIsolates from the Tonsils of Healthy Cattle[J].Veterinary Microbiology,2003,91(2/3):231-238.
[9] SHIMOJI Y,MORI Y,HYAKUTAKE K,et al.Use of an Enrichment Broth Cultivation-PCR Combination Assay for Rapid Diagnosis of Swine Erysipelas[J].Journal of Clinical Microbiology,1998,36(1):86-89.
[10] OKATANI A T,UTO T,TANIGUCHI T,et al.Pulsed-Field Gel Electrophoresis in Differentiation ofErysipelothrixSpecies Strains[J].Journal of Clinical Microbiology,2001,39(11):4 032-4 036.
[11] YAMAZAKI Y.A Multiplex Polymerase Chain Reaction for DiscriminatingErysipelothrixRhusiopathiaefromErysipelothrixTonsillarum[J].Journal of Veterinary Diagnostic Investigation,2006,18(4):384-387.
[12] KWOK A H,LI Y,JIANG J,et al.Complete Genome Assembly and Characterization of an Outbreak Strain of the Causative Agent of Swine Erysipelas-ErysipelothrixRhusiopathiaeSY1027[J].BMC Microbiology,2014,14:176.
[13] ERIKSSON H,JANSSON D S,JOHANSSON K E,et al.Characterization ofErysipelothrixRhusiopathiaeIsolates from Poultry,Pigs,Emus,the Poultry Red Mite and Other Animals[J].Veterinary Microbiology,2009,137(1/2):98-104.[14] FEASI M,BACIGALUPO L,CAPPATO S,et al.ErysipelothrixRhusiopathiaeIntra-Abdominal Abscess[J].International Journal Infectious Diseases,2010,14(1):81-83.
[15] 华 平,王 萌,刘家良,等.猪红斑丹毒丝菌主动脉瓣心内膜炎一例报道及文献复习[J].中华临床医学杂志,2013,7(10):4 277-4 280.
[16] 何世成,谈志祥,刘道新,等.3株猪红斑丹毒丝菌湖南珠的分离与鉴定[J].中国畜牧兽医,2011,38(5):155-158.
[17] 张乐宜,蔡汝健,蒋智勇,等.猪红斑丹毒丝菌GZ株的分离鉴定及序列分析[J].西北农业学报,2014,23(7):31-38.
[18] 陆 萍,黄晓慧,李春芬,等.安徽部分地区猪丹毒杆菌的分离鉴定及生物学特性研究[J].微生物学通报,2014,41(9):1 822-1 828.
[19] MAKINO S,OKADA Y,MARUYAMA T,et al.Direct and Rapid Detection ofErysipelothrixRhusiopathiaeDNA in Animals by PCR[J].Journal Clinical Microbiology,1994,32(6):1 526-1 531.
[20] GUPTA R S.Evolution of the Chaperonin Families (Hsp60,Hsp10 and Tcp-1) of Proteins and the Origin of Eukaryotic Cells[J].Molecular Microbiology,1995,15(1):1-11.
[21] KWOK A Y,SU S C,REYNOLDS R P,et al.Species Identification and Phylogenetic Relationships Based on Partial HSP60 Gene Sequences Within the GenusStaphylococcus[J].International Journal of Systematic Bacteriology,1999,49:1 181-1 192.
(责任编辑 陈炳权)
Classification and Identification of the Erysipelothrix Species Strains Based on thegroELGene Sequences
YANG Zhenlong1,NAZIERBIEKE Wulumuhan1,2,BORRATHYBAY Enotmack1,2
(1.College of Biology and Environmental Sciences,Jishou University,Jishou 416000,Hunan China;2.College of Biological and Geography Sciences,Yili Normal University,Yining 835000,Xinjiang China)
To investigate the effect of 16S rRNA gene andgroELgene used in the classification and identification of species of the genusErysipelothrix,the 16S rRNA andgroELgenes of fourE.rhusiopathiaestrains were amplified by PCR and sequenced and their phylogenetic threes was constructed.The open reading frame ofgroELgenes of four tested strains were 1 614 bp in length,and sequence similarities of thegroELgene between the four tested strains and the previously reportedE.rhusiopathiaetype strain ATCC19414 andE.tonsillarumtype strain ATCC43339 were 99% and 86%,respectively.While the 16S rRNA genes of the four tested strains was 1 351 bp in length,and sequence similarity of the 16S rRNA gene between the four tested strains andE.rhusiopathiaetype strain ATCC19414 andE.tonsillarumtype strain ATCC43339 was 99%.Phylogenetic analysis indicated that theE.rhusiopathiaeandE.tonsillarumwere differentiated well bygroELgene sequence analysis.This study demonstrated that thegroELgene is an alternative phylogenetic marker for the classification of species of the genusErysipelothrix.
Erysipelothrixrhusiopathiae;Erysipelothrixtonsillarum;16S rRNA;groEL;classification and determination
1007-2985(2015)04-0054-05
吾鲁木汗·那孜尔别克(1961—),女,新疆塔城托里人,新疆伊犁师范学院生物与地理科学学院教授,博士,主要从事病原微生物致病机理研究.
Q939.1
B
10.3969/j.issn.1007-2985.2015.04.014
