响应面法优化黄参多糖的提取工艺及其体外抗氧化活性
2015-01-08徐运飞魏燕霞王风霞高清雅
徐运飞 ,刘 琴,宋 珅,魏燕霞,王风霞,高清雅,赵 敏,张 继*
1西北师范大学生命科学学院;2 甘肃特色植物有效成分制品工程技术研究中心;3西北师范大学化学化工学院,兰州 730070
黄参是伞形科(Umbelliferae)属的单种植物迷果芹(Sphallerocarpus gracilis)的肉质根,呈淡黄色,外形酷似人参,故又名黄参。据经典本草著作《晶珠本草》记载:迷果芹涩、温、治黄水病,肾病、腰痛、肿痛,肾腰寒气病(藏药志)迷果芹全草均可入药,可祛风湿,可用于治疗风湿性关节炎[1-4]。邸多隆[5]等用60%~70%的黄参多糖提取物、0.1%~0.5%的阿斯巴甜、0.3%~1.0% 的L-薄荷脑、27%~37%的D-甘露糖醇、0.3%~1.0%的微粉硅胶及0.4%~1.5%的硬脂酸镁制备了一种黄参多糖含片,该含片口感好,具有增强免疫力、降血压、血糖和血脂的作用。
常规热水法是实验室提取多糖最常用的方法之一,具有操作简单、设备要求低、对环境友好等优点,最重要的是与其它方法相比,对天然活性物质的结构影响小,因此被广泛应用于包括多糖的水溶性活性成分的提取研究。
许多研究都表明[6],氧化与人类的许多疾病诸如癌症、动脉硬化等的发病机理有关,例如自由基引发的氧化现象是机体衰老的主要原因。适当摄入具有抗氧化活性的物质可以抑制所产生的自由基对机体造成的损伤,切断过氧化链式反应,帮助机体抵御和防治相关疾病,延缓衰老维持机体健康[7]。目前对于黄参多糖的研究较少,对其活性的研究未见报道。本实验对黄参多糖的抗氧化活性做了研究,以期为黄参的高值化开发利用和黄参多糖研究提供一定的理论基础。
1 材料与仪器
1.1 材料
黄参(甘肃省,山丹县),经西北师范大学张继教授鉴定为伞形科迷果芹属。60 ℃下干燥48 h,粉碎,过100 目筛,备用。
氯仿(分析纯),忠义化工;NaOH(分析纯),天津凯信化工有限公司;无水乙醇,天津精细化工厂;HCl(分析纯),西安化学试剂厂,纤维素酶(2 万U/g),北京卫诺恩生物技术有限公司;木瓜蛋白酶(65万U/g),上海信裕生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),四唑氮蓝(NBT),还原型辅酶Ⅰ(NADH),吩嗪硫酸甲酯(PMS),水杨酸,三氯乙酸,乙二胺四乙酸(EDTA),抗坏血酸(Vc),K2HPO4,KH2PO4,铁氰化钾,均为分析纯。
1.2 仪器
BL320H 型电子天平,日本岛津;JRA-6 型数显磁力搅拌水浴锅,金坛市杰瑞尔电器有限公司;FSH-2A 型可调高速分散器,常州华冠仪器制造有限公司;KQ-400GKDV 型实验用超声仪(恒定功率250W),常州诺基仪器有限公司;TDL5M 型台式大容量冷冻离心机,湘仪离心机厂;LGJ-185 型真空冷冻干燥机,北京松源华兴科技发展有限公司;SB-35型旋转蒸发仪,日本EYELA;UV1000 紫外可见分光光度计,Labtech;SHB-Ⅲ型多用循环真空泵等。
2 实验方法
2.1 常规热水提取法提取黄参多糖
黄参在60 ℃下干燥48 h,粉碎,过100 目筛,备用。取一定量粉碎过筛后的黄参粉末,以蒸馏水为溶剂,以一定的料液比、提取时间和提取温度条件下常规热水提取黄参多糖。提取液经4000 rpm 离心10 min,取上清60 ℃减压浓缩,加入无水乙醇至终浓度为80%,醇沉24 h,5000 rpm 离心10 min,取下层沉淀,-60 ℃冷冻干燥得到黄参粗多糖。黄参粗多糖经木瓜蛋白酶和Sevage 偶联法脱去蛋白,60 ℃减压浓缩,加入无水乙醇醇沉24 h,5000 rpm 离心10 min,取下层沉淀,-60 ℃冷冻干燥得到黄参多糖。
2.2 多糖得率的计算[8,9]
将冷冻干燥后未经脱蛋白的粗多糖在电子天平上进行称重得到黄参多糖的质量,用以下公式进行计算黄参粗多糖的得率:

2.3 常规热水提取法提取黄参多糖的单因素实验
影响热水提取黄参多糖得率的主要因素有料液比、提取时间、提取温度和提取次数等。本实验中提取次数分别选取1 次、2 次、3 次、4 次和5 次五个水平,其他参数为:料液比1∶30(g/mL),提取时间5 h,提取温度80 ℃;料液比(原料∶水)选取1 ∶10、1∶20、1∶30、1∶40 和1∶50(g/mL)五个水平,其他参数为:提取时间5 h,提取温度80 ℃;提取时间选取1、3、5、7 h 和9 h 五个水平,其他参数为:料液比1∶30(g/mL),提取温度80 ℃;提取温度选取40、50、60、70、80 ℃和90 ℃六个水平,其他参数为:料液比1∶30(g/mL),提取时间5 h。
2.4 热水法提取黄参多糖的响应面实验设计
在热水法提取黄参多糖单因素实验基础上进行响应面试验,确定了提取时间、提取温度及液料比的最佳工艺参数,以多糖得率为指标,因素水平见表1。
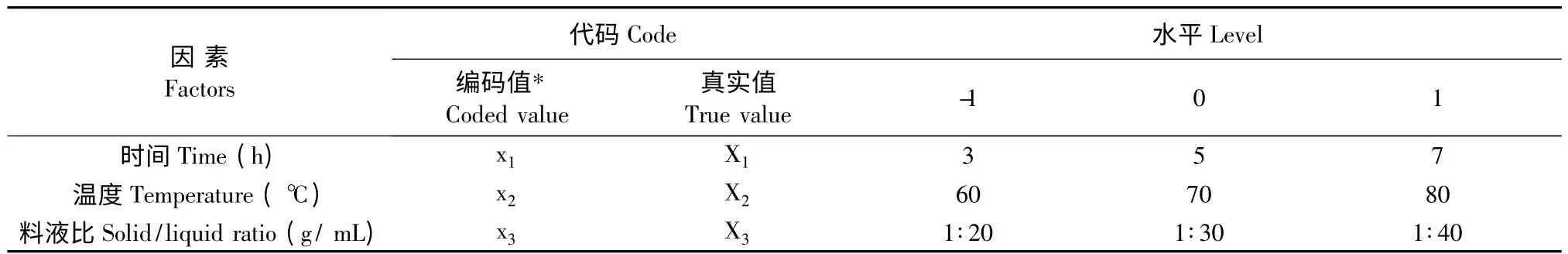
表1 实验因素、水平及编码Table 1 Experiment factors,levels and code
2.5 黄参多糖的体外抗氧化活性评价
2.5.1 黄参多糖对DPPH 自由基的清除作用
准确称取一定量的VC和黄参多糖,充分溶解后配制浓度为5.0 mg/mL 的母液,再稀释至浓度分别为2、1、0.6、0.2、0.1、0.06、0.02 mg/mL,取1 mL不同质量浓度(0.02~2 mg/mL)的多糖溶液、2 mL DPPH 溶液(现用现配)、2 mL 甲醇溶液充分混合均匀后在黑暗中静置30 min,在517 nm 处测定吸光值[10]。以VC作为阳性对照。每个样品重复三次,求平均值。DPPH 自由基清除率公式如下:
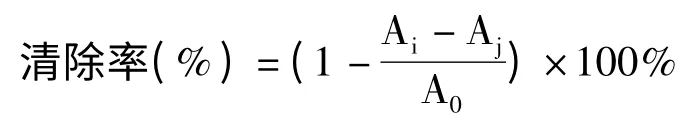
式中:A0表示无样品的DPPH 溶液的吸光值;Ai表示待测样与DPPH 混合溶液的吸光值;Aj表示不加DPPH 的样品的吸光值。
2.5.2 黄参多糖对·OH 自由基的清除作用
准确称取一定量的VC和黄参多糖,充分溶解后配制浓度为5.0 mg/mL 的母液,再稀释至浓度分别为2、1、0.6、0.2、0.1、0.06、0.02 mg/mL,将2 mL多糖溶液、2 mL 6 mmol/L 的FeSO4溶液、H2O2溶液混匀后静置10 min,再加入2 mL 6 mmol/L 的水杨酸溶液,混匀,静置30 min 后,在510 nm 处测定吸光值[11]。以VC作为阳性对照组。每个样品重复三次,求平均值。·OH 清除率计算公式如下:
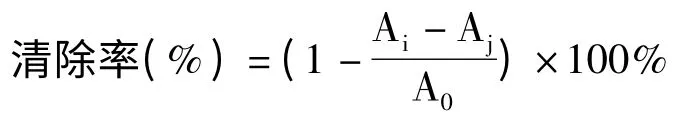
式中:A0表示无样品的混合反应液的吸光值;Ai表示待测样与混合反应液的吸光值;Aj表示不加水杨酸的样品溶液的吸光值。
PMS/ NADH 体系会产生超氧阴离子自由基,用NBT 显色法测定。准确称取一定量的VC和黄参多糖,充分溶解后配制浓度为5.0 mg/mL 的母液,再稀释至浓度分别为2、1、0.6、0.2、0.1、0.06、0.02 mg/mL,反应混合物中依次加入不同浓度的多糖溶液,Tris-HCl (16 mmol/L,pH 8.0),NADH (557 μmol/L),NBT(108 μmol/L)和PMS(45 μmol/L),在25 ℃温浴5 min,在560 nm 下测吸光值[12]。以VC作为阳性对照组。每个样品重复三次,求平均值。清除率公式如下:
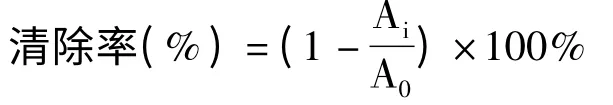
式中:A0表示无样品的混合反应液的吸光值;Ai表示待测样与混合反应液的吸光值。
2.5.4 还原力的测定
准确称取一定量的黄参多糖和VC,充分溶解后配制浓度为5.0 mg/mL 的母液,再稀释至浓度分别为2、1、0.6、0.2、0.1、0.06、0.02 mg/mL。不同浓度的多糖溶液(0.02~2 mg/mL)1 mL、2.5 mL 0.2 mol/L 磷酸缓冲液(pH=6.6)、铁氰化钾[K3Fe(CN)6]溶液(1%)2.5 mL 混合均匀,50 ℃水浴20 min。加入10%的三氯乙酸溶液终止反应。在700 nm 下测吸光值[13]。以VC作为阳性对照,吸光值越高还原力越强。
3 结果与讨论
3.1 常规热水提取法提取黄参多糖
3.1.1 单因素结果与分析
3.1.1.1 提取次数对黄参多糖得率的影响
由图1a 得知,随着提取次数的增加,黄参多糖的得率呈现迅速增加的趋势,在提取次数达到3 次以上时,随着提取次数的增加多糖得率增幅缓慢,为了节约资源,简化操作,确定次数为3 次。
3.1.1.2 提取时间对黄参多糖得率的影响
由图1(b)得知,在一定范围内,随着提取时间的延长,黄参多糖的得率先增大后减小,在提取时间为5 h 时,多糖得率最高。这是因为处理时间太短,原料中的多糖溶解不充分;而时间过长,会使多糖降解为单糖、寡糖或低聚糖,导致得率的下降[8]。因此,提取时间应确定为5 h。
3.1.1.3 提取温度对黄参多糖得率的影响
由图1(c)可知,提取温度对黄参多糖得率的影响显著,随着提取温度的升高,多糖得率显著提高,在70 ℃时最高,温度过高时,溶液中的多糖会有损失,所以温度在达到一定水平后,多糖得率逐渐降低,而且温度过高可能会造成多糖活性的丧失。因此,确定提取温度为70 ℃。
3.1.1.4 料液比对黄参多糖的率的影响
由图1(d)可知,料液比对多糖得率的影响较为显著,随着料液比的增大多糖的得率逐渐增加,在料液比为1∶30(g/mL)时得率最高,随后随着料液比的增大多糖得率逐渐降低。这可能是因为料液比小,提取体系中含水量少,原料中的多糖不能充分溶出,料液比太大,浓缩时间延长,导致多糖损失[14],得率降低。因此,因选择料液比为1∶30(g/mL)。
3.1.2 响应面法优化热水提取黄参多糖的工艺研究
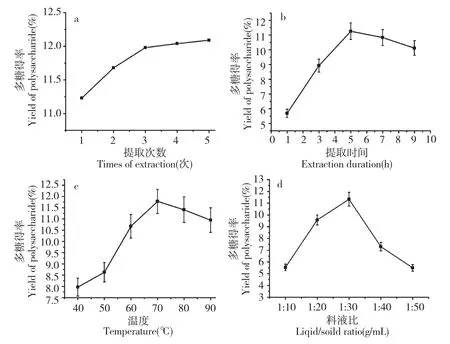
图1 提取次数(a)、提取时间(b)、温度(c)及料液比(d)对多糖得率的影响Fig.1 The effect of times of extraction (a),extraction duration(b),extraction temperature(c)and solid/liquid ratio (d)on the yield of polysaccharide
以黄参多糖得率为响应值Y,通过SAS 软件对试验资料进行响应面分析,共17 个试验点,其中12个为析因点,5 个为零点,析因点为自变量取值在X1、X2、X3所构成的三维顶点;零点为区域的中心点,其中零点试验重复5 次,用以估算试验误差[15]。试验结果见表4,经二次回归拟合后求得响应函数,得到的回归方程如下:
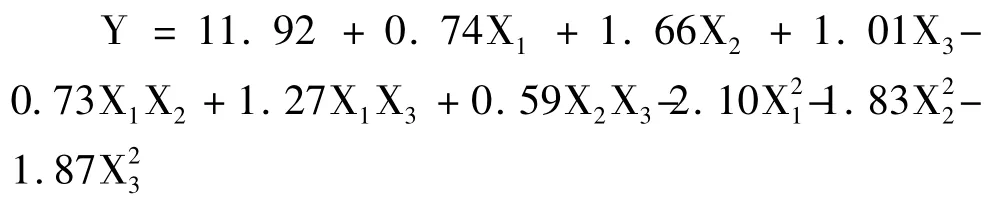
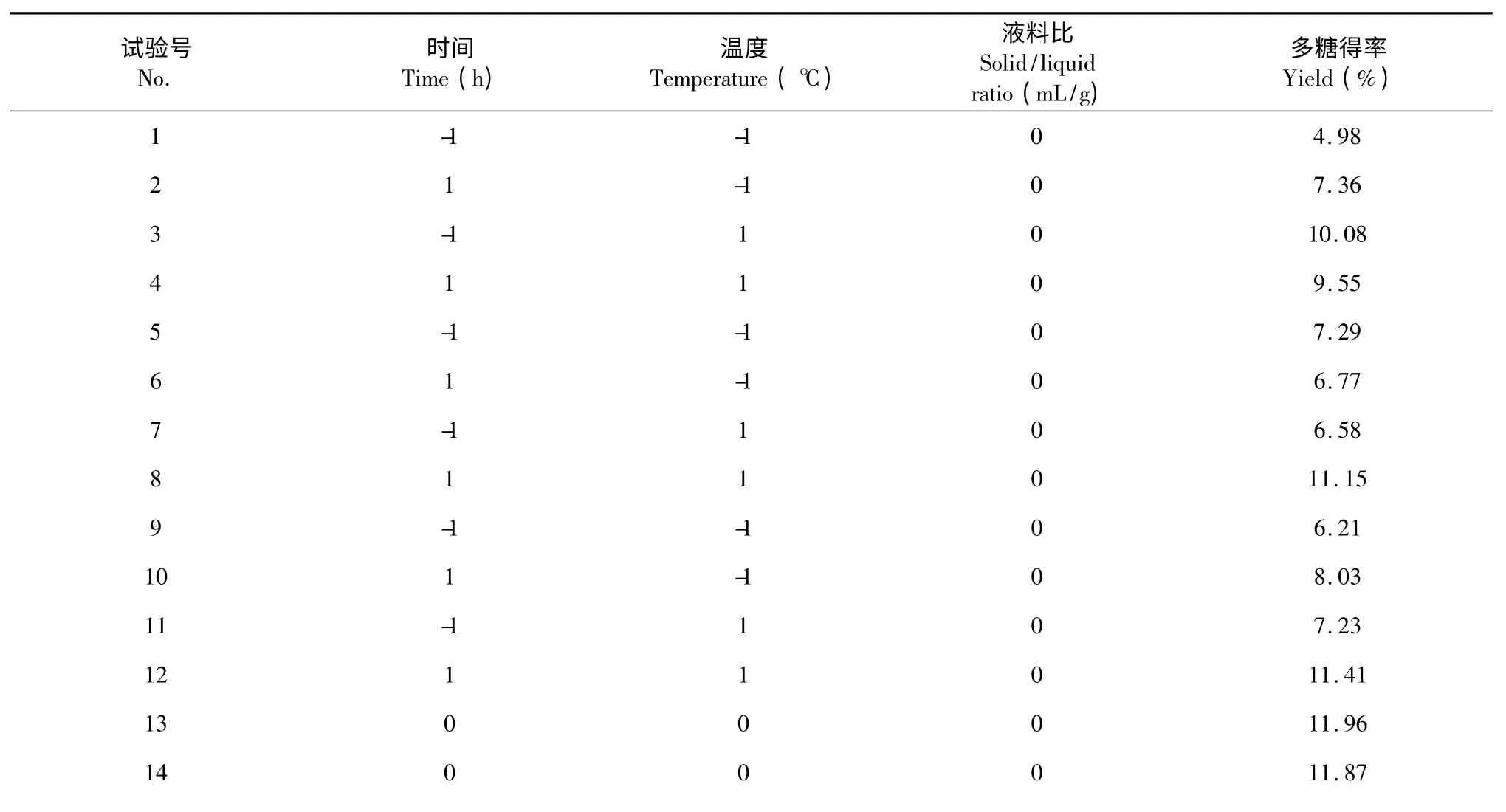
表2 响应面实验设计及结果Table 2 RSM design matrix and the responses
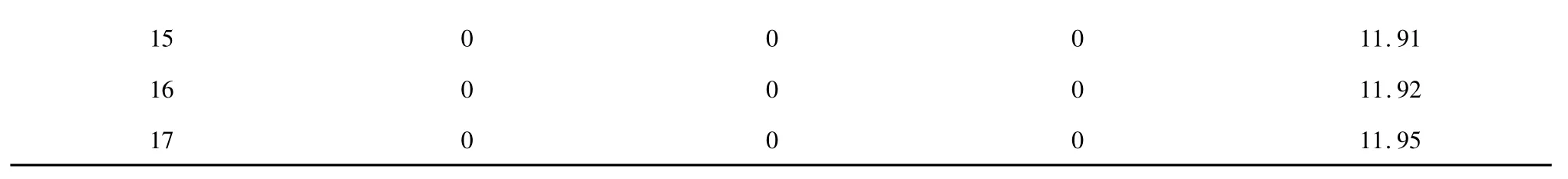
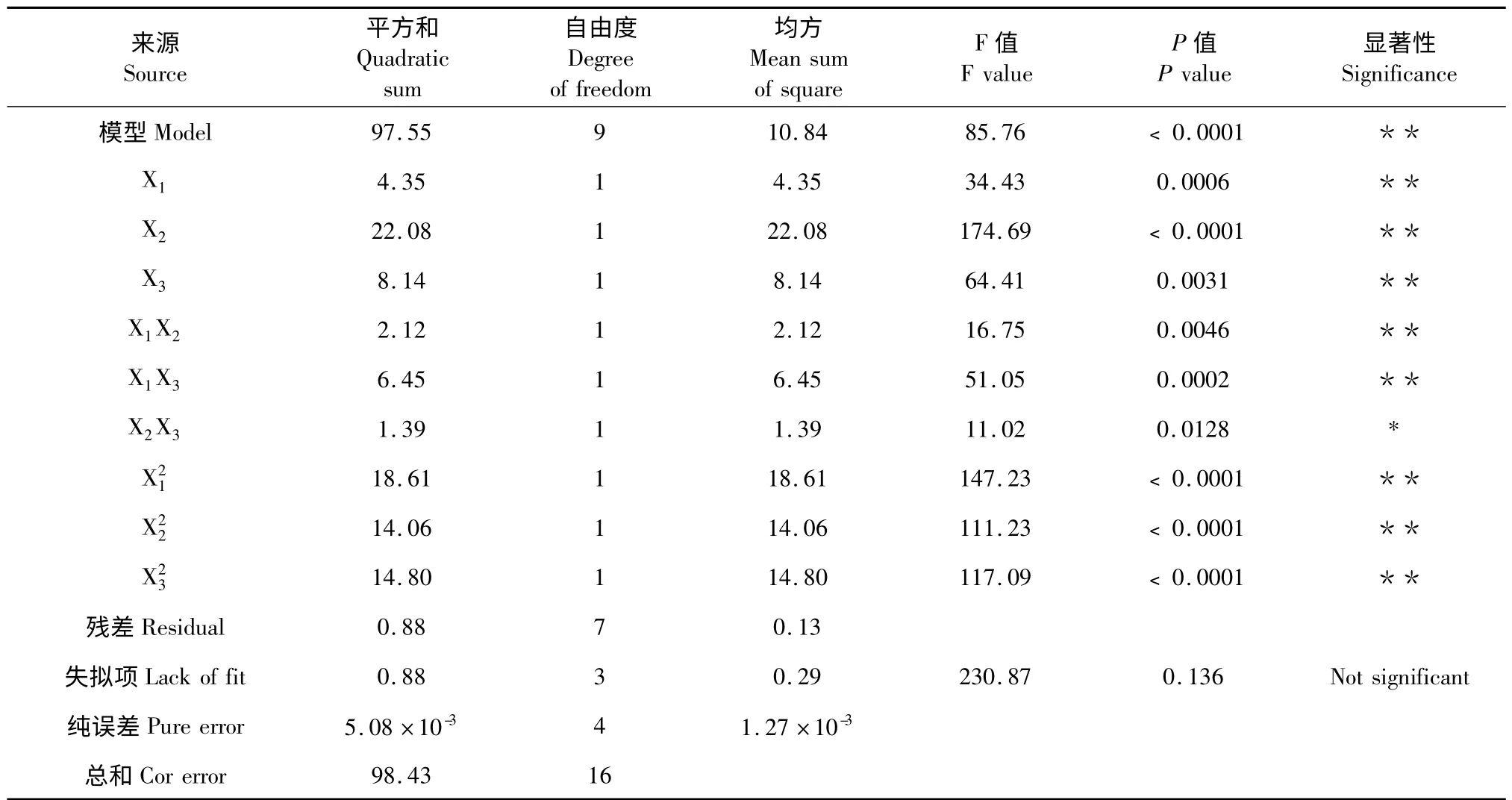
表3 多糖得率回归模型系数的显著性检验Table 3 Regression coefficient and ANOVA test of the yield of polysaccharide
方差分析见表3。模型误差显著,失拟误差不显著,回归系数R2为0.991,说明模型的拟合度很好,响应值的99.1%的是由于所选变量引起的,决定系数(R2adj=0.9795)接近于1,变异系数(C.V.=3.87%)很低,都说明模型相关性高,用该模型模拟真实的三因素三水平的分析是可行的[16]。可以用该模型方程来分析和预测不同提取条件下黄参多糖的得率的变化。
由表3 的结果可以看出三个因素对多糖得率影响的主次是X2>X1>X3,一次项XI、X2、X3,二次项和交互项XIX2、XIX3都是极显著的,表明各因素不是简单的线性关系,且对响应值的影响有明显的交互作用。
从响应面分析图2(a)、(b)和(c)中可以看出响应值与影响因素的关系:提取温度对黄参多糖提取率的影响最为显著,表现为曲线较陡,其次依次为提取时间和料液比,表现为曲线较平缓。
3.1.3 优化提取参数
根据所得模型由SAS 软件分析得到黄参多糖热水提取的最佳条件为:提取时间为5.44 h,温度为74.79 ℃,料液比为1∶34.19(g/mL),理论最佳提取率为12.61%。为了检验响应面法的可行性,采用得到的最佳提取条件进行黄参多糖热水提取的验证实验,同时考虑到实际操作和生产的便利,因此将热水提取黄参多糖的各个实验因素条件修订为:时间5.45 h,温度为75 ℃,料液比为1∶34(g/mL)。经过5 次平行实验,得到的平均得率为12.52%。提取率与预测结果契合度高,说明该工艺稳定可行,适合黄参多糖的提取。
3.2 黄参多糖的体外抗氧化活性
3.2.1 黄参多糖对DPPH·自由基的清除作用
DPPH·自由基被认为一种很稳定的以氮为中心的自由基,若受试物可以清除它,则表明受试物具有抗氧化活性。DPPH·有个单电子,在517 nm 有最大吸收,其甲醇溶液呈深紫色,加入有抗氧化活性的受试物后能与DPPH·的单电子配对,从而使得DPPH·的浓度减小颜色变浅,光吸收值减小[17]。黄参多糖对DPPH·自由基的清除作用见图3(a)。结果显示,在实验浓度范围内,黄参多糖对DPPH·自由基有一定的清除作用,随着浓度的升高,清除作用也逐渐加强,当黄参多糖浓度为2 mg/mL 时,对DPPH·自由基的清除率可达到63%。
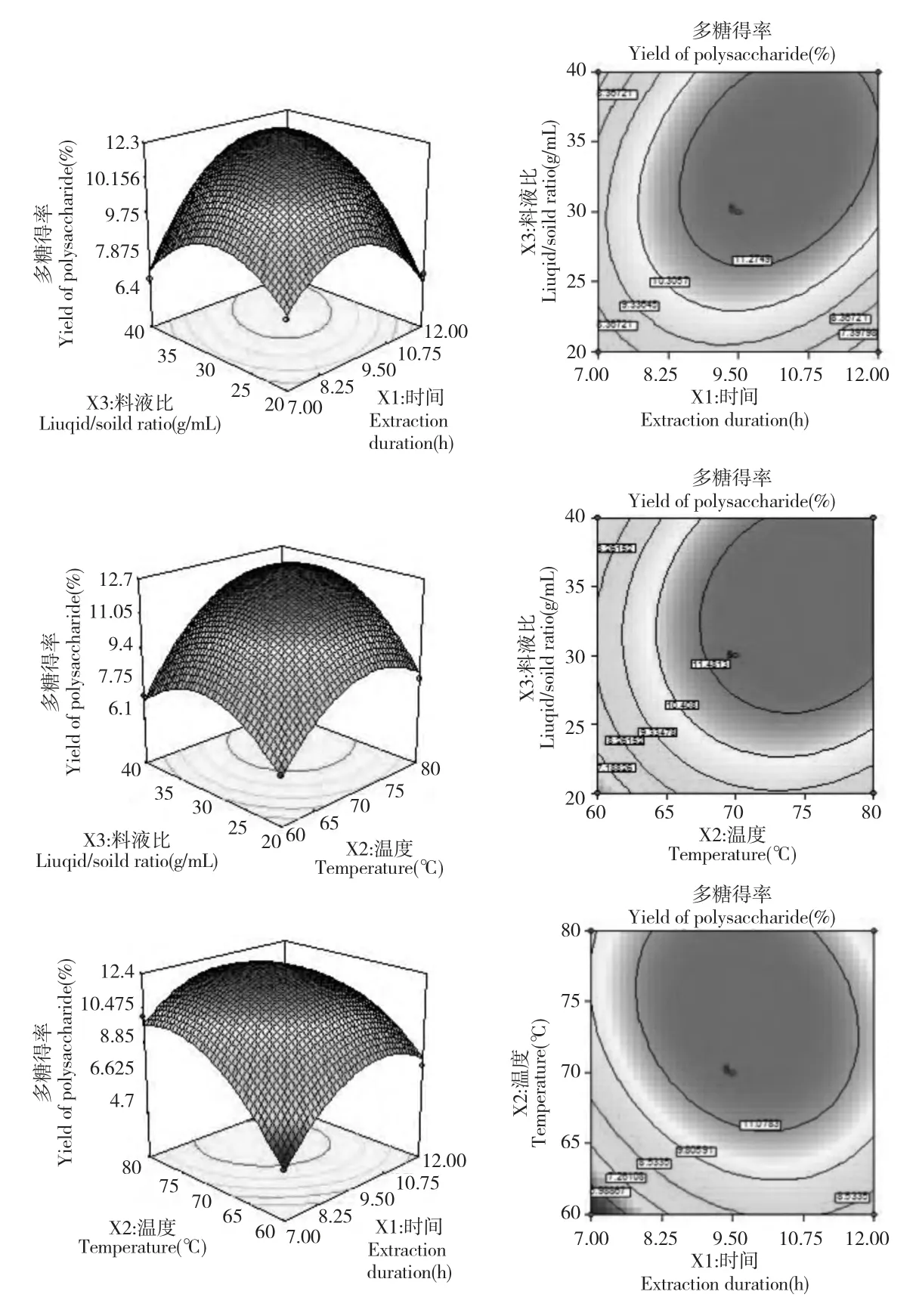
图2 提取时间和料液比(a)、料液比和提取温度(b)及提取温度和提取时间(c)对黄参多糖提取率影响的响应面图和等高线图Fig.2 Response surface plots and contour plots showing the effects of extraction duration and solid/liquid ratio (a),solid/liquid ratio and extraction temperature (b)and extraction duration and extraction temperature (c)on extraction yield of S.gracilis polysaccharide
3.2.2 黄参多糖对·OH 自由基的清除作用
·OH 是一种活性氧自由基,毒性极强,可造成生物膜损伤,导致多种疾病发生,物理辐射等因素都会促进其形成[18]。黄参多糖对·OH 自由基的清除作用与黄参多糖的浓度成正相关,见图3(b),当黄参多糖浓度为2 mg/mL 时,对·OH 自由基的清除率可达72.3%。
3.2.3 黄参多糖对超氧自由基的清除作用
超氧阴离子自由基是人体内产生的一种活性氧自由基,能引发体内脂质过氧化,加快肌体的衰老,诱发癌症、心血管疾病,严重危害人体健康[19]。实验结果表明黄参多糖对超氧自由基有一定的清除作用,如图3(c)所示,随着黄参多糖浓度的增加,清除作用逐渐增强,多糖浓度为5 mg/mL 时对超氧阴离子自由基的清除为78.2%。
3.2.4 还原力
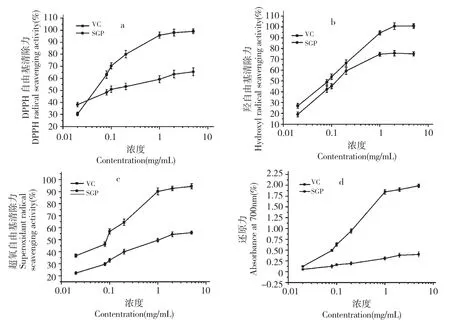
图3 黄参多糖与Vc 对DPPH·自由基(a)、·OH 自由基(b)及超氧自由基(c)的清除能力及还原力(d)比较Fig.3 Comparison of DPPH radical scavenging ability (a),hydroxyl radical scavenging ability (b),super radical scavenging ability(c)and reducing power (d)of S.gracilis polysaccharide and Vc
抗氧化剂是通过自身的还原作用给出电子而清除自由基,还原力越强,抗氧化性越强[20]。因此,可通过测定还原力来说明其抗氧化活性的大小。从图3(d)可以看出,与VC相比,黄参多糖的还原力很弱,随着黄参多糖浓度的增加,其总还原力呈缓慢增大,总体上呈现出一定的浓度依赖性。
4 讨论与结论
多糖又称多聚糖,是机体内一类重要的生物活性物质,由一种或多种单糖通过糖苷键连接而成,广泛存在于动物、植物、真菌等有机体中,与脂质、蛋白质、核酸一起被视为生物体中最重要的4 种生物大分子物质[21]。现代研究证明多糖有多种生物活性和功能,如抗氧化、抗肿瘤、抗辐射、抗凝血、降血糖、免疫调节等。丁春邦等用热水法、微波法和酶法从淫羊藿中提取多糖并对几种方法得到的多糖的抗氧化活性做了评价,结果表明热水法得到的多糖抗氧化活性最高。陈群和刘家昌[22]在对人参多糖、黄芪多糖和枸杞多糖的研究中发现,人参多糖、黄芪多糖和枸杞多糖具有免疫调节活性和抗衰老作用;人参多糖、黄芪多糖还具有抗肿瘤作用[23]。
本文利用常规热水提取法提取黄参多糖,通过单因素实验和响应面优化得到了其提取工艺的最佳工艺参数;常规热水提取法提取黄参多糖的提取方法提取工艺条件为:时间5.45 h,温度为75 ℃,料液比为1∶34(g/mL),多糖得率为12.52%。该方法省时、环保,多糖得率高,适合黄参多糖的提取。与其它提取工艺相比,该方法的特点是简单有效,在一般实验室条件下都能够实现,能够被广泛应用,而且提取多糖的得率较高。并且,通过考察黄参多糖对和自由基的清除能力以及对亚铁离子螯合作用和还原力的作用,结果表明,黄参多糖具有良好的抗氧化活性,为对其深入研究提供了一定的理论基础。
1 Yu RT(于瑞涛),Zhu PC(朱鹏程),Tao Y(陶燕),et al.Sulfuric acid-phenol method forSphallerocarpus gracilispolysaccharide content measurement.Chin J Anal Lab(分析试验室),2008,27:222-224.
2 Yang CH(杨粹华),Gu LN(顾琳娜).The identification ofCodonopsis pilosulaandSphallerocarpus gracilis.Chin J Hosp Phar(中国医院药学杂志),2004,24:789-790.
3 Jia HX(贾恢先),Chu Q(邹卿),Ye XQ(叶相清).Study on distribution and content of trace elements of Shandan Huangshen.Acta Botan Boreali-Occidentalia Sin(西北植物学报),2001,21:188-190.
4 Xue GY(薛澒燕).The research on Chinese components and biological activity of Shandan Huang.Lanzhou:Lanzhou University of Technology,MSc.2011.
5 Di DL(邸多隆),Huang XY(黄新异).Chin Patent(中国专利):200710307289.1,2009.
6 Qu YH(曲映红),Liu ZD(刘志东),Chen SS(陈舜胜).Study on antioxidant activity ofOctopamineand its derivatives.Nat Prod Res Dev(天然产物研究与开发),2015,27:255-258.
7 Cheng XY(成喜雨),Cui X(崔馨),Liu CC(刘春朝),et al.Recent advances of antioxidant activity of Chinese herbal meidical.Nat Prod Res Dev(天然产物研究与开发),2006,18:514-518.
8 Zhao BT,Zhang J,Guo X,et al.Microwave-assisted extraction,chemical characterization of polysaccharides fromLilium davidii var.unicolor Salisband its antioxidant activities evaluation.Food hydrocolloids,2013,31:346-356.
9 Song S(宋珅),Zhao BT(赵保堂),Yin ZX(殷振雄),et al.Extraction and separation of polysaccharides from uatermelon seeds and its monosaccharide composition analysis by GC-MS.Food Ferment Ind(食品与发酵工业),2013,39:238-245.
10 Yang Q,Chen H,Zhou X,et al.Optimum extraction of polysaccharides fromOpuntia dilleniiand evaluation of its antioxidant activities.Carbohydr Polym,2013,97:736-742.
11 Dalonso N,de Oliveira Petkowicz CL.Guarana powder polysaccharides:characterisation and evaluation of the antioxidant activity of a pectic fraction.Food Chemi,2012,134:1804-1812.
12 Wang C,Wang Y,Zhang J,et al.Optimization for the extraction of polysaccharides fromGentiana scabraBunge and their antioxidantin vitroand anti-tumor activityin vivo.J Taiwan Instit Chem Eng,2013,12:802-809.
13 Wang S,Dong X,Tong J.Optimization of enzyme-assisted extraction of polysaccharides from alfalfa and its antioxidant activity.Int J Biol Macromole,2013,62:387-396.
14 Wang JL,Zhang J,Wang XF,et al.A comparison study on microwave-assisted extraction ofArtemisia sphaerocephalapolysaccharides with conventional method:Molecule structure and antioxidant activities evaluation.Int J Biol Macromol,2009,45:483-492.
15 Gan C,Aishah AL.Extraction of antioxidant pectic polysaccharide from mangosteen (Garcinia mangostana)rind:Optimization using response surface methodology.Carbohyd Polym,2011,83:600-607.
16 Yan YL,Yu CH,Chen J,et al.Ultrasonic-assisted extraction optimized by response surface methodology,chemical composition and antioxidant activity of polysaccharides fromTremella mesenterica.Carbohydr Polym,2011,83:217-224.
17 Ma LH(马利华),Qin WD(秦卫东).Study on the antioxidant and monosaccharide composition ofZingiber officinaleRoscoe polysaccharide.Food Technol Food Ind(食品工业科技),2010,7:120-124.
18 Xu JJ(许晶晶),Tang ZH(唐志红),Wang JY(王景玉).Study on purification and antioxidant activity of polysaccharides fromEnteromorpha.Food Technol Food Ind(食品工业科技),2009,10:134-136.
19 Wu Z,Li H,Tu DW,et al.Extraction optimization,preliminary characterization,and in vitro antioxidant activities of crude polysaccharides from finger citron.Ind Crops Prod,2013,44:145-151.
20 Cheng HR,Feng SL,Jia XJ,et al.Structural characterization and antioxidant activities of polysaccharides extracted fromEpimedium acuminatum.Carbohydr Polym,2013,92:63-68.
21 Sai FDABL(赛福丁阿不拉),Wang MJ(王君敏),Mi KRM(米克热木),et al.Progress on antivirus and immune enhancement activity of polysaccharides and sulfated derivatives.Nat Prod Res Dev(天然产物研究与开发),2013,25:572-575.
22 Cheng HR,Feng SL,Ding CB,et al.Structure characterization and antioxidant activities of polysaccharide extracted fromEpimedium cuminatum.Carbohydr Polym,2013,92:63-68.
23 Chen Q(陈群),Liu JC(刘家昌).The research advance ofPanax ginsengpolysaccharides,Astragalus membranaceuspolysaccharides andLycium barbarum L.polysaccharides.J Huainan Teachers Coll(淮南师范大学学报),2001,10:39-41.
