裂壶藻渣酶解产物的抗氧化稳定性
2015-01-03杨贤庆李来好吴燕燕林婉玲
胡 晓,武 琼,2,杨贤庆,*,李来好,吴燕燕,林婉玲,戚 勃
裂壶藻渣酶解产物的抗氧化稳定性
胡 晓1,武 琼1,2,杨贤庆1,*,李来好1,吴燕燕1,林婉玲1,戚 勃1
(1.中国水产科学研究院南海水产研究所,国家水产品加工技术研发中心,农业部水产品加工重点实验室,广东 广州 510300;2.中国海洋大学食品科学与工程学院,山东 青岛 266003)
本实验以裂壶藻渣酶解产物对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力及其还原力活性为评价指标,探讨温度、pH值、食品辅料、防腐剂、金属离子及人工胃肠道模拟环境对其抗氧化活性的影响。结果表明:在30~100 ℃的范围内温度变化对裂壶藻渣酶解产物的抗氧化活性影响不明显;在酸性环境中酶解产物可以较好地保持活性;蔗糖及NaCl对酶解产物活性影响不显著,葡萄糖在质量分数2%~10%范围内,随质量分数提高,对其活性的影响渐增;防腐剂山梨酸钾对酶解产物活性的影响略强于苯甲酸钠;金属离子对样品活性的影响大小为:Zn2+>Cu2+>K+>Ca2+;体外模拟胃肠实验中,酶解产物经胃肠液处理后其活性保持率可达65%以上。
裂壶藻;抗氧化;酶解产物;稳定性
目前,生产应用的抗氧化剂主要包括两种:合成抗氧化剂和天然抗氧化剂。随着人们对食品安全和健康问题的关注和日益重视,具有较多弊病的合成抗氧化剂已证实对人体具有毒害及蓄积致癌作用,并被一些国家明令禁止用于食品中[1]。于是,天然抗氧化剂的研究逐渐成为多学科领域的热点[2-4]。
近年来,利用水产蛋白酶解产物制备具有抗氧化活性肽已越来越受到关注,相关研究主要集中在鱼、虾、贝等水产资源,而关于微藻蛋白酶解产物的抗氧化活性与稳定性的研究报道较少[5-11]。海洋微藻作为一类原始而十分重要的海洋生物资源,富含多不饱和脂肪酸、多糖、多肽等多种生物活性物质,现主要用于制备生物能源及水产养殖饲料,关于抗氧化活性物质制备的报道更为少见[12-18]。裂壶藻是一类富含多不饱和脂肪酸的微藻,常被用来生产高纯度二十二碳六烯酸(docosahexaenoic acid,DHA)的保健品、婴幼儿乳制品添加剂等。裂壶藻经提取多不饱和脂肪酸后所产生的藻渣其蛋白质含量可高达40%以上,然而目前这些藻渣大多被当成饲料或肥料处理,蛋白资源未得到充分开发与利用。本研究以裂壶藻经提取油脂后的藻渣为原料,利用复合蛋白酶与Alcalase 2.4 L复配酶解方式制备抗氧化肽,研究温度、pH值、食品辅料、防腐剂、各种金属离子及模拟胃肠环境对裂壶藻渣酶解产物抗氧化稳定性的影响,以期利用裂壶藻渣制备高活性抗氧化肽,从而为裂壶藻渣的高值化利用及产品开发提供理论依据和重要参考。
1 材料与方法
1.1 材料与试剂
裂壶藻渣(蛋白含量40%)购于广东润科生物工程有限公司。
Alcalase 2.4 L蛋白酶 丹麦诺维信公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;复合蛋白酶、氢氧化钠、盐酸、无水乙醇、三氯乙酸、磷酸氢二钠、磷酸二氢钠、铁氰化钾、氯化铁、硫酸亚铁 广州齐云生物技术有限公司。
1.2仪器与设备
Delta320精密pH计 瑞士Mettler-Toledo公司;DKS24型恒温水浴锅 上海森信实验仪器厂有限公司;BS 224S型电子精密天平德国Sartorius公司;3K30型高速冷冻离心机 德国Sigma公司;AvantiJ26XP型高速离心机美国Beckman Coulter公司;Alpha1-4型冷冻干燥机 德国Christ公司;Sunrise-basic TACAN吸光酶标仪 瑞士Tecan公司;UV2550型紫外-可见分光光度计日本岛津公司。
1.3方法
1.3.1抗氧化肽样品的制备
称取一定质量藻渣,按1∶12(m/m)料水比加水,搅拌均匀,调节pH值至7.5,待读数稳定后按酶总量质量分数0.5%加入复合蛋白酶和Alcalase 2.4 L蛋白酶(1∶1,m/m),置于水浴锅50℃恒温水解4 h。酶解结束后,将酶解液置于沸水浴中灭酶处理10 min,之后取出冷却至室温,10 000 r/min离心,所得上清液冷冻干燥后所得粉末即为实验用样品。
1.3.2 DPPH自由基清除能力测定
参照Bae等[19]的测定方法并加以修改。取0.5 mL样品,加入0.5 mL DPPH乙醇溶液(2×10-4mol/L DPPH溶于无水乙醇),混匀后室温下避光20 min,10 000 r/min离心10 min,于517 nm波长处测定吸光度(Ai)。空白组为0.5 mL无水乙醇代替DPPH乙醇溶液,测定517 nm波长处吸光度(Aj)。对照组以0.5 mL无水乙醇代替样品,测定517 nm波长处吸光度(A0)。按照公式(1)计算DPPH自由基清除率。
1.3.3还原力测定
参照Ahmadi等[20]的测定方法并加以修改。取待测样液1 mL,加入质量分数1%的铁氰化钾溶液1 mL、0.2 mol/L磷酸盐缓冲液(pH 6.6)1 mL,混匀后于50℃水浴保温20 min,再加入质量分数10%三氯乙酸(trichloroacetic acid,TCA)1 mL,振荡混匀后10 000 r/mim离心10 min。取上清液1 mL,加入1 mL去离子水和0.2 mL质量分数0.1%的氯化铁溶液,振荡混匀后置于50℃保温10 min,体系变为蓝色,再于700 nm波长处测定吸光度。每组实验做两组平行对照,并以去离子水代替样品作空白对照。
1.3.4活性保持率计算
按照公式(2)、(3)分别计算抗氧化肽样品的DPPH自由基清除能力保持率和还原力保持率。
式中:A1、A2分别表示处理前后样品DPPH自由基清除率;A3、A4分别表示处理前后样品还原力大小。
1.3.5酶解产物稳定性影响因素实验
1.3.5.1温度的影响测定
将蛋白质质量浓度分别为1 mg/mL和2 mg/mL的酶解产物分别在30、50、70、90、100℃水浴中恒温处理1 h后,冷却至室温,测定其DPPH自由基清除率及还原力大小,每组重复3次(其中1 mg/mL质量浓度产物用于测量DPPH自由基清除率,2 mg/mL质量浓度产物用于测量还原力大小,下同)。
1.3.5.2 pH值的影响测定
分别用1 mol/L的HCl和1 mol/L的NaOH溶液调节pH值为2、4、6、8、10、12,配制质量浓度分别为1 mg/mL和2 mg/mL的酶解产物,测定其DPPH自由基清除率及还原力大小,每组重复3次。
1.3.5.3食品辅料的影响测定
配制蛋白质质量浓度分别为1 mg/mL和2 mg/mL的酶解产物,向其中分别添加不同质量分数的葡萄糖、蔗糖及NaCl溶液,测定其DPPH自由基清除率及还原力大小,每组重复3次。
1.3.5.4防腐剂的影响测定
分别配制蛋白质质量浓度为1 mg/mL和2 mg/mL的酶解产物,分别添加不同质量分数的山梨酸钾和苯甲酸钠,测定其DPPH自由基清除率及还原力大小,每组重复3次。
1.3.5.5金属离子的影响测定
配制蛋白质质量浓度分别为1 mg/mL和2 mg/mL的酶解产物,分别添加不同质量浓度的K+、Ca2+、Zn2+、Cu2+金属离子溶液,测定其DPPH自由基清除率及还原力大小,每组重复3次。
1.3.6酶解产物体外模拟胃肠道消化系统稳定性实验
1.3.6.1人工胃液、人工肠液的配制
根据《中华人民共和国药典》2005年版[21]配制。
人工胃液:取0.1 mol/L的HCl 1.64 mL,用适量水溶解1 g胃蛋白酶,将两者混匀定容于100 mL容量瓶待用;
人工肠液:用适量水溶解0.68 g磷酸氢二钾,再用0.1 mol/L NaOH溶液调节pH值为6.8,加入1 g胰蛋白酶混匀,用水定容至100 mL待用。
1.3.6.2人工胃液对抗氧化肽稳定性的影响
配制蛋白质质量浓度分别为1 mg/mL和2 mg/mL的酶解产物,每一酶解产物各取4份,每份10 mL,分别添加人工胃液1 mL,置于37℃水浴中保温,并分别于15、30、60、120 min取1份样品,于100℃水浴灭酶处理10 min后,按照1.3.2节及1.3.3节方法测量DPPH自由基清除率及还原力大小,每组设置2组平行。
1.3.6.3人工肠液对抗氧化肽稳定性的影响
配制蛋白质质量浓度分别为1 mg/mL和2 mg/mL的酶解产物,每一样品各取4份,每份10 mL,分别添加人工肠液1 mL,置于37℃水浴中保温,并分别于15、30、60、120 min时取出,保温结束立即于100℃水浴灭酶处理10 min,按照1.3.2节及1.3.3节方法测定DPPH自由基清除率及还原力大小,每组设置2组平行。
1.3.6.4模拟人工肠胃环境对抗氧化肽稳定性的影响
配制蛋白质质量浓度分别为1 mg/mL和2 mg/mL的酶解产物各10 mL,分别添加人工胃液1 mL,于37℃水浴保温2 h,再添加1 mL人工肠液,继续保温2 h,结束后立即于沸水浴灭酶处理10 min,测定DPPH自由基清除率及还原力大小,每组设置2组平行。
2 结果与分析
2.1酶解产物稳定性影响因素分析
2.1.1温度对酶解产物抗氧化稳定性的影响
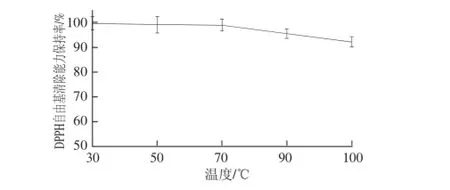
图1 温度对酶解产物DPPH自由基清除能力的影响Fig.1 Effect of temperature on DPPH radical scavenging capacity
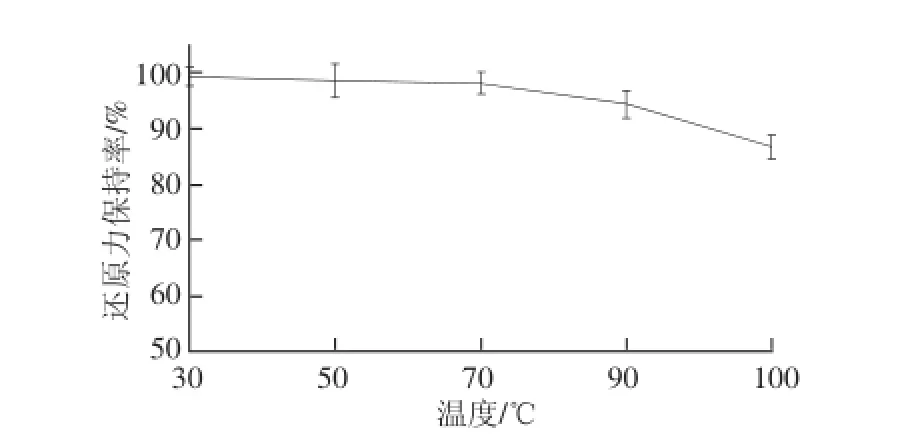
图2 温度对酶解产物还原力的影响Fig.2 Effect of temperature on reducing power
由图1、2可知,在30~100℃温度范围内对酶解产物进行热处理,样品的抗氧化能力变化不大,其DPPH自由基清除能力及还原力在100℃时仍具有较高保持率,说明本样品具有较好的耐热性。但是,由于加热处理可以一定程度上改变抗氧化肽的空间结构[22],反应过程中暴露的氨基酸基团有所差异,从而导致与DPPH自由基的接触及供电子能力都可能发生变化,因此样品在加热过程中抗氧化能力所发生的一定变化可能与样品的空间构象有关。
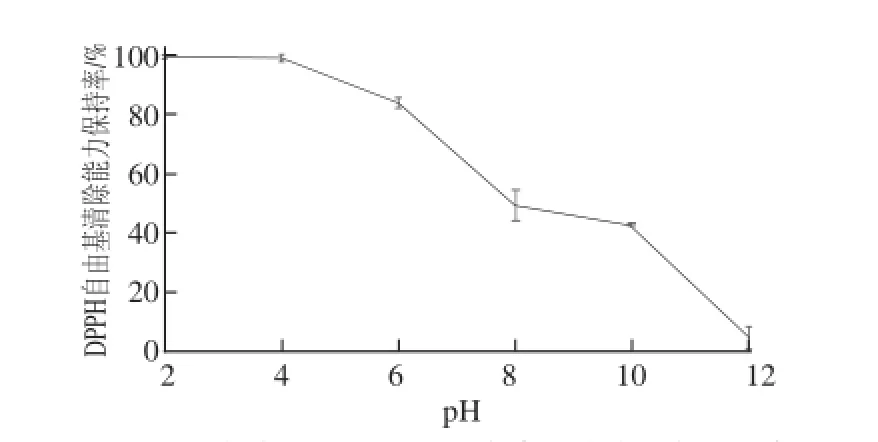
图3 pH值对酶解产物DPPH自由基清除能力的影响Fig.3 Effect of pH on DPPH radical scavenging capacity
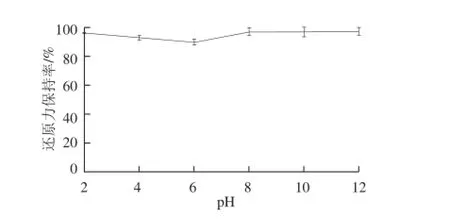
图4 pH值对酶解产物还原力的影响Fig.4 Effect of pH on reducing power
2.1.2 pH值对酶解产物抗氧化稳定性的影响
由图3可知,酶解产物的DPPH自由基清除能力保持率在酸性环境中较强,而在碱性环境中很快丧失,原因可能是碱性环境较多消耗了多肽中具有清除自由基效果的氢供体,使自由基清除能力明显减弱。而且pH值能够影响抗氧化肽的空间构象,酸性环境中抗氧化肽的极性氨基酸暴露出来,阻碍了疏水氨基酸的反应,碱性环境中则相反[23]。本实验结果与赵谋明等[24]对蓝园鲹抗氧化肽抗氧化稳定性的研究相似,产物均证实在酸性环境中具有较高稳定性。由图4可知,酶解产物的还原能力在碱性环境中并无明显变化,原因可能是还原力反映的是抗氧化剂供电子能力的大小,通过给出自身电子清除自由基的能力强弱来判断样品抗氧化性的强弱,而元素得失电子能力和氧化还原能力有关,与酸碱性关系不大。综上所述,此酶解产物在酸性环境中能够保持较强抗氧化活性。
2.1.3食品辅料对酶解产物抗氧化稳定性的影响
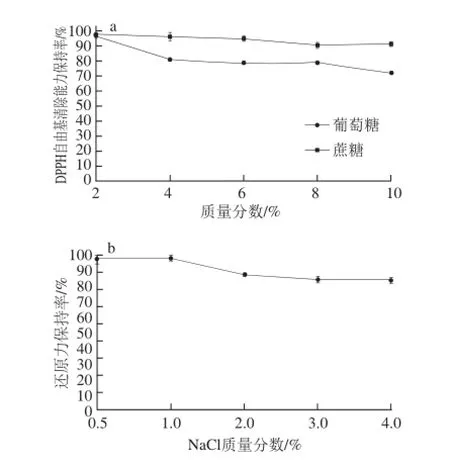
图5 食品辅料对酶解产物DPPH自由基清除能力的影响Fig.5 Effect of food auxiliary materials on DPPH radical scavenging capacity
由图5可知,在实验选取的质量分数范围内,对酶解产物DPPH自由基清除能力的影响大小为:葡萄糖>NaCl>蔗糖。随着NaCl、蔗糖质量分数升高,DPPH自由基清除能力保持率无明显变化,而随着葡萄糖质量分数的升高有一定程度降低。
由图6可知,产物的还原力受蔗糖质量分数影响很小,但随葡萄糖和NaCl质量分数升高而略有下降。综合分析得知,高质量分数的葡萄糖溶液环境可以在一定程度上降低样品的抗氧化活性,而蔗糖对样品活性的影响效果极小,NaCl的添加对样品活性无明显影响,本实验结果与赵谋明[24]、游丽君[25]等的研究结果相似。因此,在样品加工过程中应尽量避免高质量分数葡萄糖的添加,或者可以在处理中用蔗糖代替葡萄糖。
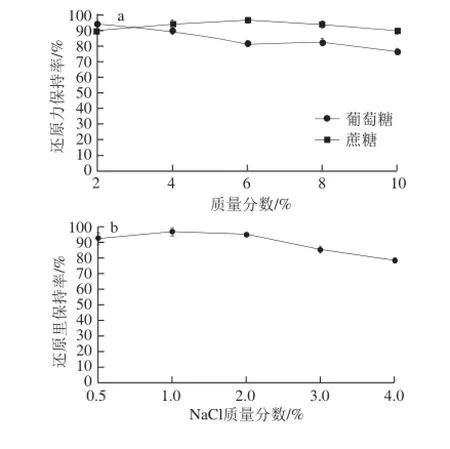
图6 食品辅料对酶解产物还原力的影响Fig.6 Effect of food auxiliary materials on reducing power
2.1.4防腐剂对酶解产物抗氧化稳定性的影响
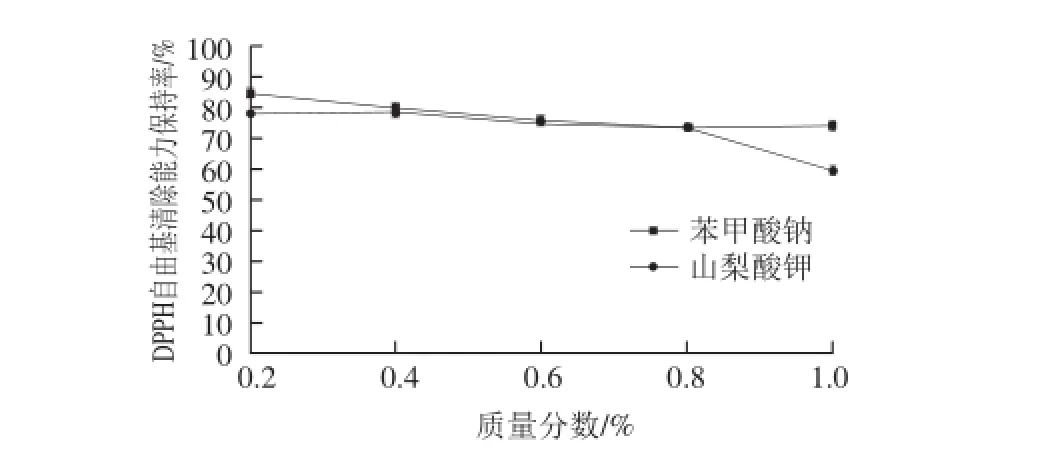
图7 防腐剂对酶解产物DPPH自由基清除能力的影响Fig.7 Effect of preservatives on DPPH radical scavenging capacity
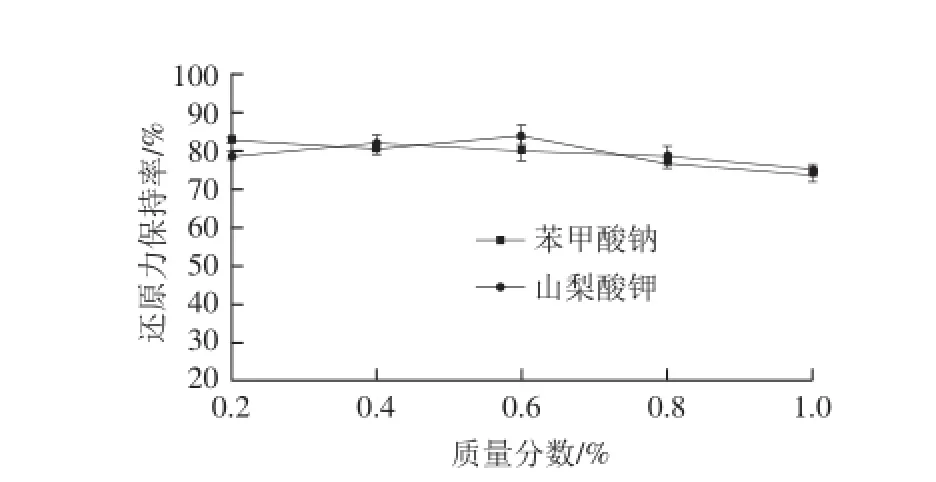
图8 防腐剂对酶解产物还原力的影响Fig.8 Effect of preservatives on reducing power
由图7、8可知,当样品中加入0.2%的苯甲酸钠或山梨酸钾后,抗氧化活性降低到原来的80%左右,且随着防腐剂质量分数的提高活性依旧呈缓慢下降趋势。但相比较而言,山梨酸钾的影响略强于苯甲酸钠,且对于DPPH自由基清除能力的影响强于对还原力的影响。分析可看出,防腐剂的添加能够在一定程度上影响样品的抗氧化活性,且随着防腐剂添加量的提高,影响逐渐增强。
2.1.5金属离子对酶解产物抗氧化稳定性的影响
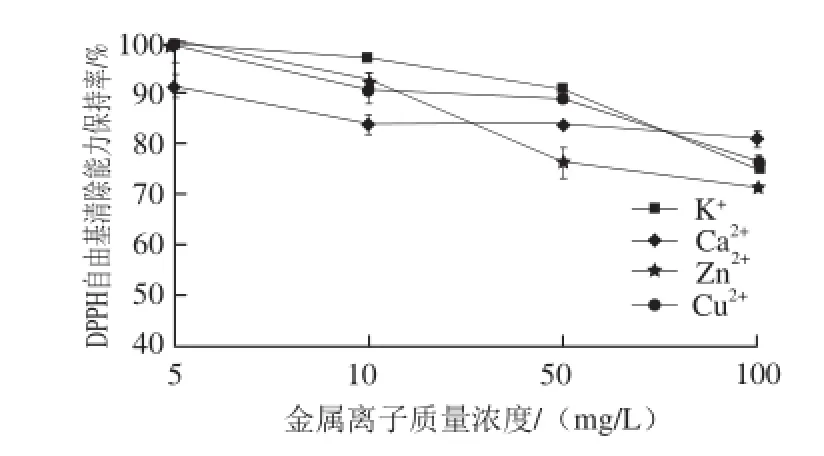
图9 金属离子对酶解产物DPPH自由基清除能力的影响Fig.9 Effect of metal ions on DPPH radical scavenging capacity
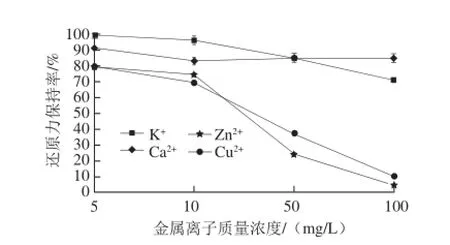
图10 金属离子对酶解产物还原力的影响Fig.10 Effect of metal ions on reducing power
在实验质量浓度范围内,不同金属离子对酶解产物的抗氧化活性影响不同。由图9可知,各金属离子对酶解产物清除DPPH自由基能力的影响大小依次为:Zn2+>Cu2+>K+>Ca2+。尤其在离子质量浓度升至50 mg/L后,Zn2+对DPPH自由基清除能力保持率影响显著,清除能力保持率降低至原来的76%;在Cu2+与K+质量浓度增加到100 mg/L后,酶解产物DPPH自由基清除能力保持率也减弱至原有活性的75%左右;对比而言,酶解产物中添加Ca2+后,抗氧化活性保持相对稳定,对DPPH自由基清除能力保持率始终在80%以上。由图10可知,各金属离子对酶解产物还原力大小的影响顺序也为:Zn2+>Cu2+>K+>Ca2+。在质量浓度高于10 mg/L后,Zn2+与Cu2+对样品抗氧化活性影响巨大,还原力迅速减弱,当继续添加至100 mg/L时,还原力保持率只维持原有的4.5%和10%,活性几乎完全丧失;随着K+添加质量浓度的升高,样品还原力保持率也有一定程度下降;而Ca2+的添加对样品活性并未产生明显影响,虽略有下降,但整体趋势保持稳定,Ca2+质量浓度达到100 mg/L时,产物还原力保持率仍在84%以上。综合分析来看,酶解产物对Zn2+及Cu2+较为敏感,对K+的敏感程度远远低于以上两者,而在Ca2+环境中保持相对稳定。
2.2酶解产物体外模拟胃肠道消化系统稳定性分析
由于大多数食物中的蛋白质会在人体消化系统中分解为小肽及氨基酸,以被人体消化道吸收丧失活性,因此有的活性多肽在人类食用后无法发挥其应有的生理作用。而通过实验模拟胃肠道环境,监测消化过程中酶解产物的抗氧化活性变化,通过活性保持情况可以帮助分析该种抗氧化产品可否应用于食品加工。
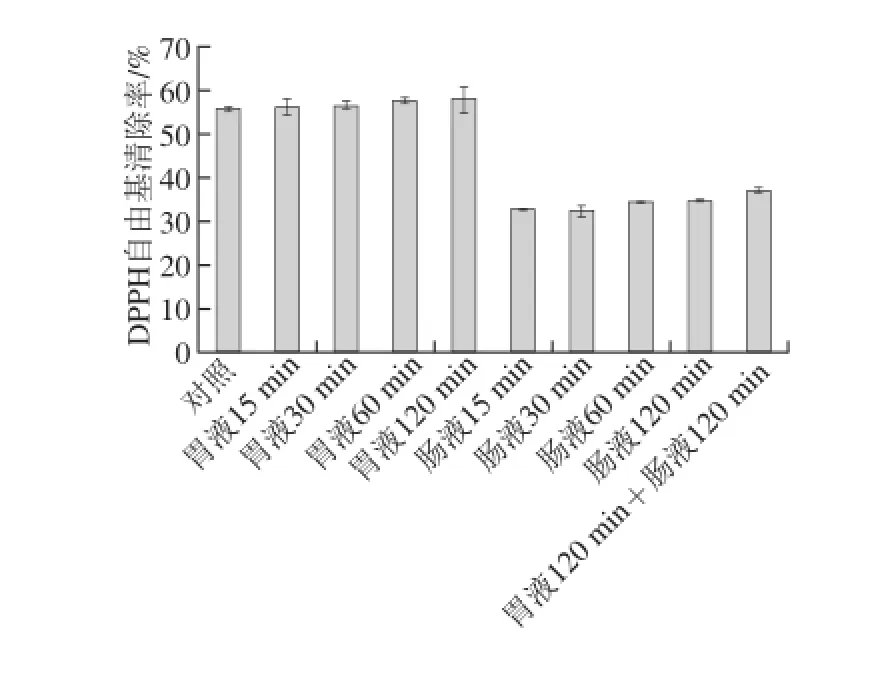
图11 酶解产物体外模拟消化环境DPPH自由基清除率变化Fig.11 Changes in DPPH radical scavenging rate in simulated digestion environmentin vitro
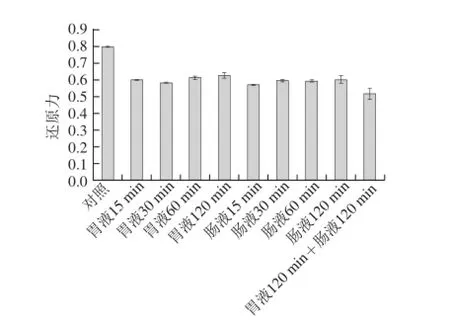
图12 酶解产物体外模拟消化环境还原力变化Fig.12 Changes in reducing power in simulated digestion environmentin vitro
由图11可知,裂壶藻渣酶解产物的DPPH自由基清除能力在胃液环境中基本无变化,而在肠液中活性有所降低,但随时间变化不显著。先后用胃液及肠液分别处理酶解产物,DPPH自由基清除率由原始的55%降至37%,由此可见酶解产物的DPPH自由基清除能力受肠液环境的影响较大。由图12可知,裂壶藻渣酶解产物在人工胃液、人工肠液中还原力均有所降低,但同样随时间延长变化不大。胃肠液处理后,酶解产物的还原力由0.795降低到0.517,活性保持了原来的一半以上。总体来看,裂壶藻酶解产物在人工模拟胃肠环境中表现出一定的活性保持率,肠液对其的影响效果大于胃液,但不论经胃液、肠液单独处理,还是先后共同处理,其DPPH自由基清除率和还原力均能保持在原有的65%以上,且受时间的影响不明显,由此可见本实验的酶解产物样品对人工胃肠液具有一定的惰性。
但是,人体实际的消化系统会比模拟环境更加复杂,人工胃肠环境实验仅能为实际情况提供参考。考虑到人体中复杂的缓冲液环境及酶促反应过程,还应配合进一步的动物实验或分析模型才能得出确定性结果。
3 结 论
本实验以裂壶藻渣为原料,期望通过一定酶解工艺制备具有抗氧化活性的多肽,先后研究了温度、pH值、食品辅料、防腐剂、金属离子对其抗氧化活性的影响及其在人工模拟胃肠道环境中抗氧化活性的变化情况。结果发现:样品具有较好的耐热性,温度对其抗氧化活性的影响很小;酸性环境中酶解产物具有较高的活性保持率,而碱性环境中酶解产物DPPH自由基清除能力迅速降低直至丧失;食品辅料中,葡萄糖对酶解产物抗氧化活性影响相对显著,而蔗糖和NaCl对酶解产物稳定性影响较小;山梨酸钾、苯甲酸钠的添加可一定程度降低酶解产物的抗氧化活性,且山梨酸钾的影响略强于苯甲酸钠;金属离子中,Zn2+与Cu2+对样品抗氧化活性影响很大,K+的影响较小,酶解产物在Ca2+环境中可以保持相对稳定;在体外模拟胃肠实验中,酶解产物经胃肠液处理后表现出一定的抗氧化活性保持率,单独处理中肠液影响大于胃液,但均能使其抗氧化活性保持在原来的65%以上。综合以上分析来看,裂壶藻渣酶解产物具备较好的抗氧化活性及稳定性,具有一定生产应用价值。
[1] SHEIH I C, WU T, FANG T J. Antioxidant properties of a new antioxidative peptide from algae protein waste hydrolysate in different oxidation systems[J]. Bioresource Technology, 2009, 100(13): 3419-3425.
[2] TONG L M, SASAKI S, MCCLEMENTS D J, et al. Mechanisms of the antioxidant activity of a high molecular weight fraction of whey[J]. Journal of Agricultural and Food Chemistry, 2000, 48(5): 1473-1478.
[3] GUO Hang, KOUZUMA Y, YONEKURA M. Isolation and properties of antioxidative peptides from water-soluble royal jelly protein hydrolysate[J]. Food Science and Technology Research, 2005, 11(2): 222-230.
[4] SUN Hongmei. Evaluation of antioxidant activity of polysaccharidesisolated fromCamellia sinensis(tea) in exhausting training mice[J]. Journal of Medicinal Plants Research, 2011, 5(5): 791-795.
[5]马赛蕊,胡晓,吴燕燕,等.罗非鱼肉蛋白酶解液的抗氧化活性[J].食品科学, 2012, 33(19): 52-56.
[6]任娇艳,赵谋明,崔春,等.草鱼蛋白源抗氧化肽的分离及鉴定[J].食品科学, 2009, 30(13): 13-17.
[7]吴燕燕,田倩,尚军,等.合浦珠母贝抗氧化肽的性质及应用研究[J].食品工业科技, 2011, 32(11): 123-126.
[8]王晶,吴燕燕,李来好,等.合浦珠母贝肉酶解产物的抗氧化稳定性与功能特性[J].食品工业科技, 2014, 35(13): 67-71.
[9]谢宁宁,陈小娥,方旭波,等.水产抗氧化肽研究进展[J].浙江海洋学院学报:自然科学版, 2010, 29(1): 74-80.
[10]田倩,吴燕燕,李来好,等.合浦珠母贝肉酶解液中抗氧化肽的分离及活性研究[J].食品科学, 2011, 32(增刊1): 144-148.
[11]王晶,吴燕燕,李来好,等.响应面法优化微波辅助酶解合浦珠母贝蛋白工艺[J].食品科学, 2014, 35(10): 11-17. doi: 10.7506/spkx1002-6630-201410003.
[12]周力,王松松,孙源,等.酸前处理微藻制备生物柴油工艺研究[J].中国油脂, 2013, 38(11): 61-63.
[13]肖艳,牛荣丽.海水小球藻中脂类物质的成分分析及其抗菌活性研究[J].食品工业科技, 2013, 34(1): 60-62.
[14]李凡,曹煜成,胡晓娟,等.微囊藻和小球藻携带WSSV量的变化及对水体游离WSSV的影响[J].南方水产科学, 2014, 10(2): 54-60.
[15]何震寰,黄翔鹄,李长玲,等.沼泽红假单胞菌对波吉卵囊藻常温保存效果的影响[J].南方水产科学, 2013, 9(4): 50-55.
[16]王丽花,曹煜成,李卓佳.溶藻细菌控藻作用及其在对虾养殖池塘中的应用前景[J].南方水产科学, 2012, 8(4): 76-82.
[17]彭聪聪,李卓佳,曹煜成,等.虾池浮游微藻与养殖水环境调控的研究概况[J].南方水产, 2010, 6(5): 74-80.
[18]王少沛,曹煜成,李卓佳,等.水生环境中细菌与微藻的相互关系及其实际应用[J].南方水产, 2008, 4(1): 76-80.
[19] BAE S H, SUH H J. Antioxidant activities of five different mulberry cultivars in Korea[J]. LWT-Food Science and Technology, 2007, 40(6): 955-962.
[20] AHMADI F, KADIVAR M, SHAHEDI M. Antioxidant activity ofKelussia odoratissimaMozaff in model and food systems[J]. Food Chemistry, 2007, 105(1): 57-64.
[21]国家药典委员会.中华人民共和国药典(2005年版,二部)[M].北京:化学工业出版社.
[22] CHEN Huaming, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from soybeanβ-conglycinin[J]. Journal of Agricultural and Food Chemistry, 1995, 43(3): 574-578.
[23]于丽娜,高俊安,杨庆利,等.不同处理条件对花生抗氧化肽抗氧化活性的影响[J].食品科学, 2012, 33(11): 104-110.
[24]赵谋明,何婷,赵强忠,等.蓝园鲹抗氧化肽抗氧化稳定性研究[J].食品科学, 2009, 30(1): 128-130.
[25]游丽君,赵谋明, REGENSTEIN J,等.加工和贮藏条件对泥鳅多肽抗氧化活性的影响[J].江苏大学学报:自然科学版, 2009, 30(6): 549-553.
Antioxidant Stability of Enzymatic Hydrolysates from Schizochytrium limacinum Meal
HU Xiao1, WU Qiong1,2, YANG Xianqing1,*, LI Laihao1, WU Yanyan1, LIN Wanling1, QI Bo1
(1. Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, National R&D Center for Aquatic Product Processing, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 2. College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
The DPPH free radical scavenging activity and reducing power of enzymatic hydrolysates from Schizochytrium limacinum meal was selected as the indexes to investigate the effects of temperature, pH, food auxiliary materials, preservatives, metal ions and digestion environment in vitro on the antioxidant stability. The results showed that the enzymatic hydrolysates from Schizochytrium limacinum meal had strong heat-resistance ability from 30 ℃ to 100 ℃ and the activity was maintained well in an acidic environment; some food additives such as sucrose and NaCl had little effects on the antioxidant stability while glucose exerted an increasing effect at increasing concentrations from 2% to 10%. The effect of potassium sorbate on the activity of hydrolysis products was slightly stronger than that of sodium benzoate. The effect of different metal ions followed the decreasing order of Zn2+> Cu2+> K+> Ca2+. Up to 65% of the activity could be retained after simulated gastrointestinal environment treatment in vitro.
Schizochytrium limacinum; antioxidation; enzymatic hydrolysates; stability
TS254.9
A
1002-6630(2015)11-0021-06
10.7506/spkx1002-6630-201511005
2014-11-16
国家现代农业(罗非鱼)产业技术体系建设专项(CARS-49);“十二五”国家科技支撑计划项目(2012BAD28B06);
广东省海洋渔业科技与产业发展专项(微藻功能性蛋白肽的研究与产品开发);
广东省科技计划项目(2013B021100013);国家自然科学基金青年科学基金项目(21205138;31301454)
胡晓(1981—),男,副研究员,博士,研究方向为食品生物技术、水产品加工与质量安全。E-mail:hnhuxiao@163.com
*通信作者:杨贤庆(1963—),男,研究员,本科,研究方向为水产品加工及贮藏工程。E-mail:yxqgd@163.com
