降胆固醇乳酸菌的筛选及其对小白鼠的不良影响
2014-12-25张开屏田建军
张开屏, 田建军
(1.内蒙古商贸职业学院 食品工程系,内蒙古 呼和浩特010070;2.内蒙古农业大学 食品科学与工程学院,内蒙古 呼和浩特 010018)
乳酸菌是人体肠道中重要的益生菌,对维持宿主的微生态平衡和提高免疫功能起着极其重要的作用[1-3]。国外大量研究证实[4-7],不同种类的乳酸菌具有降低胆固醇的效果。服用乳酸菌及其相关制品,可降低心血管病的发病率。因此从传统发酵制品中筛选出安全高效的降胆固醇乳酸菌,可为今后益生菌制剂和功能性乳制品开发提供优良菌种。
作者以分离自内蒙古传统发酵乳制品中14株乳酸杆菌为研究对象,从中筛选出具有降胆固醇能力较高的乳酸菌,并进行了乳酸菌种的鉴定和灌胃小白鼠的不良影响试验。
1 材料与方法
1.1 实验材料
分离自内蒙古传统发酵乳制品中乳酸菌14株。TPY培养基、MRS培养基、MRS-CHOL培养基:参照文献[12]进行配制;胆固醇、邻苯二甲醛,巯基乙酸钠、正己烷、冰醋酸:均为分析纯;16S rDNA基因序列分析材料:参照文献[14]进行配制;清洁级纯系昆明种小鼠:体重(20±2)g,雌雄各半,由内蒙古大学实验动物研究中心提供,许可证号:SCXK(蒙2002-0001)。
1.2 实验方法
1.2.1 供试菌液的调制 参照文献[11],对试验菌株进行纯化和革兰氏染色镜检,MRS液体培养基37℃、24 h活化2代,按1%接种体积分数接种MRS三角瓶液体培养(约 120 mL、37 ℃、24 h)然后无菌分装于三支离心管中(约40 mL),按3 000 r/min离心10 min,弃上清液加灭菌生理盐水约30 mL洗涤3次,按3 000 r/min离心10 min,弃上清液,获得菌体细胞,再加20~30 mL灭菌生理盐水,分光光度计调供试菌液活菌数约为3×109CFU/mL。
1.2.2 胆固醇的测定
1)标准曲线的绘制:分析天平精确称量分析纯胆固醇 50.00 mg,参照文献[9,14],用无水乙醇定容于50 mL的容量瓶中,配成质量浓度为1.0 g/L的胆固醇标液。 精确吸取 0.50、1.00、1.50、2.00、2.50 mL的胆固醇标准液于50 mL容量瓶中,无水乙醇定容, 得到 10.0,20.0,30.0,40.0,50.0 mg/L 的梯度溶液。分别取梯度溶液1.0 mL置于20 mL试管中,在通风厨中抽干,然后加入2.0 mL邻苯二甲醛溶液,磁力搅拌器振荡使其充分溶解,10 min后加入1.0 mL的浓H2SO4磁力搅拌器振荡混合均匀,室温条件下放置10 min使其显色,波长550 nm条件下测其OD值,分光光度计用2.0 mL邻苯二甲醛溶液加入1.0 mL的浓H2SO4,混合均匀,室温放置10 min调零。以胆固醇质量百分比浓度为纵坐标,550 nm条件下测的OD值为横坐标,绘制标准曲线,见图1。

图1 胆固醇质量浓度标准曲线Fig.1 Standard curve of cholesterol concentration
2)样品处理及测定:参照文献[12],按1%的接种体积分数将供试菌液在MRS-CHOL培养基中37℃厌氧培养24 h后,3 000 r/min离心10 min,取上清液为待测样品,参照文献[9-10,14],取待测试验样品0.5 mL,加无水乙醇3.0 mL和50%KOH 2.0 mL振荡器混合均匀,60℃水浴恒温10 min,冷却后加正己烷5.0 mL,混合均匀,加双蒸水3.0 mL后再充分混合,室温静置15 min使溶液分层,取正己烷层溶液2.0 mL抽干,加入邻苯二甲醛溶液2.0 mL,室温静置10 min,加入1.0 mL浓H2SO4,混合均匀,放置10 min后,550 nm条件下测OD值。根据标准曲线方程计算样品中胆固醇的质量浓度,进而计算胆固醇降解率R及其单位菌株对胆固醇的去除效力E。

式中:S对照为对照样上清液中胆固醇质量浓度(μg/mL);S接种为发酵上清液中胆固醇质量浓度(μg/mL);N 为乳酸菌数的对数值 lg(CFU/g)。
1.2.3 乳酸菌的生理生化试验 对筛选到的菌株进行革兰氏染色,在生物显微镜下观察菌体形态,通过氧化氢酶试验、运动性及产酸、产气、糖发酵等生理生化试验进行鉴定[15]。
参照文献[11、13、16],采用通用的 16S rDNA 引物进行PCR扩增,得到约1 500 bp的特异性扩增产物,电泳检测扩增产物后,送至上海生工生物工程技术服务有限公司进行测序,进而对乳酸菌进行种的鉴定。
1.2.4 菌株N59-1的致病性试验
1)试验小鼠分组及给药:将40只试验小白鼠随机分为两组,雄雌各半,每组20只,其中一组用于空白对照。以约3×109CFU/mL菌液分别灌胃雌雄小鼠,每次每只小鼠灌胃1.0 mL,在24 h内灌胃2次,间隔8 h,取另一管用灭菌脱脂乳制备成相同浓度的菌悬液,空白对照组小鼠每次每只小鼠灌胃1.0 mL脱脂乳培养基,灌胃时间与试验组相同,连续观察30 d,记录观察期间小鼠表现和死亡情况。
2)小鼠死亡记录及组织切片的制作:参照文献[17],对死亡的小鼠进一步做脏器有无病理变化试验和主要器官心、肝、肾、脾、贲门的组织切片观察。若小鼠没有死亡,试验结束时,则从每组中各取一只小鼠,对小白鼠进行摘眼球取血,制备血片,将取血后的小白鼠脱臼致死,进行组织切片观察。
3)脏器系数的测定[18]:取血完毕脱臼处死小鼠,并小心分离出肝、肾,并立即于分析天平上称量质量,计算脏器系数。

2 结果与分析
2.1 降胆固醇乳酸菌的筛选
按1%的接种体积分数,将供试菌液接种于MRS-CHOL培养基中,与对照样一起在厌氧条件下,37℃培养24 h,分别测定其pH值、培养基中胆固醇的质量浓度,并分别计算单位菌株对胆固醇的去除效力E和胆固醇降解率R,结果见图2~3。图中带有相同子母,表示样品之间差异不显著(P>0.05),不同子母表示样品之间差异显著(P<0.05)。
由图2可以看出 ,14株全部试验菌株对介质中胆固醇都有脱除作用,除12和13号菌株外,其它12株菌株与对照样相比差异显著(P<0.05)。试验菌株对胆固醇的脱除力平均值为6.63 μg/lg(CFU/g),脱除力高于平均6.63 μg/lg(CFU/g)的菌株有7株,代号分别为 2、4、5、6、7、9、11,其中 11 号菌株 N59-1 对胆固醇的脱除力为 14.85 μg/lg(CFU/g),脱除力最高,代号15的菌株对胆固醇的脱除力与平均值相等,脱除力低于平均值 6.63 μg/lg(CFU/g)的菌株有 6 株,代号分别为 3、8、10、12、13、14。 菌株间对胆固醇脱除力的差异显著性,如图2中子母所示,含有不同子母,表示差异显著(P<0.05)。
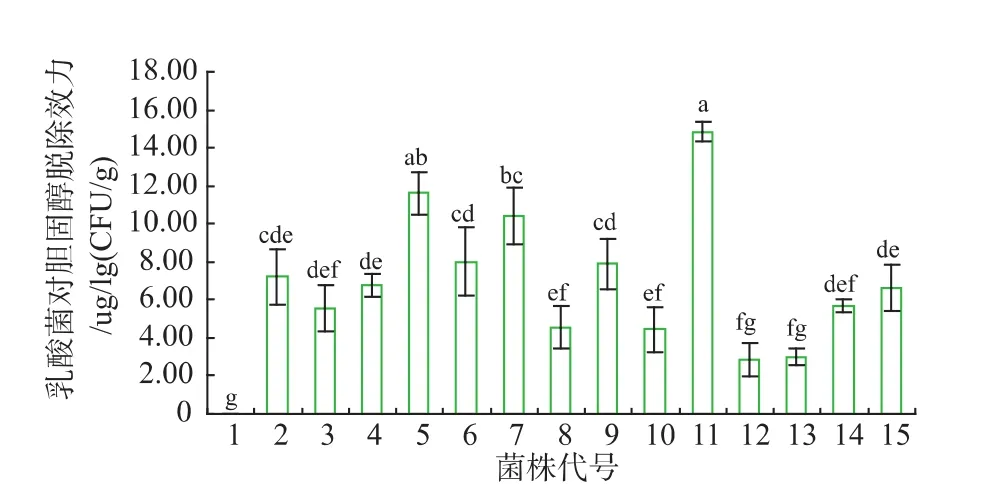
图2 乳酸菌对胆固醇的脱除效力Fig.2 Cholesterol removal effectiveness of lactobacillus from media
由图3可以看出,14株全部试验菌株对介质中胆固醇都有一定的降解作用,除12和13号菌株外,其它12株菌株与对照样1相比差异显著 (P<0.05)。试验菌株对胆固醇的降解率平均值为15.48%,降解率高于平均值15.48%的菌株有7株,代 号 分 别 为 4、5、6、7、9、11、15, 其 中 11 号 菌 株N59-1对胆固醇的降解率为42.97%,降解率最高,降解率低于平均值15.48%的菌株有7株,代号分别为 2、3、8、10、12、13、14。 菌株间对胆固醇降解率的差异显著性,如图3中子母所示,含有不同子母,表示差异显著(P<0.05)。
结合图2和图3可以看出,菌株对胆固醇的脱除力和菌株对胆固醇的降解率有高度的相关性,降解率高的菌株,脱除力也高,代号11的菌株N59-1,对胆固醇的去除率R高达42.97%,同时单位菌株对胆固醇的去除效力E为14.85,与其它菌株相比差异显著(P<0.05),故N59-1可作为比较理想的筛选菌株。
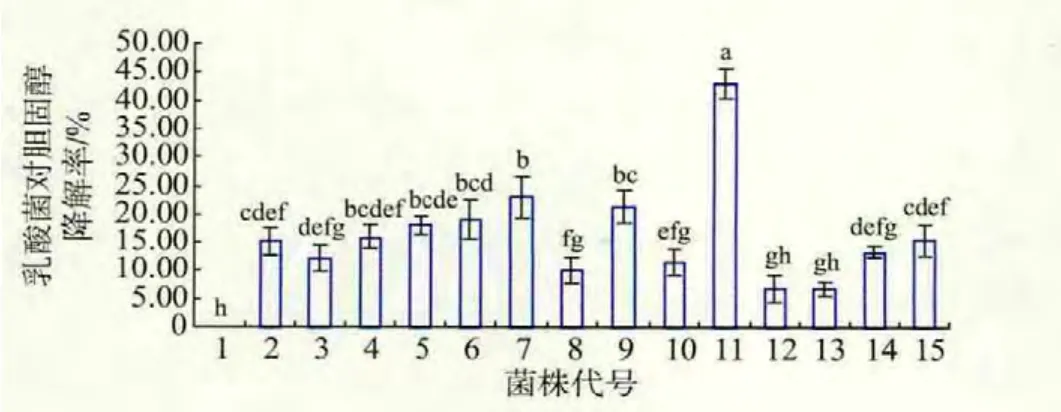
图3 乳酸菌对胆固醇的降解率Fig.3 Cholesterol removal rate of lactobacillus from media
2.2 乳酸菌的生理生化鉴定
2.2.1 乳杆菌属的鉴定 采用嗜酸乳杆菌ATCC4356、保加利亚乳杆菌JCM1002和瑞士乳杆菌ATCC12278三株标准菌株作为对照菌株进行乳杆菌属的鉴定。经形态学和生理生化试验对筛选的11号菌株N59-1进行了鉴定,N59-1发酵葡萄糖但不产生气体,属同型乳酸发酵,细胞壁中不含有二氨基庚二酸,产生DL-乳酸,脱脂乳中产酸量为1.3%,试验结果见表1。根据表1及文献[13],可将试验菌株鉴定为乳酸菌的乳杆菌属。
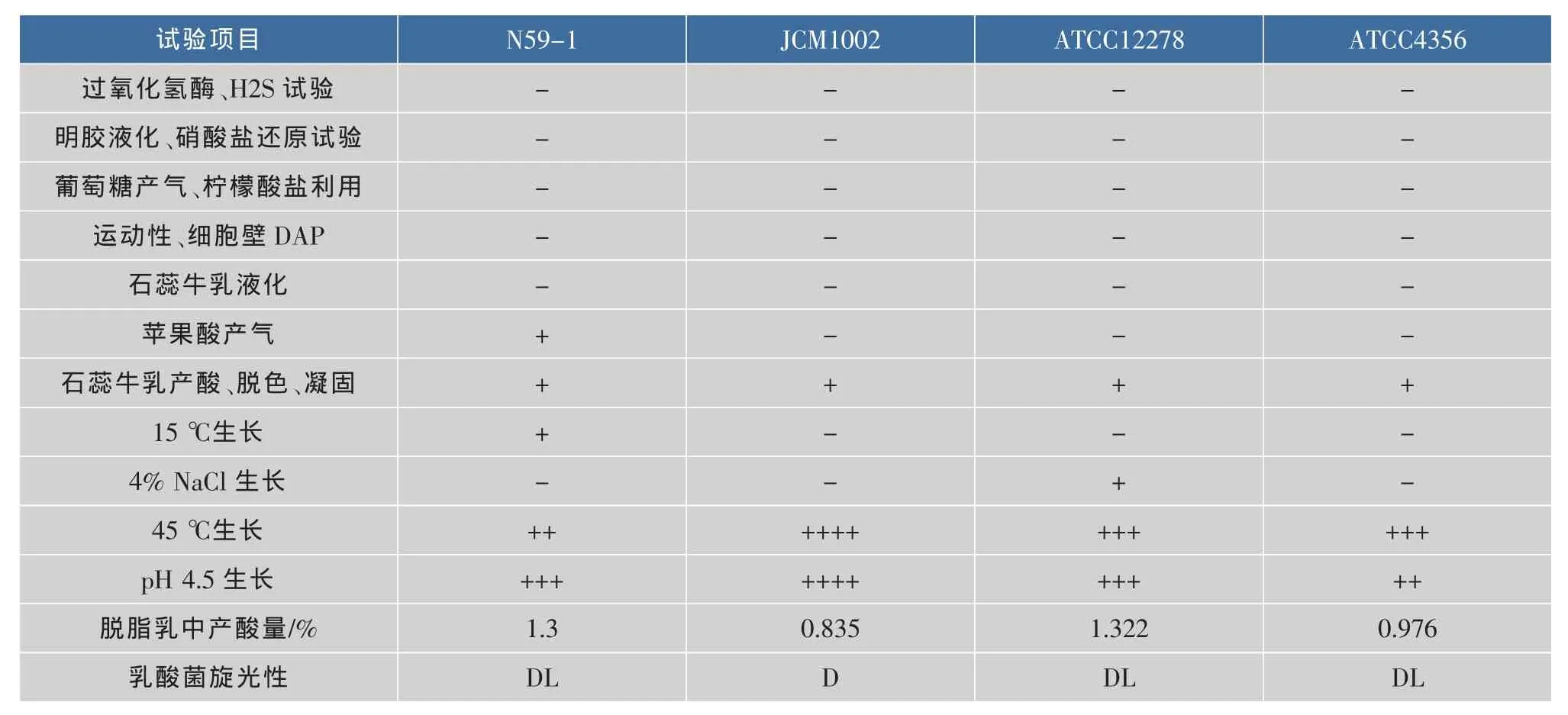
表1 乳杆菌的生理生化试验鉴定结果Table 1 Consequence on identification Lactobacillus physiological and biochemical experiment
2.2.2 乳杆菌种的鉴定 糖发酵试验结果见表2。由表2可以看出,N59-1均分解木糖、核糖、蔗糖、果糖、淀粉、乳糖、半乳糖、葡萄糖、甘露糖、半乳糖、麦芽糖、纤维二糖等产酸,不利用肌醇、菊粉、七叶苷、扁桃苷、松三糖、纤维二糖。根据表2,参照文献[4]可将N59-1归为植物乳杆菌。
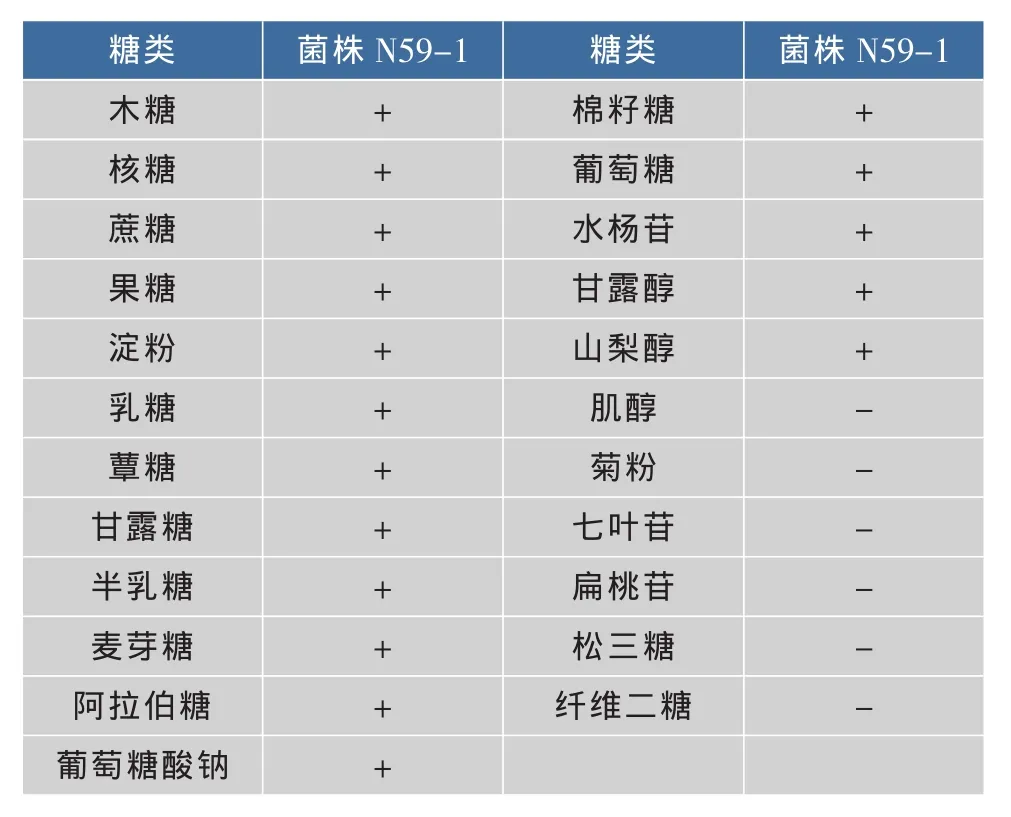
表2 糖发酵试验Table 2 Capacity of strains to make use of carbon source
用0.8 g/dL的琼脂糖凝胶对试验菌株N59-1的16S rDNA扩增产物做电泳检测,经核酸染料染色后,在1 500 bp处出现荧光条带,与预期一致,然后用回收的产物直接进行16S rDNA序列测定。由菌株N59-1的16S rDNA序列与GenBank数据库中已知的乳杆菌属内标准菌株的16S rRNA/rDNA基因序列同源性百分比对比可知,菌株N59-1的16S rDNA序列与其它乳杆菌的16S rRNA/rDNA序列相似性均大于84%,是乳杆菌属的菌株。而且菌株N59-1与L.plantarum的标准菌株的同源性为99.7%,可以认为该菌株是一株Lb.plantarum。
2.3 菌株N59-1的致病性试验
2.3.1 菌株N59-1对小鼠急性毒性试验结果 以3×109CFU/mL浓度菌液分别灌胃雌雄小鼠,每次每只小鼠灌胃1.0 mL,在24 h内灌胃2次,间隔8 h,观察7 d,结果发现全部小鼠在整个试验过程中精神状态、毛皮、肤色、饮水、进食量、尿色和粪便与对照组小鼠的情况相同,均未发生任何不良反应和死亡情况,表明试验菌株没有引起小鼠的不良反应。
2.3.2 菌株N59-1对小鼠血液的影响 试验观察期30 d时,将每只小白鼠进行摘眼球取血,制备血片。血片结果显示,灌胃试验菌株的小白鼠与对照组的血片相似,细胞分布均匀,形态正常,无异常细胞,白细胞数量正常,没有血小板和红细胞聚集。
2.3.3 菌株N59-1对小鼠重要器官组织形态学的影响 试验观察期30 d时,试验组小鼠肺脏、脾脏、肾脏、心脏与对照组相似。肝脏组织结构正常,肝小叶结构清楚;肺脏结构形态正常,未见明显的病理学改变;脾脏结构形态正常,红髓、白髓清楚可见,无增生,未见异常改变;肾脏皮质、髓质、肾小球结构正常,肾小管上皮细胞无浊肿或脂肪变性;心脏部位心室、心房、心肌纤维结构清楚,横纹清晰可见,为正常结构,未见炎性细胞侵入,间质未见异常。
2.3.4 菌株N59-1对小鼠脏器系数的影响 给食含N59-1菌液30 d称重后,处死小鼠解剖检查心、肝、脾、肺、肾、脑、胃、肠等全身各脏器,肉眼观察未发现明显异常。取心、肝、肺、肾、脾等靶脏器,用滤纸吸去血液称重,求脏器系数,结果见表3。
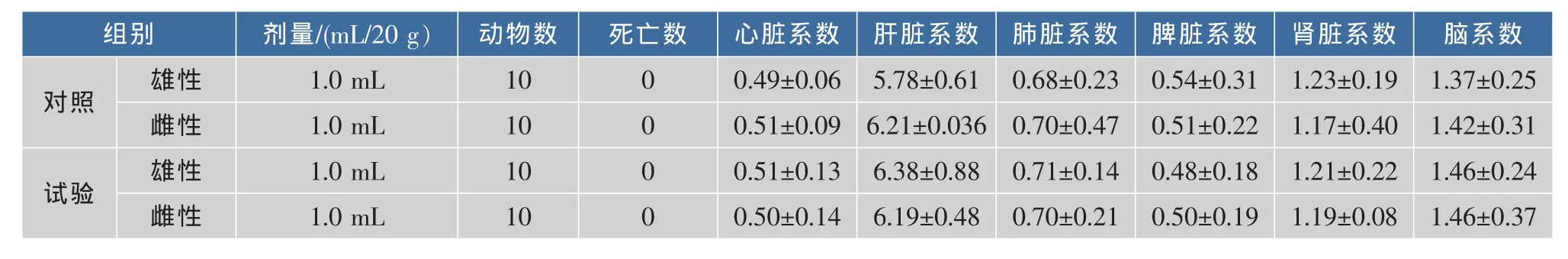
表3 菌株N59-1对小鼠脏器系数的影响(X±S,n=10)Table 3 Effect of strain N59-1 on organ coefficient in mice(X±S,n=10)
由表3可知,小鼠心脏系数、肝脏系数、肺脏系数、脾脏系数、肾脏系数、脑系数、卵巢或睾丸系数试验组与对照组无显著变化(P>0.05),可见含N59-1菌液对小鼠无不良影响。
3 结语
1)14株全部试验菌株对MRS-CHOL培养基中胆固醇都有一定的脱除作用,脱除率R在6.84%~42.97%之间,R的平均值为16.59%,其中12株菌株与对照样相比差异显著(P<0.05),菌株N59-1对胆固醇的脱除率最高,数值为42.97%(P<0.05)。
2)菌株N59-1与标准菌株L.plantarum的同源性约为99.7%,菌株N59-1可判定为L.plantarum。
3)在30 d的灌胃期内,菌株N59-1在行为、血液和重要器官组织形态学、脏器系数方面,试验组与对照组无显著差异(P>0.05),可见含N59-1菌液对小鼠无不良影响。
[1]ZHANG Fang,HANG Xiaomin,FAN Xiaobing,et al.Selection and optimization procedure of synbiotic for cholesterol removal[J].Anaerobe,2007,13:185-192.
[2]Papamanoli,Tzanetakis E,Litopoulou-Tzanetaki N,et al.Characterization of lactic acid bacteria isolated from a Greek dryfermented sausage in respect of their technological and probiotic properties[J].Meat Science,2003,65(2):859-867.
[3]ZHAO Liping,SHEN Jian.Whole-body systems approaches for gut microbiota-targeted,preventive health care[J].Journal of Biotechnology,2010,149(3):183-190.
[4]Lin S Y,Ayres J W,Winkler W,et al.Lactobacillus effects on cholesterol:in vitro and in vivo results[J].Journal of Dairy Science,1989,72(11):2885-2889.
[5]KEYS ,ANCEL.Serum cholesterol response to dietary cholesterol[J].American Journal of Clinical Nutrition,1986,44(2):309.
[6]Liong M T,Shan N P.Effects of a Lactobacillus casei synbiotic on serum lipoprotein,intestinal microflora and organic acids in rats[J].Journal Dairy of Science,2006,89(5):1390-1399.
[7]JUNGAE J,KIM S,CHO S Y,et al.Hypocholesterolemic effects of Lactobacillus plantarum KCT3928 by increased bile acid excretion in C57BL/6 mice[J].Nutrition,2009,26(3):321-330.
[8]WANG Y,XU N,XI A,et al.Effects of Lactobacillus plantarum MA2 isolated from tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-vholesterol diet[J].Applied Microbiology Biotechnology,2009,84(2):341-347.
[9]GILLAND S E,NELSON C R,MAXWELL C.Assimilation of cholesterol by Lactobacillus acidophilus[J].Appl Environ Microbiol,1985,49:377-381.
[10]Rude L L,Morris D M.Determination of cholesterol using o-phthalaldehyde[J].J Lipid Res,1973,14:364-366.
[11]Kuwahara T,L Norimatsa.Genetic variation in 16S-23S rDNA interal transcribed spacer region and the possible use of this genentic variation for molecular diognosis of Bacteriodes species[J].Microbiol Immunol,2001,45:191-199.
[12]田建军.高效降胆固醇乳酸菌的筛选及其在发酵乳中的应用[D].呼和浩特:内蒙古农业大学,2006.
[13]康白.微生物实验手册[M].大连:大连出版社,1988.
[14]田建军,张开屏,靳烨.高效降胆固醇乳酸菌的筛选[J].食品科技,2011,11:21-25.TIAN Jianjun,ZHANG Kaiping,JIN Ye.Screening of Lactobacillus for efficient cholesterol-degrading[J].Food Science and Technology,2011,11:21-25.(in Chinese)
[15]布坎南 R E,吉布斯 N E.伯杰氏细菌鉴定手册(第8版)[M].中国科学院微生物研究所译.北京:科学出版社,1984.
[16]王俊国.降胆固醇益生乳杆菌的筛选及其降胆固醇作用的研究[D].呼和浩特:内蒙古农业大学,2008.
[17]田欣田,董文德,邱震东.现代动物病理学实验技术[M].北京:中国农业大学出版社,1992.
[18]GB15193.1-2003.国家标准食品安全学毒理学评价程序[S].北京:中国标准出版社,2003.
