酚酞啉在辣根过氧化酶发光检测中的应用*
2014-12-24冯志明蔡俊李旭红李其华曹小妹
冯志明,蔡俊,李旭红,李其华,曹小妹
(1.湖南师范大学化学生物学及中药分析省部共建教育部重点实验室,长沙 410081;2.中南大学湘雅三医院,长沙 410013)
化学发光免疫分析是利用酶催化的化学发光进行定量分析的光化学方法。相比传统的放射免疫分析,化学发光免疫分析不需昂贵的实验设备,无放射性污染,操作简便。与酶联免疫定性比色分析比较,化学发光免疫分析不仅灵敏度高,且能够进行定量分析与检测,应用前景广阔。
辣根过氧化物酶(Horseradish Peroxidase,HRP)是常用的抗体标记酶,因其具有高转换系数、适应性广和相对分子质量小等特点而广泛应用于化学发光免疫分析[1]。鲁米诺(luminol)是HRP催化氧化发光的常用底物。当不使用增强剂时,鲁米诺体系的发光时间短、发光强度小、检测灵敏度低。加入增强剂,可使发光强度提高,发光持续时间延长,提高了信噪比和灵敏度[2]。文献报道的用于HRP酶促化学发光的增强剂虽然比较多,但价廉高效的增强剂仍值得探索[3]。
笔者选取价廉易得的商品酚酞为原料合成酚酞啉,探讨了酚酞啉对HRP–Luminol–H2O2化学发光的增强特性以及用于HRP定量分析的可行性。
1 实验部分
1.1 主要仪器与试剂
酸度计:pHS–25C型,上海精密科学仪器有限公司;
发光光度计:LKB–1250型,瑞典LKB公司;酚酞啉:参照文献[4]合成,略有改进;
鲁米诺和辣根过氧化物酶[RZ(A403/A275)~3.0]:美国Sigma-aldrich公司;
辣根过氧化物酶标记鼠抗人甲胎蛋白单克隆抗体包被IgG(Anti-AFP–HRP):长沙赢润生物技术有限公司;
实验所用其它化学试剂均为分析纯。
1.2 实验方法
将适量的10 mmol/L酚酞、对碘酚或酚酞啉溶液(用pH 8.5 Britton-Robinson 缓冲液配制)、辣根过氧化物酶溶液(用pH 8.5 Britton-Robinson缓冲液稀释至1×10–6g/L)和10 mmol/L鲁米诺溶液(1.77 mg鲁米诺溶于1 mL pH 8.5 Britton-Robinson缓冲液)充分混合后,加入30.0 mmol/L H2O2溶液到测定管中,在发光光度计中测定发光强度。
2 结果与讨论
2.1 增强剂对HRP–Luminol–H2O2酶促发光的增强作用
在HRP–Luminol–H2O2反 应 体 系(1.0×10–7g/L HRP,3 mmol/L H2O2,1.5 mmol/L Luminol,pH 8.5)中,无增强剂时,发光强度低,且持续时间短。加入酚酞、对碘酚和酚酞啉(终浓度均为0.5 mmol/L),均可显著提高反应体系的发光强度。对碘酚和酚酞啉不仅能显著增强HRP酶催化的化学发光强度,而且在30~60 s发光强度达到峰值后衰减慢,持续发光可达20~30 min(见表1)。酚酞也可提高反应体系的发光强度,但体系发光强度达到峰值后衰减较快。结果表明,酚酞啉和对碘酚对HRP–Luminol–H2O2反应体系的发光具有相似显著的增强作用,克服了HRP–Luminol–H2O2反应体系瞬时发光、不易准确测量和发光强度低等缺点[5]。

表1 增强剂对HRP–Luminol–H2O2酶促发光的增强效应
关于HRP–Luminol–H2O2反应体系,一般认为HRP催化过氧化氢产生活性氧自由基,活性氧自由基再激发发光剂鲁米诺形成激发态鲁米诺自由基,鲁米诺自由基再释放光子返回基态[6–8]。实验证明,在HRP–Luminol–H2O2反应体系中加入酚酞啉后,其最大发射波长仍为425 nm处,与文献报道HRP–Luminol–H2O2反应体系发光光谱基本相同。说明酚酞啉没有改变HRP酶促发光反应的历程,可能是酚酞啉更容易形成稳定的自由基,起到能量传递中间体的作用,从而避免活性氧自由基之间的相互灭活,使酶促发光反应温和且持续。
HRP酶促反应的发光强度随时间变化而改变,启动反应后在30 s左右达到峰值,然后缓慢衰减。在实验条件下,选择启动反应后30 s时记录发光强度较为合适,发光值较高且误差小。
2.2 酸度对酚酞啉增强的HRP–Luminol–H2O2化学发光的影响
在HRP–Luminol–H2O2反 应 体 系(1.0×10–7g/L HRP,1.5 mmol/L Luminol,0.5 mmol/L酚酞啉,3.0 mmol/LH2O2)中,通过改变缓冲液的pH值改变反应体系的酸度,在pH 7.0~9.5范围内测定反应启动后30 s时的发光强度,结果见表2。
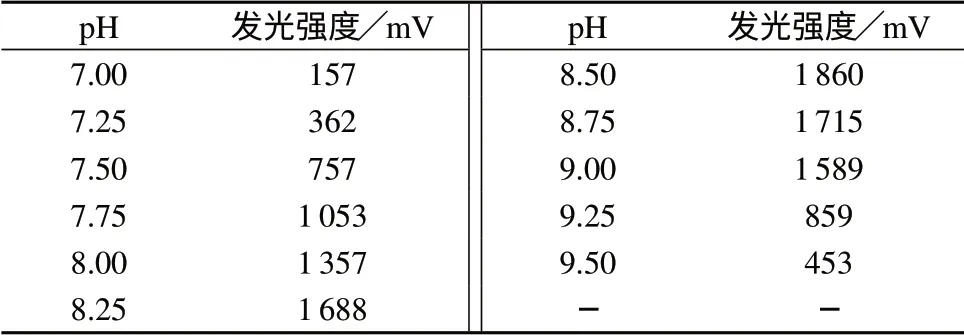
表2 酸度对酚酞啉增强的HRP–Luminol–H2O2酶促发光的作用
由表2可知,酸度对酚酞啉增强的HRP–Luminol–H2O2化学发光影响较大。相对发光强度在pH 8.5时达最大值,pH值低于8.5时衰减迅速,pH 8.5~9.5时缓慢衰减。pH值过低,不利于底物鲁米诺自由基的生成;pH值过高,辣根过氧化物酶的活性受限。实验选择pH 8.5较为合适,灵敏度高。
2.3 酚酞啉的浓度对HRP–Luminol–H2O2化学发光的影响
在HRP–Luminol–H2O2反 应 体 系(1.0×10–7g/L HRP,1.5 mmol/L Luminol,0.5 mmol/L酚酞啉,3.0 mmol/L H2O2,pH 8.5)中依次加入不同剂量的酚酞啉,记录反应启动后30 s时的发光强度,结果见表3。

表3 酚酞啉的浓度对HRP–Luminol–H2O2酶促发光的作用
由表3可知,酚酞啉浓度在0.5~1.0 mmol/L范围内有较好的增强效果。在HRP质量浓度为1.0×10–7g/L时,加入0.5 mmol/L酚酞啉即可获得理想的增强效果,酚酞啉浓度过高反而不利于反应体系的发光。
2.4 标准曲线、精密度和检出限
HRP采用0.1% BSA溶液应用对数稀释法,质量浓度依次为1 600,800,400,200,100,50,25,10,5 pg/mL。在HRP–Luminol–H2O2反应体系(适量的HRP,1.5 mmol/L Luminol,0.5 mmol/L酚酞啉,3.0 mmol/L H2O2,pH 8.5)中,依次递增辣根过氧化物酶含量,启动反应后30 s时记录发光值(见图1)。
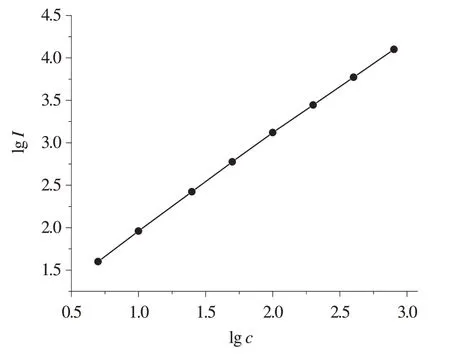
图1 辣根过氧化物酶浓度对HRP–Luminol–H2O2酶促发光的作用
在发光体系中加入酚酞啉,酶含量在5~800 pg/mL范围内(免疫分析常用检测范围)HRP浓度c与相对发光强度I显示良好的线性关系,其线性回归方程为lgI =1.15lgc+0.82,线性相关系数r=0.96。
对空白溶液进行10次平行测定,以测定结果的3倍标准偏差除以校准曲线斜率,求得方法的检出限为1.25 pg/mL。
2.5 精密度试验
取HRP样品,按照实验方法重复测定不同浓度的HRP样品,进行精密度试验,观察批内批间的变异系数,结果见表4。

表4 精密度试验结果(n=10)
由表4可知,批内相对标准偏差为2.8%~5.1%,批间的相对标准偏差为5.8%~8.1%,说明方法具有良好的精密度。
2.6 回收试验
取HRP样品,按照实验方法测定,再分别加入不同体积的100 pg/mL HRP标准工作溶液,进行加标回收试验,结果见表5。由表5可知,HRP加标回收率在93.5%~96.2%之间,说明方法具有较高的准确度。
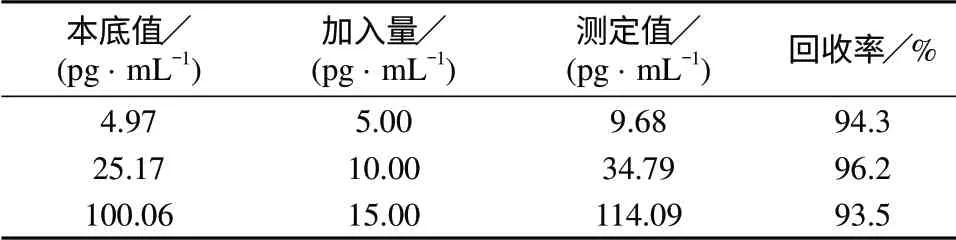
表5 加标回收试验结果
2.7 在HRP标记的AFP检测中的应用
HRP是常用的抗体标记酶,用于增强化学发光系统中具有样品用量少、发光强度大、反应时间短、无污染等优点,在肿瘤标志物临床检测等免疫分析中应用广泛[9]。在发光反应体系中选择临床检验应用广泛的辣根过氧化物酶标记鼠抗人甲胎蛋白单克隆抗体包被IgG代替HRP,观察酚酞啉在其检测中的初步应用。
参照2.4中的测定方法,用Anti–AFP–HRP代替HRP,AFP质量浓度依次为1 600,800,400,100,50,10 ng/mL。AFP含量在10~1 600 ng/mL范围内线性关系良好,其线性回归方程为lgI=1.14lgc+0.78,线性相关系数r=0.98。由于AFP上标记的HRP相对较少,因此其线性范围略宽于纯的HRP。
3 结语
在HRP–Luminol–H2O2反应体系中,增强剂酚酞啉的使用从其稳定性及增强发光作用等都显示出良好的特性,方法具有良好的精密度和准确度。与其它酚类有机增强剂[10–12]不同,酚酞啉合成与纯化简便,价廉高效,使用简便,可以用于HRP及其标记物的化学发光定量分析。
[1]Kamidate T,Komatsu K,Tani H,et al. Direct determination of horseradish peroxidase encapsulated in liposomes by using luminol chemiluminescence[J]. Anal Sci,2008,24(4): 477–481.
[2]Minekawa T,Ohkuma H,Abe K,et al. Development of ultra-high sensitivity bioluminescent enzyme immunoassay for hepatitis B virus surface antigen using firefly luciferase[J]. Luminescence,2009,24(6): 394–399.
[3]Kamidate T,Maruya M,Tani H,et al. Application of 4-iodophenolenhanced luminol chemiluminescence to direct detection of horseradish peroxidase encapsulated in liposomes[J]. Anal Sci,2009,25(9): 1 163–1 166.
[4]Kolthoff I M,Lehmicke D J. Polarographic behavior of phenolphthalein[J]. J Am Chem.Soc,1948,70(5): 1 879–1 885.
[5]Sánchez F G,Díaz A N,Bracho V,et al. Automated determination of asulam by enhanced chemiluminescence using luminol/peroxidase system[J]. Luminescence,2009,24(6): 448–452.
[6]Vladimirov Y A,Proskurnina E V. Free radicals and cell chemiluminescence[J]. Biochemistry (Moscow),2009,74(13): 1 545–1 566.
[7]Rájecký M,Lojek A,Cíž M. Differentiating between intra-and extracellular chemiluminescence in diluted whole-blood samples[J]. International Journal of Laboratory Hematology,2012,34(2): 136–142.
[8]Alpeeva I S,Sakharov I U. Luminol–hydrogen peroxide chemiluminescence produced by sweet potato peroxidase[J]. Luminescence,2007,22(2): 92–96.
[9]Yang X Y,Guo Y S,Bi S,et al. Ultrasensitive enhanced chemiluminescence enzyme immunoassay for the determination of α-fetoprotein amplified by double-codified gold nanoparticles labels[J]. Biosensors and Bioelectronics,2009,24(8): 2 707–2 711.
[10]Xin T B,Chen H,Lin Z,et al. A secondary antibody format chemiluminescence immunoassay for the determination of estradiol in human serum[J]. Talanta,2010,82(4): 1 472–1 477.
[11]Ahmed S,Kishikawa N,Ohyama K,et al. An ultrasensitive and highly selective determination method for quinones by highperformance liquid chromatography with photochemically initiated luminol chemiluminescence[J]. J Chromatogr A,2009,1216(18): 3 977–3 984.
[12]范顺利,屈芳,林金明. H2O2–鲁米诺–荧光素钠–K2CO3高灵敏化学发光法测定二氧化碳[J].化学学报,2006,64(18): 1 876–1 880.
