紫扁豆花色苷提取工艺及树脂初步纯化研究
2014-12-14许小向洪艳平尹小莉闵嗣璠
陆 庆,蒋 艳,许小向,洪艳平*,尹小莉,闵嗣璠
(1.江西农业大学 食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西 南昌 330045;2.江西农业大学 图书馆,江西 南昌 330045)
紫扁豆(Lablab purpureus),豆科植物,多年生或1 年生缠绕藤本植物,外观紫色,常食用其嫩荚或成熟豆粒。扁豆含有包括蛋白质、脂肪、糖类、钙、磷、铁及食物纤维、维A 原、维生素B1、维生素B2、维C等多种营养成分,且扁豆衣中富含B 族维生素[1]。花色苷是花青素与糖类物质以糖苷键结合而成的一类化合物,为广泛存在于蔬菜、水果等食物中的天然色素,属植物化学成分中的黄酮类化合物,具有抗氧化[2]、抗炎症[3]、抗肿瘤[4]、抗动脉粥样硬化[5]等广泛、优异的生物活性,特别是其抗肿瘤活性以天然、低毒、高效而备受关注,已被广泛用于食品、保健品、化妆品、医药等行业。紫扁豆中的色素主要为花色苷,人们可经日常食用途径摄入而起到一定的保健功能。大孔树脂因其理化性质稳定、分离性能优良、溶剂用量少等优点而应用于天然植物活性成分的提取分离[6-7],利用大孔吸附树脂纯化天然植物花色苷多见于紫甘薯[8]、紫甘蓝[9]、蓝莓果[10]等紫红色果蔬。目前,关于紫扁豆花色苷提取及其纯化方面的研究未见报道。作者在研究扁豆花色苷提取工艺并进行含量测定基础上,以大孔树脂进行初步纯化,旨在为人们深入了解紫扁豆的食用价值或开发利用提供理论依据和科学参考。
1 材料与方法
1.1 试验材料
紫扁豆(Lablab purpureus),秋季购于江西农业大学市场,干燥粉碎后备用。
试剂:无水乙醇、盐酸、氢氧化钠、氯化钾、醋酸钠等均为分析纯试剂;树脂:AB-8、X-5、DM-20、DM-21、DM-21D、DM-28、DM-2,山东鲁抗立科药业有限公司。
1.2 仪器
Q-350B3 型高速粉碎机上海冰都电器有限公司;GPX-9248A 型干燥箱/培养箱(两用),上海跃进医疗器械有限公司;玻璃反应釜、W-O 恒温油水浴锅,上海申顺生物科技有限公司;数显恒温水浴锅HH-4,常州国华电器有限公司;FA2104V 型电子天平,上海青浦仪器有限公司;V-5600 型可见分光光度计,上海元析仪器有限公司;SHZ-D(Ⅱ)型循环水式真空泵,巩义市予华仪器有限责任公司;TDL-5-A 型低速大容量离心机,上海安亭科学仪器厂。
1.3 方法
1.3.1 紫扁豆花色苷提取 准确称取紫扁豆粉末3.0 g,加入酸性乙醇溶液,根据试验条件回流浸提完成后,将所得提取液抽滤,滤液置于旋转蒸发仪40 ℃减压浓缩除去酒精,所得溶液定容于100 mL 具塞棕色容量瓶中4 ℃冷藏保存。
1.3.2 花色苷含量测定(1)缓冲液的配制。pH 1.0 缓冲液:称取1.49 g KCl 定容100 mL,1.7 mL HCl定容100 mL,按体积比KCl∶HCl=25∶67 配置。pH 4.5 缓冲液:称取2.72 g NaAc·3H2O 定容100 mL,HCl 调pH。
(2)紫扁豆花色苷最大吸收波长的确定。取一定量紫扁豆提取液用酸性乙醇溶液稀释至一定体积,使其吸光值在一定范围内,在400~600 nm 波长范围内扫描,绘制吸收光谱图。
(3)平衡时间的确定。因花青素在溶液介质中存在4 种结构形式,这些结构在一定pH 下常处于一种动态平衡,当pH 改变时,动态平衡发生移动,总的趋势是pH 降低时,平衡向红色的2-苯基苯并吡喃阳离子移动,pH 升高时,平衡向蓝色的醌式移动,一定时间后达到一个新的平衡[11]。因此色素溶液用缓冲液稀释后,须静置一段时间,等动态平衡稳定后,测吸光值。
(4)紫扁豆花色苷提取得率(以紫扁豆干重计)的测定。采用pH 示差法[12-13],移取2 mL 待测液分别用pH 1.0 和pH 4.5 的缓冲液定容到10 mL,放置一定时间平衡后,波长538 nm 和700 nm 处测定吸光值。
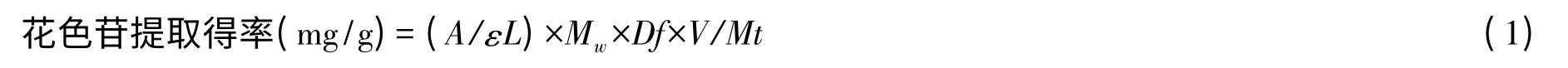
式中:A=(A538nm-A700nm)pH1.0-(A538nm-A700nm)pH4.5;Mw是矢车菊花素-3-葡萄糖苷的相对分子质量449.2;ε 是矢车菊花素-3-葡萄糖苷消光系数26 900;L 为光程1 cm;Df 为稀释因子;V 为最终体积,mL;Mt 为样品质量。
1.3.3 紫扁豆花色苷提取工艺单因素试验和正交设计试验 准确称取3.0 g 紫扁豆粉末5 份,分别考察了pH(1、2、3、4、5)、料液比(1∶8、1∶10、1∶12、1∶14、1∶16)、提取温度(40、50、60、70、80 ℃)、乙醇质量分数(30%、40%、50%、60%、70%)、提取时间(45、60、75、90、105 min)5 个因素对紫扁豆花色苷提取得率的影响。根据单因素试验结果,以料液比、提取温度、乙醇浓度、提取时间为因素,进行正交设计试验,得出紫扁豆花色苷提取的最优条件。
1.3.4 优化条件下的提取级数实验 在正交设计得出的最优条件下分别采用级数为1,2,3 做提取试验,确定不同提取级数对紫扁豆花色苷提取得率的影响。
1.3.5 优化条件下提取的重复性实验 在正交设计得出的最优条件下做重复性提取试验,确定提取条件的可行性和重现性。
1.3.6 树脂静态纯化及色价的测定 (1)最佳树脂的筛选。分别称取已活化处理的各种树脂0.5 g,置于250 mL 具塞锥形瓶中,加入pH3,0.171 9 mg/mL 花色苷粗提液50 mL,盖紧瓶塞。室温(10 ℃)静置24 h 吸附饱和,吸取上清液测定其吸光度A1。将吸附饱和树脂抽滤去除水分,各称取0.5 g 置于250 mL具塞锥形瓶中,加入50 mL pH3.0 的80%乙醇溶液解吸24 h,吸取上清液测定其吸光度A2。
(2)树脂静态纯化。树脂按文献[14]预处理,经静态吸附-解吸试验得到最佳的吸附-解吸条件,将最佳条件下纯化后的溶液真空干燥后用于色价测定。
(3)色价的测定[15]。称取适量纯化并经真空干燥后的紫扁豆花色苷,用pH 3.0 的柠檬酸-磷酸氢二钠缓冲液稀释定容至100 mL,在最大吸收波长处测定吸光值。

式中:A 为最大吸收波长处吸光值;m 为称取样品的质量。
2 结果与分析
2.1 紫扁豆花色苷提取液光谱扫描图谱
紫扁豆花色苷提取液经紫外可见分光光度计扫描后的光谱图见图1。由图1 可知紫扁豆花色苷的最大吸收波长为538 nm。
2.2 平衡时间的确定
由表1 可知,在pH 1.0 的缓冲液中,样液的吸光值随时间的延长而增大,150 min 时达平衡;在pH 4.5 的缓冲液中,样液的吸光值随时间的延长而增大,150 min 时达平衡。所以,平衡时间选择150 min。
2.3 不同因素对紫扁豆花色苷提取效果影响
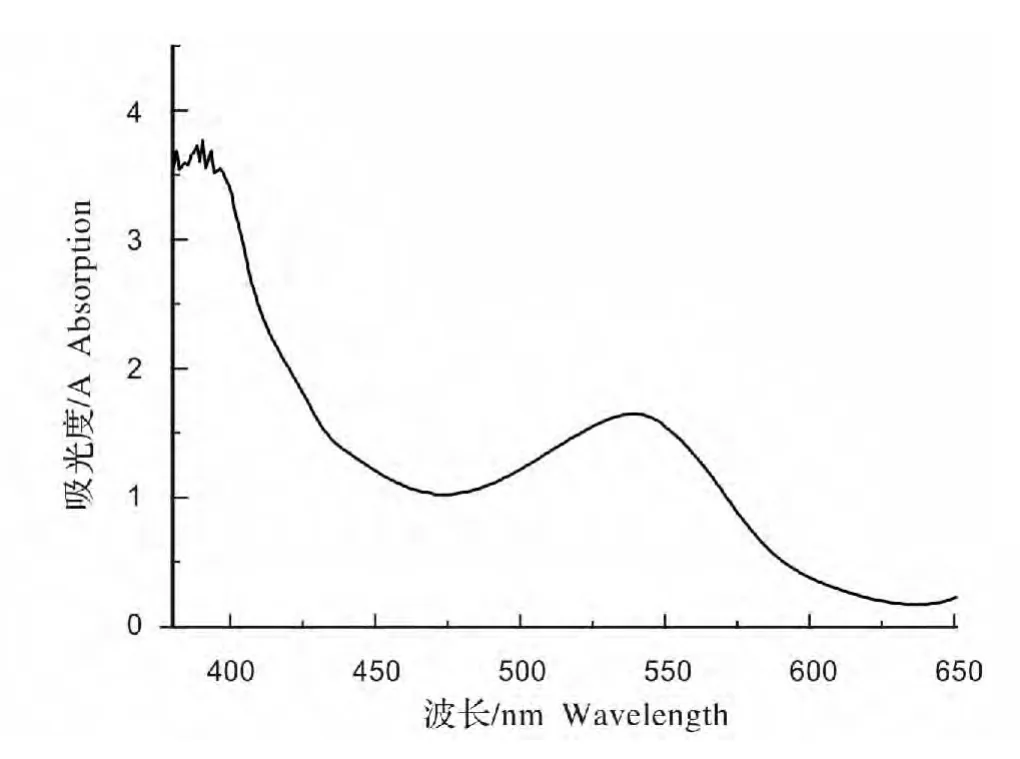
图1 紫扁豆花色苷光谱扫描图Fig.1 Spectrum scanogram of anthocyanins from Lablab purpureus
图2(a)表明,随着乙醇溶液的pH 不断增大,提取液中花色苷提取得率在pH 3 时达到最高,随后有所下降,说明花色苷在酸性条件下较稳定,故提取溶剂为pH 3 为较佳pH 值;从图2(b)结果看出,料液比增大到1∶12 后,花色苷的提取得率趋于平缓,综合考虑经济效率因素,确定1∶12 为较合适料液比;随浸提温度的升高利于花色苷的浸出,在60 ℃下提取液中花色苷得率达最高,然而温度升高后提取液中花色苷含量有所下降[图2(c)],这可能与较高温度下导致花色苷结构破坏有关,从花色苷化学结构角度分析,加热时,因为蓝色的醌式碱(A)、红色的氧鎓离子(AH+)之间是可逆的,平衡向形成查尔酮的方向移动,结果使显色物质(AH+和A)含量降低[16];图2(d)结果显示,不同质量分数乙醇提取液中花色苷含量在30%~60%范围内呈上升趋势,在质量分数为60%时达最高,乙醇浓度增大后其极性下降不利于极性较大的花色苷溶出;从提取时间对花色苷提取得率的影响[图2(e)]可以看出,溶液中花色苷呈先升后降的趋势,天然色素不稳定,随提取时间的延长,花色苷可能被氧化导致其结构骨架发生变化而使其含量降低,因此选择75 min 为较合适的提取时间。
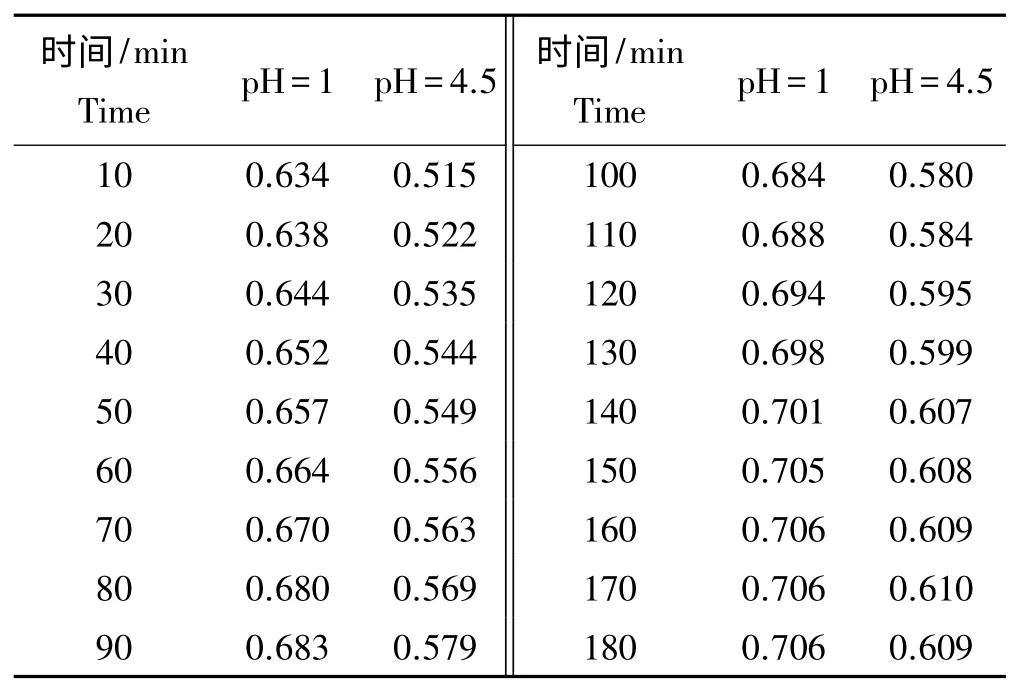
表1 平衡时间的确定Tab.1 Determination of the equilibrium time
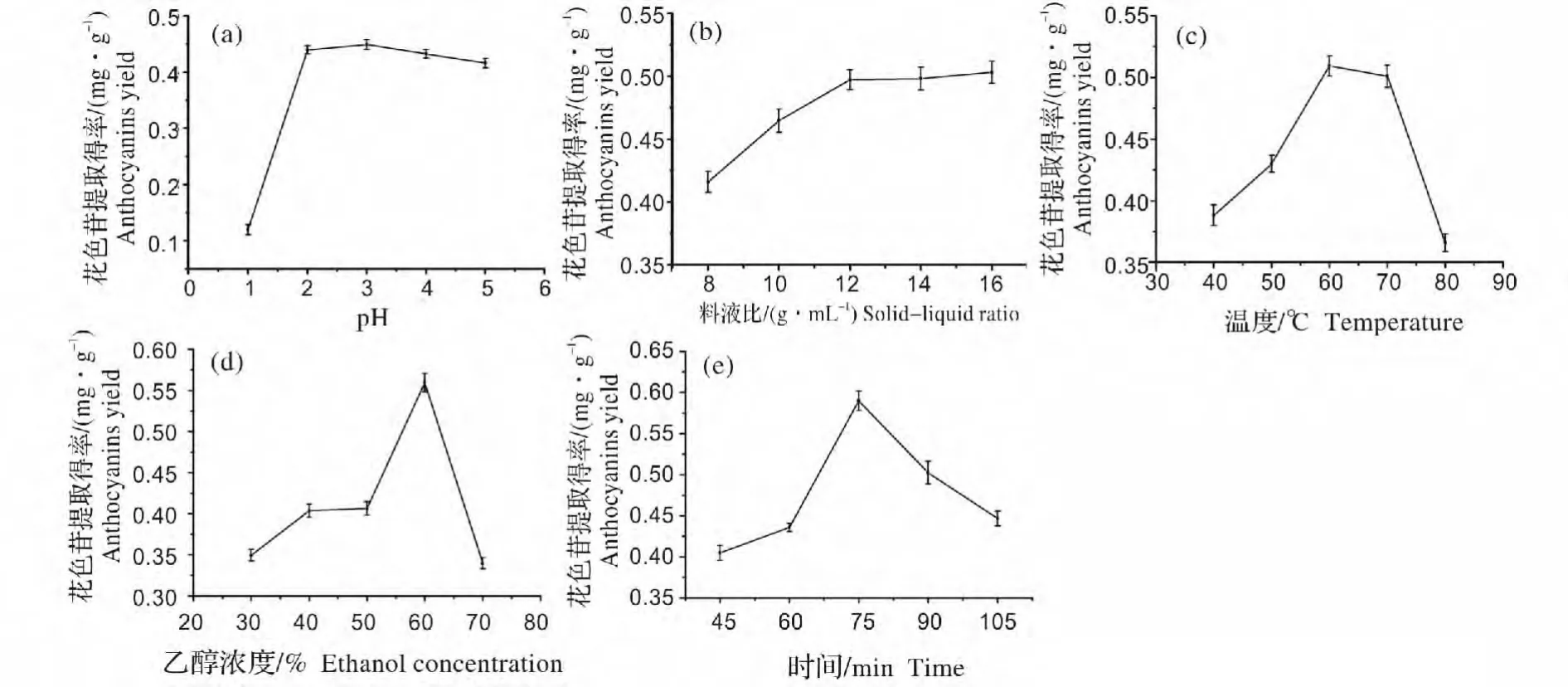
图2 pH、料液比、温度、乙醇浓度、时间对紫扁豆花色苷提取得率的影响Fig.2 Effect of pH value,solid-liquid ratio,extraction temperature,ethanol concentration,extraction time on yield of anthocyanins
2.3.1 正交试验结果 为使提取条件进一步优化,得到理想的提取效果,根据单因素试验结果,pH 确定为3,设定正交试验因素水平表(表2~表5)。
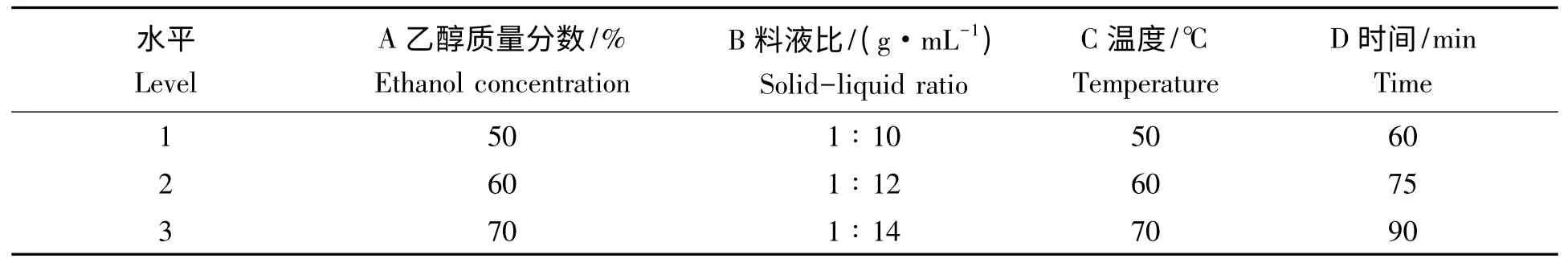
表2 正交试验因素水平Tab.2 Levels and factors of L9(34)orthogonal test
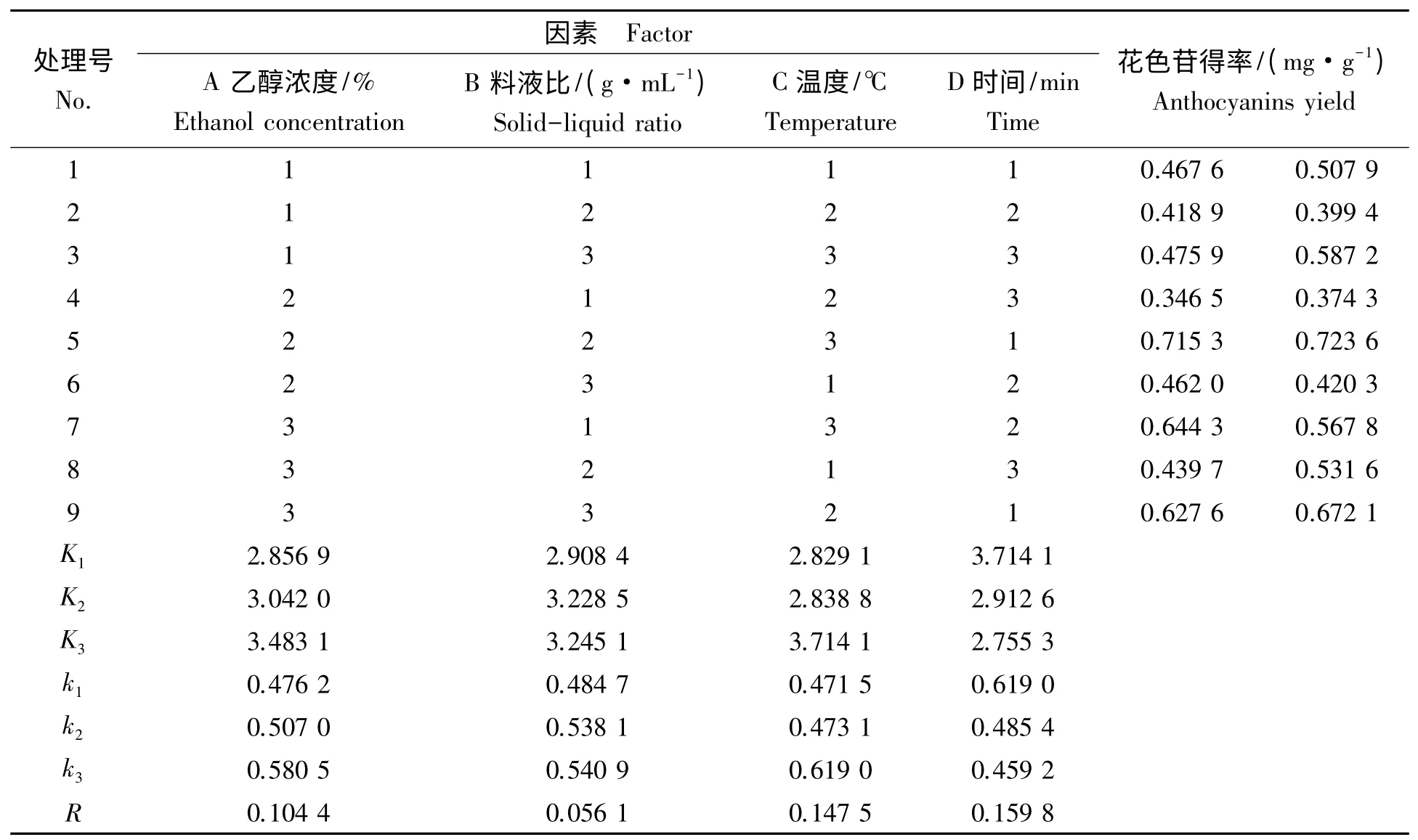
表3 正交试验设计与数据处理Tab.3 The design and results of orthogonal test
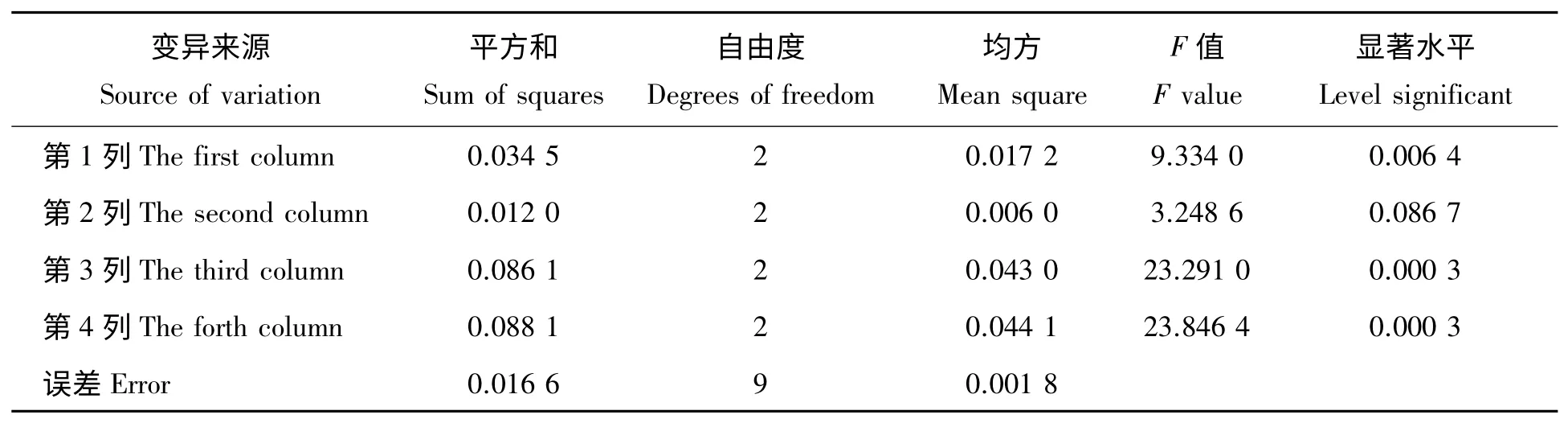
表4 正交设计方差分析Tab.4 Analysis of variance

表5 正交试验Duncan 法多重比较结果Tab.5 Result of Duncan multiple comparison for the orthogonal test
在正交实验中(表3)第5 组组合方案A2B2C3D1得到的花色苷提取得率达到0.723 6 mg/g,与综合Duncan 多重比较和极差分析(表4,5)所得最优水平组合A3B3C3D1不符,分别对A2B2C3D1和A3B3C3D1进行验证试验,花色苷提取得率分别为0.731 1 mg/g 和0.689 4 mg/g,所以最终确定紫扁豆最佳提取工艺参数为A2B2C3D1,即乙醇质量分数为60%,料液比1∶12,提取温度70 ℃,提取时间60 min。极差分析可知,影响紫扁豆花色苷提取得率各因素主次关系依次为:提取时间(D)、提取温度(C)、乙醇浓度(A)、料液比(B)。
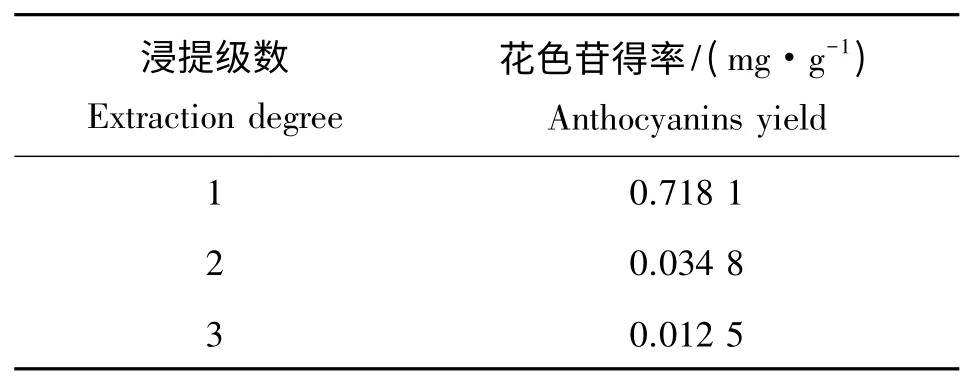
表6 提取级数试验结果Tab.6 The result of extraction series
2.3.2 提取级数及提取重复性实验结果
由表6 可知,提取第1 次后紫扁豆花色苷提取得率较高,经计算,提取1 次已达到3 次提取得率总和的93.8%,所以试验确定提取级数为一级。
由表7 可知,试验测得的结果变异系数为1.04%,表明重现性较好,试验得出的最优组合方法是正确可行的。
2.4 最佳树脂筛选
7 种树脂的静态吸附与解吸实验结果如表8 所示。由表8 可知,DM-28 树脂优势显著,吸附和解吸相比其他6 种树脂效果好,可能是由于DM-28 树脂颗粒较小,具有较大比表面的比表面积,所以选定DM-28 为最佳树脂。
2.5 紫扁豆花色苷树脂初步纯化结果
经初步的DM-28 树脂静态吸附-解吸,确定树脂DM-28 为纯化紫扁豆花色苷的最佳树脂。紫扁豆花色苷纯化前色价为2.1,纯化后色价提高到10.3,是纯化前的4.9 倍。
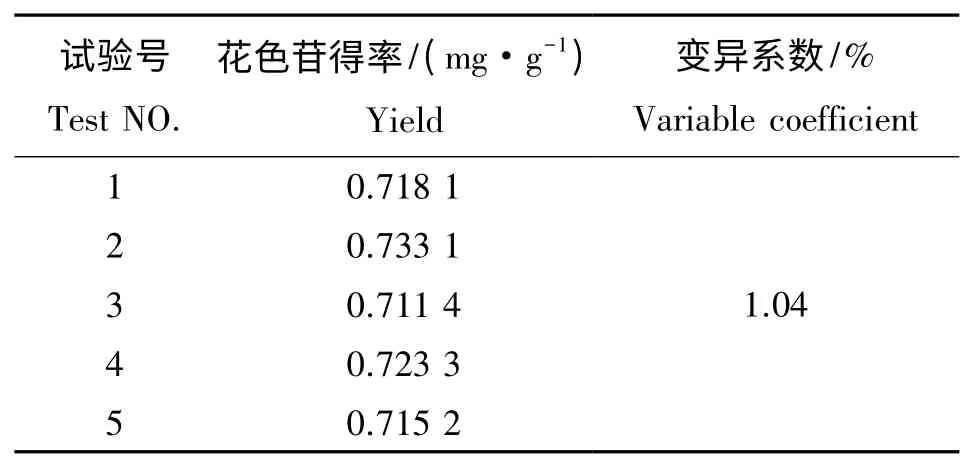
表7 重现性试验结果Tab.7 The result of repeat test
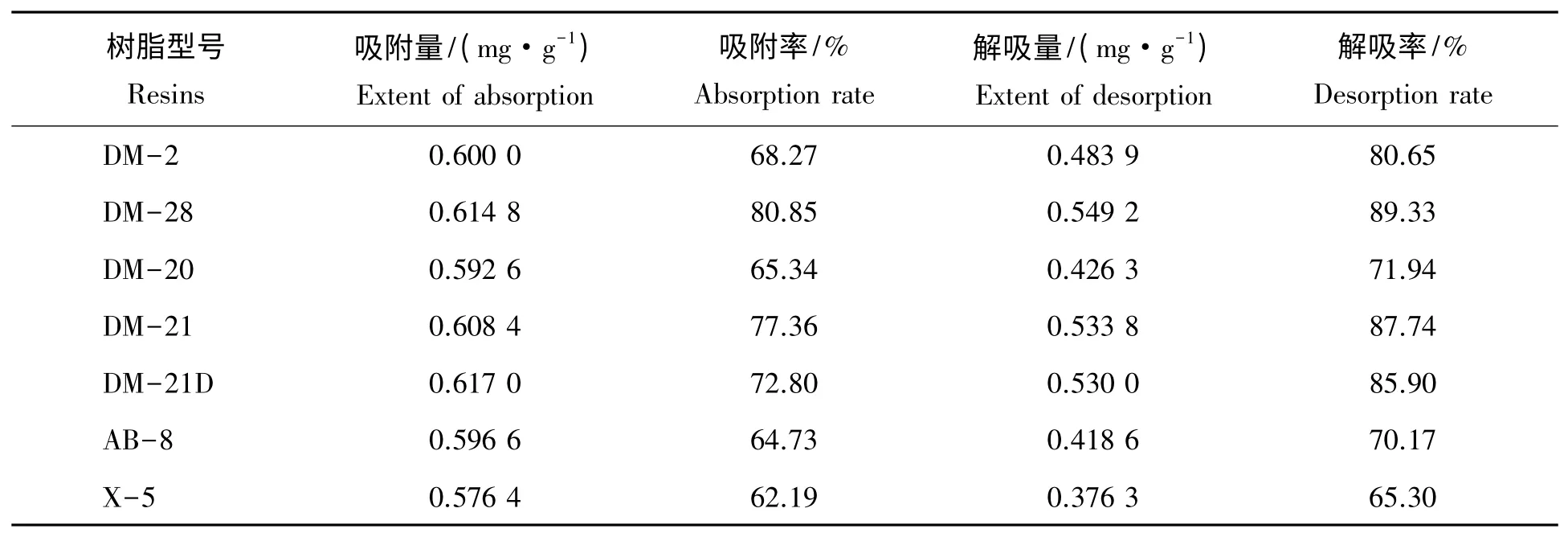
表8 7 种大孔树脂静态吸附与解吸性能比较Tab.8 Comparison of the absorption and desorption properties of seven different macroporous resin
3 结论
通过单因素和正交试验优化了紫扁豆花色苷最佳提取工艺条件,选择pH 为3,提取乙醇质量分数为60%,料液比1∶12,提取温度70 ℃,提取时间60 min,得到花色苷最大提取得率为0.733 1 mg/g。筛选出DM-28 为较适合纯化紫扁豆花色苷的大孔树脂,在静态条件下,经DM-28 树脂吸附-解吸后,紫扁豆花色苷的色价纯化后是纯化前的4.9 倍。
[1]Hendricksen R E,Minson D J,陈礼伟.紫扁豆[J].国外畜牧学:草原与牧草,1987(1):12-20.
[2]刘国凌,郭红辉,尚彬.岗稔果皮花色苷体外抗氧化活性研究[J].食品工业,2014,35(1):203-206.
[3]王静,马养民,逯文静.蓝莓花青素的纯化及镇痛、抗炎药效学研究[J].食品工业科技,2013,34(5):338-340.
[4]刘奕琳,王振宇.蓝靛果花色苷乙醇洗脱物抗癌活性的研究[J].食品工业科技,2012,33(19):159-161.
[5]林丽,李进,吕海英,等.黑果枸杞花色苷对小鼠动脉粥样硬化的影响[J].中国中药杂志,2012,37(10):1460-1466.
[6]杨武英,上官新晨,吴磊燕,等.大孔树脂精制芦荟叶黄酮的研究[J].江西农业大学学报,2010,32(1):169-174.
[7]戴余军,潘国栋,张昭,等.大孔树脂对黑胡萝卜花色苷纯化工艺的研究[J].中国调味品,2013,38(4):114-118.
[8]孙健,岳瑞雪,钮福祥,等.紫甘薯花青素的大孔树脂动态吸附工艺优化[J].江苏农业科学,2013,41(6):227-229.
[9]朱振宝,吴园芳,易建华.紫甘蓝花色苷色素稳定性研究[J].粮食与油脂,2011(10):46-49.
[10]李颖畅,郑凤娥,孟宪军.大孔树脂纯化蓝莓果中花色苷的研究[J].食品与生物技术学报2009,28(4):496-500.
[11]Fuleki T,Francis F J.Quantitative methods for anthocyanins,extraction and determination of total anthocyanin incranberries[J].Journal of Food Science,1968,33(1):72-77.
[12]邓素芳,王天池,赖钟雄.pH 示差法测定野生蕉果皮花青素含量[J].中国南方果树,2014,43(2):5-7.
[13]Wrolstad R E.Color and pigment analyses in fruit and products[M].Agriculture Experiment Station,Oregon State University,Station Bulletin 1976:624.
[14]尹忠平,洪艳平,徐明生.大孔树脂吸附纯化粗提玫瑰茄红色素研究[J].江西农业大学学报,2007,29(6):1026-1030.
[15]郭松年,徐驰,刘兴华,等.温度、pH 值和光照对石榴汁花色苷稳定性的影响[J].食品与发酵科技,2009,45(5):29-34.
[16]王丰,明哲.红树莓果实花色苷提取工艺[J].江苏农业科学,2010,38(5):377-378.
