原发性肝细胞癌血管生成拟态观察中PAS染色法的应用*
2014-12-04林丽琳翁剑武吴志峰
刘 彪,林丽琳,翁剑武,吴志峰,王 凤,谢 群
莆田学院基础医学院人体解剖与组织胚胎学教研室 莆田351100
自从Maniotis 等[1]在对人眼葡萄膜黑色素瘤微循环的研究中发现并提出了血管生成拟态(vasculogenic mimicry,VM)之后,高侵袭性恶性肿瘤VM 成为研究热点。VM 指瘤细胞围绕形成的管状结构,且管状结构的内部伴有血浆和红细胞,其对评价肿瘤疗效和患者预后有重要价值[2]。VM 主要通过过碘酸-希夫(periodic acid-schiff staining,PAS)染色并结合CD34 等血管内皮特异性标记分子来确定。然而,PAS 染色过程中存在染色浅、层次不分明、假阳性等问题,给VM 的观察与鉴别造成了困扰。作者在原发性肝细胞癌(hepatocellular carcinoma,HCC)VM 的研究中发现,组织切片厚度、孵育温度、染色及阅片等环节对实验结果的影响至关重要。为此,作者总结了相应的应对措施,为正确使用PAS 染色提供借鉴。
1 材料与方法
1.1 主要材料与试剂 采用莆田学院附属医院病理科保存完整的HCC 石蜡标本制作病理切片。PAS 试剂盒购自罗基(北京)生物技术有限公司;CD34 抗体、SP 染色试剂盒及DAB 试剂盒为福州迈新生物技术开发有限公司产品。
1.2 切片制备与CD34-PAS 双染 标本在切片前置于-20℃冰箱中冷冻15~20 min,制备厚度分别为2 和3 μm 的切片。切片自然干燥后于65℃烤箱中烘烤120 min,常规脱蜡水化,抗原修复,用过氧化物酶阻断山羊血清封闭后滴加CD34 抗体工作液,置湿盒于4℃孵育过夜,滴加二抗孵育20 min,DAB显影,观察到内皮细胞着色后终止显色反应。将切片置于10 g/L 高碘酸(A 液)中氧化5 min,蒸馏水冲洗3次后加入Schiff 溶液(B 液)避光孵育15 min,流水冲洗10 min 后加入Little-Mayer 苏木素(C液)染色4 min,蒸馏水浸洗后加入体积分数1%盐酸乙醇(D 液),待组织颜色变红立即终止分化,流水冲洗15 min 后用蒸馏水浸洗3次,逆浓度梯度乙醇脱水、二甲苯透明后用中性树胶封片。
1.3 结果判定 镜下CD34 染色阳性表现为血管内皮细胞呈棕褐色着色,PAS 染色阳性表现为管腔基底膜呈紫红色着色。若观察到由肝癌细胞呈梁状排列构成的网状血管通道,腔内可见红细胞,血细胞与肝癌细胞之间有呈樱桃红色的PAS 阳性的基底膜样结构,且CD34 阴性,即判定为VM;若管壁有CD34 阳性的内皮细胞和PAS 阳性结构,无论腔内有无红细胞均判定为内皮细胞依赖性血管。
2 结果
2.1 内皮细胞依赖性血管的形态特点 HCC组织中肝血窦出现毛细血管化,内皮细胞CD34 阳性,内皮细胞下方也出现PAS 阳性的基底膜,说明HCC组织中存在CD34-PAS 双阳性血管,判定为内皮细胞依赖性血管(图1)。
2.2 VM 的形态特点 采用3 μm 厚的切片及上述优化的染色步骤进行CD34-PAS 双染,VM 结构的PAS 染色显色深浅合适,对比度强,镜下辨析度高。HCC组织中VM 主要呈现两种形态:由CD34 阴性的肝癌细胞构成拟态管腔,一层薄厚不均的PAS 阳性基底膜将肿瘤细胞和管腔内的红细胞分开,这种称为肿瘤细胞型VM(图1C);若管腔主体结构是PAS 阳性的基底膜而不是肿瘤细胞,则称之为细胞外基质型VM(图1D)。但是如果采用2 μm 厚的切片,则PAS 胞浆染色结果呈浅粉偏白,细胞边缘樱桃红色略明显(图1E),不利于镜下观察。
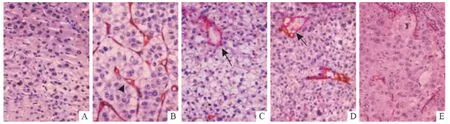
图1 HCC组织中内皮细胞依赖性血管和VM 的形态(CD34-PAS 双染法,×400)
2.3 容易与VM 混淆的病变结构的形态特点HCC组织中肝细胞常伴有透明细胞型及假腺样结构等多种病变,易与VM 混淆。透明细胞型的肝癌细胞体积大,胞质可呈淡染细丝状或透明空泡样,PAS 染色亦呈阳性(图2A);假腺样结构可见癌细胞呈单层立方上皮样围成类似甲状腺滤泡样的结构(图2B)。
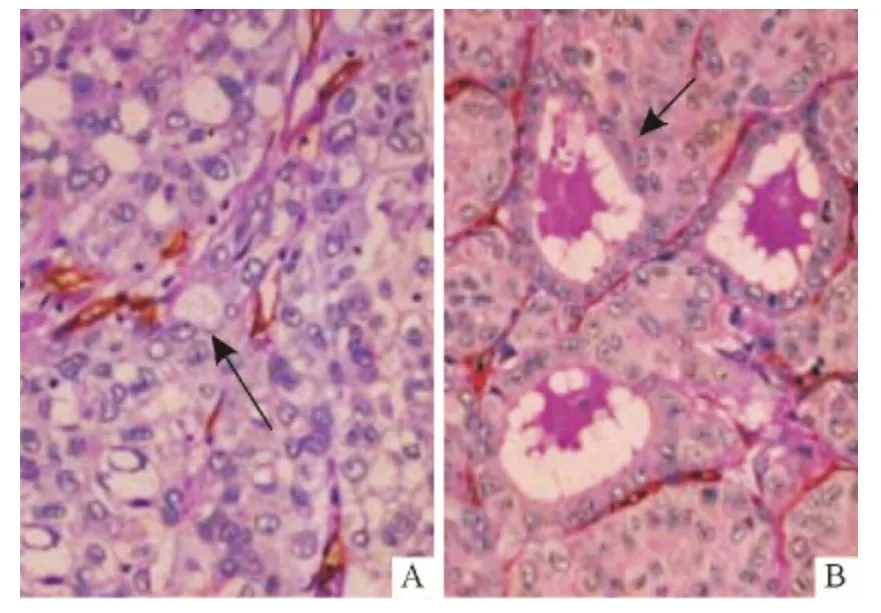
图2 HCC 中其他病变结构的形态(CD34-PAS 双染法,×400)
3 讨论
近年来,肿瘤微循环研究中常应用CD34-PAS双染法来判定内皮细胞依赖性血管和VM 等结构。作者应用此方法对HCC组织进行染色观察,对应用过程中的注意事项进行了总结。
3.1 试剂的保存和使用 实验中作者发现,Schiff试剂现配使用效果较佳,但配制步骤繁复,保存时间较短,一般采用PAS 试剂盒。即使将Schiff 试剂4℃避光保存仍易失效,故作者采用-20℃避光分装保存,使用前恢复至室温,避免反复冻融和开启影响染色效果。正常的Schiff 试剂打开时有明显气味,反之则失效[3]。若失效,每10 mL 溶液中加入0.108 g偏重亚硫酸钠仍可使用[4]。
3.2 切片制备 通常一个肝癌细胞的直径约为6 μm,SP 法染色中一般采用2 μm 厚切片,以防止细胞重叠不利于镜下观察。但作者发现,2 μm 厚的切片PAS 胞质染色浅粉偏白,细胞边缘樱桃红略明显,不利于镜下观察,故在预实验时采用同一组织块的连续切片,对比了染色效果,最终发现3 μm 厚的切片染色效果较佳。
3.3 染色过程中的注意事项 作者发现,实验室室温直接影响PAS 染色效果。Schiff 试剂的最佳反应温度在26℃以上,将冷冻的试剂取出后须避光恢复至室温后方可使用。冬季则可将湿盒放置于调好温度的恒温箱里,既能保温,又能避光。PAS 试剂盒中的A、B 液滴加到组织块时会局限于组织块边缘,无法扩开,易造成边缘淡染。虽然作为去垢剂的Tween-20 具有表面扩张力的作用,加入洗液中可扩开液面,但是作者发现Tween-20 会淡化阳性的樱桃红染色,故不建议使用。适当增加试剂用量,可使扩大的液滴缓慢覆盖住组织边缘,从而改善最终染色结果。
3.4 重视假阳性染色 PAS 染色过程易出现假阳性而造成误判。过碘酸是一种强氧化剂,它能氧化糖类及有关物质中的1,2-乙二醇基或者多糖分子的去氢葡萄糖残基,使之变为二醛,醛再与Schiff 试剂结合,形成一种紫红色的品红化合物。同时过碘酸还可将细胞内某些物质氧化,从而出现干扰性的假阳性染色。因此,使用过程中应注意选择好过碘酸的浓度及氧化时间。作者发现,采用10 g/L 过碘酸进行染色并将时间控制在5 min,假阳性染色控制较好,超过10 min 则容易出现假阳性[5]。实验中还应设置空白对照,即省去滴加Schiff 试剂这一步骤,可以验证组织中是否有可见糖原,从而排除假阳性。
3.5 VM 结构的辨析 阅片并对VM 结构进行辨析是实验的关键环节。判定肿瘤细胞型VM 的要点是管壁结构为肝癌细胞而非内皮细胞[6],一般HE染色病理学观察即能确定,也可以进一步行Hepatocyte 染色确定是否为肝癌细胞。PAS 阳性的基底膜是重要的判定依据之一,但有时PAS 阳性物质可能会不连续[7]。透明细胞型病变结构易与VM 相混淆,但该结构的外周不会出现肝癌细胞环绕排列,且透明区域不会出现红细胞;假腺样结构在镜下除类似甲状腺滤泡样的结构外,腔内常出现PAS 阳性的胆汁;上述特点可用于VM 与其他病变结构的区别。
[1]Maniotis AJ,Folberg R,Hess A,et al.Vascular channel formation by human melanoma cells in vivo and in vitro:vasculogenic mimicry[J].Am J Pathol,1999,155(3):739
[2]王珏,王莉,张健.不同组织中PAS 染色的特点[J].郧阳医学院学报,2009,28(5):505
[3]王媛,邓锋,肖咏丽,等.肝脏组织PAS 染色方法的探讨[J].疾病预防控制通报,2012,27(1):5
[4]魏丽.介绍一种PAS 染色中Schiff 液失效后的重新利用方法[J].济宁医学院学报,2010,33(3):204
[5]李剑颖.高碘酸-希夫染色的应用体会[J].检验医学与临床,2009,6(6):456
[6]陈银生,李聪,梅鑫,等.人脑胶质母细胞瘤微循环模式观察[J].中国神经肿瘤杂志,2012,10(2):76
[7]赵秀兰,杜静,张诗武,等.肝细胞肝癌中血管生成拟态的研究[J].中华肝脏病杂志,2006,14(1):41
