山羊传染性胸膜肺炎支原体C87001株菌种纯化克隆研究
2014-11-29伏小平
王 颖,伏小平*,王 栋
(1.甘肃农业大学动物医学院,兰州730070;2.中国兽医药品监察所,北京100081)
山羊支原体山羊肺炎亚种支原体(Mycoplasma capricomlum subspecies capricomlum,MCCP)是引起山羊传染性胸膜肺炎的病原。目前,我国用山羊传染性胸膜肺炎支原体强毒气管注射山羊,采集肺组织制成山羊传染性胸膜肺炎组织灭活疫苗,该疫苗不适宜工业化生产,存在散毒的危险;肺组织中杂菌含量高,所制备的疫苗易出现过敏反应,且安全性低等。因此,市场急需研制出一种安全、有效、适宜工业化生产的半合成培养基培养的山羊传染性胸膜肺炎灭活疫苗。菌种在经过多年复壮、传代后,易污染绵羊肺炎支原体(Mycoplasma ovipneumoniae,MO),其支原体含量及遗传稳定性也发生变化。为了使菌种保持纯净性和良好免疫原性,对现有制苗用C87001株冻干肺组织菌种进行克隆研究。
1 材料与方法
1.1 材料
1.1.1 菌种 山羊传染性胸膜肺炎支原体C87001株冻干肺组织,规格 1.5 g/支,1973年、1980年4月9日冻干;绵羊肺炎支原体Y-98,C4代,规格1.0 mL/支,1998年6月20日冻干;检验用强毒,山羊传染性胸膜肺炎支原体强毒C87002株,代号87002,代次:52 代,规格:1.0 g/支,均由中国兽医药品监察所鉴定、保管和供应。
1.1.2 实验动物 1岁龄山羊,健康、无传染病、皮肤病和寄生虫感染,应用间接血凝抑制试验检测绵羊肺炎支原体Y98株血清抗体为阴性,经山羊传染性胸膜肺炎支原体F38株及布鲁氏杆菌病等血清学检验均为阴性。
1.1.3 支原体培养基制备 水解乳蛋白2.5 g,酵母粉5.0 g,葡萄糖2.0 g,MEM 1.0 g,PPLO 肉汤粉17.5 g,丙酮酸钠2.0 g,1%酚红1.0 mL,加入少量蒸馏水中,待充分溶解后用蒸馏水定容至1000 mL,用1 mol/L NaOH调pH值至7.8左右,经0.22 μm 过滤除菌加20%马血清制成。
1.1.4 试剂 抗绵羊肺炎支原体血清,规格2.0 mL,琼扩效价1∶8,冻干日期1989年2月15日,由中国兽医药品监察所制备;细菌基因组DNA提取试剂盒(天根,DP302);Premix Ex Taq(TaKaRa,D335A);硫柳汞(德国进口);Montanide ISA 50V佐剂(SEPPIC,50873)。
1.1.5 仪器及设备 IAK 2000/4型乳化机;5804R型台式高速冷冻离心机;pro Gradient96 PCR仪;GNP-9270型隔水式恒温培养箱;WD-9430紫外分析仪;DYY-12型电泳仪;Dophin-Chemi凝胶成像系统。
1.2 方法
1.2.1 制苗用菌种的PCR鉴定 取山羊传染性胸膜肺炎支原体C87001株冻干肺组织,用支原体培养基连续传至7代,分别收获1~7代培养物。参照试剂盒提供的方法分别提取1~7代培养物样本菌液和绵羊肺炎支原体标准毒Y-98菌液的基因组 DNA。根据 Woubit等[1]、Thomas等[2]建立的特异性检测MCCP、MO的PCR方法的引物信息(表1)合成引物,对所提取基因组DNA样本进行PCR检测,反应体系和反应条件按照Woubit和Thomas方法,2%琼脂糖凝胶电泳检测PCR产物。
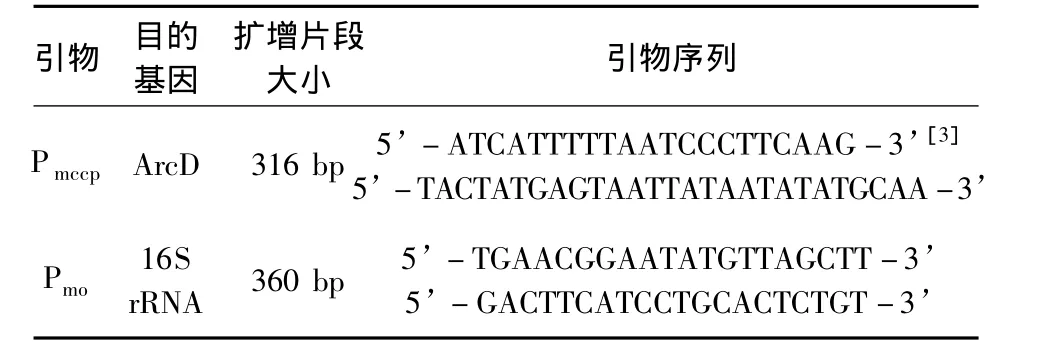
表1 引物信息
1.2.2 菌种的纯化克隆[4]用支原体培养基将C87001株肺组织冻干菌种(1980年)恢复原体积,取稀释液0.2 mL加入1.8 mL含有50%抗绵羊肺炎支原体血清的EZH培养基中,进行10倍系列稀释至10-10,37℃培养5 d。取有变色反应的最高稀释度菌液0.2 mL,再加入1.8 mL含有50%抗绵羊肺炎支原体血清支原体培养基中,再进行10倍系列稀释至10-10,37℃培养5 d,如此反复筛选5次,取第5次筛选试验中有变色反应的最高稀释度菌液进行菌落克隆试验。
取菌液0.2 mL加入1.8 mL的支原体培养基中,进行10 倍系列稀释至10-5,分别取10-3、10-4、10-53个稀释度菌液,移植于支原体固体培养基平板,0.2 mL/平板,37 ℃、5%CO2培养4 ~6 d。显微镜下挑取细小圆形或椭圆形露滴状透明、中央乳头状突起明显、呈“煎蛋”样的单个菌落,接种支原体培养基,37℃培养5 d,重复克隆5次,取第5次克隆后收获的菌液进行PCR鉴定。
1.2.3 PCR鉴定 参照试剂盒提供的方法提取1.2.2项所获得的MCCP菌液和绵羊肺炎支原体标准株Y-98的基因组DNA[5],分别用其特异性引物进行PCR反应,2%琼脂糖凝胶电泳检测PCR产物,并进行基因测序。
1.2.4 克隆株回归实验 将纯化的C87001克隆株第5代培养物,按照2%接种支原体培养基,37℃培养5 d,收获菌液进行活菌计数,取活菌滴度≥109.0CCU/mL气管注射健康易感山羊4只,每只羊10.0 mL,观察30 d。
1.2.5 克隆株形态和生化特性鉴定 将1.2.2项收获的克隆株菌液制备抹片,经姬姆萨染色镜检,并对菌液进行葡萄糖发酵试验、精氨酸试验、尿素试验、膜斑试验、毛地黄皂苷试验,鉴定克隆株生化特性。
1.2.6 克隆株培养特性鉴定 将纯化的C87001克隆株第5代培养物接种支原体培养基中培养,37℃培养5 d,观察培养特性;克隆株第5代培养物接种支原体培养基培养,置密闭罐中,37℃培养5 d,观察菌落形态。
1.2.7 克隆株纯粹检验 取克隆菌株接种TG小管及支原体培养基斜面各2支,每支0.2 mL,1支置37℃培养,1支置25℃培养,观察5 d。
1.2.8 克隆株免疫原性测定 按规程[6]用山羊传染性胸膜肺炎支原体C87001克隆株,接种支原体培养基,收获培养物适当浓缩,经硫柳汞灭活后,加矿物油佐剂混合乳化制成疫苗。选用1岁龄健康易感山羊4只,每只肌肉注射疫苗2.0 mL。免疫后21 d攻毒,连同条件相同的对照羊3只,各气管注射15个发病量的山羊传染性胸膜肺炎支原体强毒C87002株组织乳剂4.0 mL。观察30 d。
2 结果
2.1 制苗用菌种PCR鉴定结果 制苗用C87001株肺组织冻干物(1973年),在1~3代培养物中同时扩增出MCCP目的基因在316 bp处的特异性条带和MO目的基因在360 bp处的特异性条带,4~7代培养物PCR检测仅扩增出MO目的基因在360 bp处的特异性条带(图1、图3);制苗用C87001株肺组织冻干物(1980年),在1~7代培养物中同时扩增出MCCP目的基因在316 bp处的特异性条带和MO目的基因在360 bp处的特异性条带(图2、图4)。
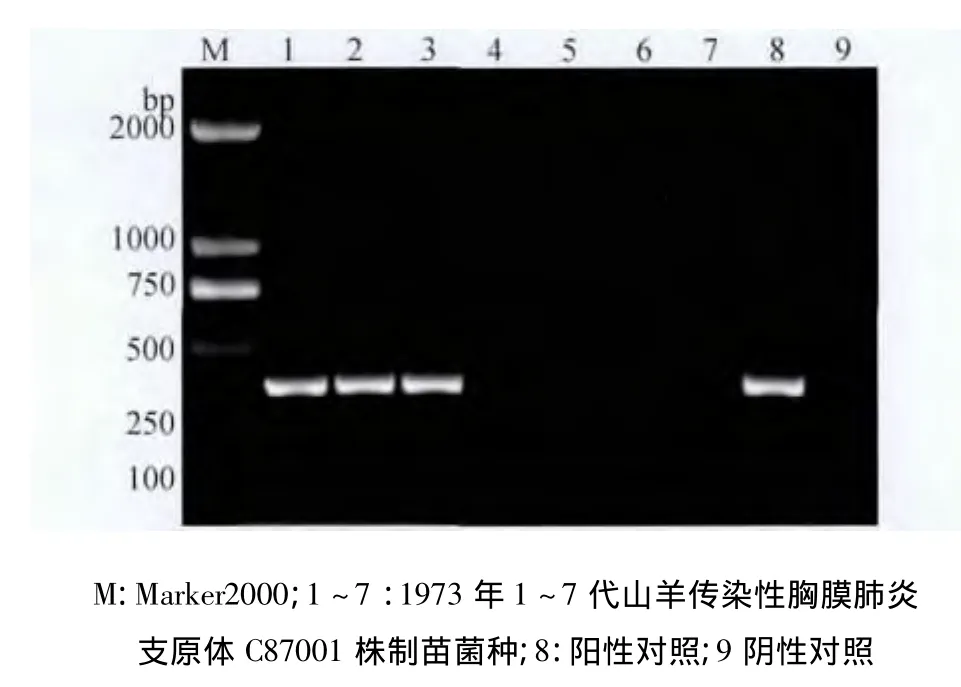
图1 1973年MCCP扩增电泳图
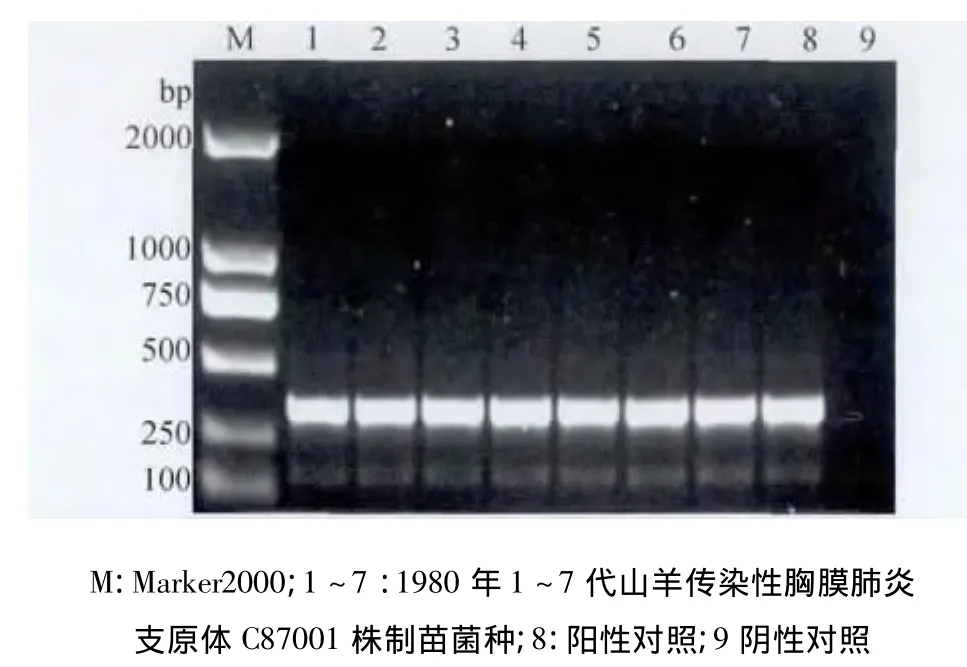
图2 1980年MCCP扩增电泳图

图3 1973年MO扩增电泳图
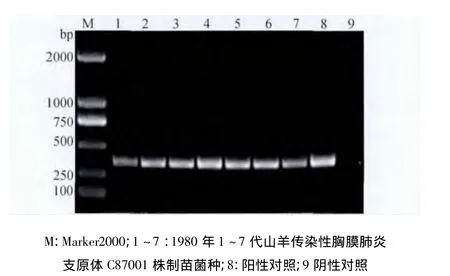
图4 1980年MO扩增电泳图
2.2 山羊传染性胸膜肺炎支原体克隆纯化鉴定结果 原始菌种C87001株经抗绵羊肺炎支原体血清反复抑制,接种支原体培养基长出中心呈脐状突起、边缘整齐的圆形菌落,符合山羊传染性胸膜肺炎支原体的菌落形态。筛选克隆菌落纯化后PCR结果中,第1、5泳道分别为纯化前种毒液Pmccp,Pmo引物扩增的结果,两条都有扩增,同时含有山羊支原体山羊肺炎亚种支原体和绵羊支原体两种支原体病原目的基因;第2、7泳道分别为纯化后种毒液Pmccp,Pmo引物扩增的结果,只有2泳道有扩增,毒种得到了纯化,只含有山羊支原体山羊肺炎亚种支原体目的基因,绵羊肺炎支原体已经得到清除;第3、6泳道为绵羊肺炎支原体两对引物的扩增结果;第4、8泳道为空白对照,因此阳性阴性对照都成立(图5),PCR扩增结果可信。
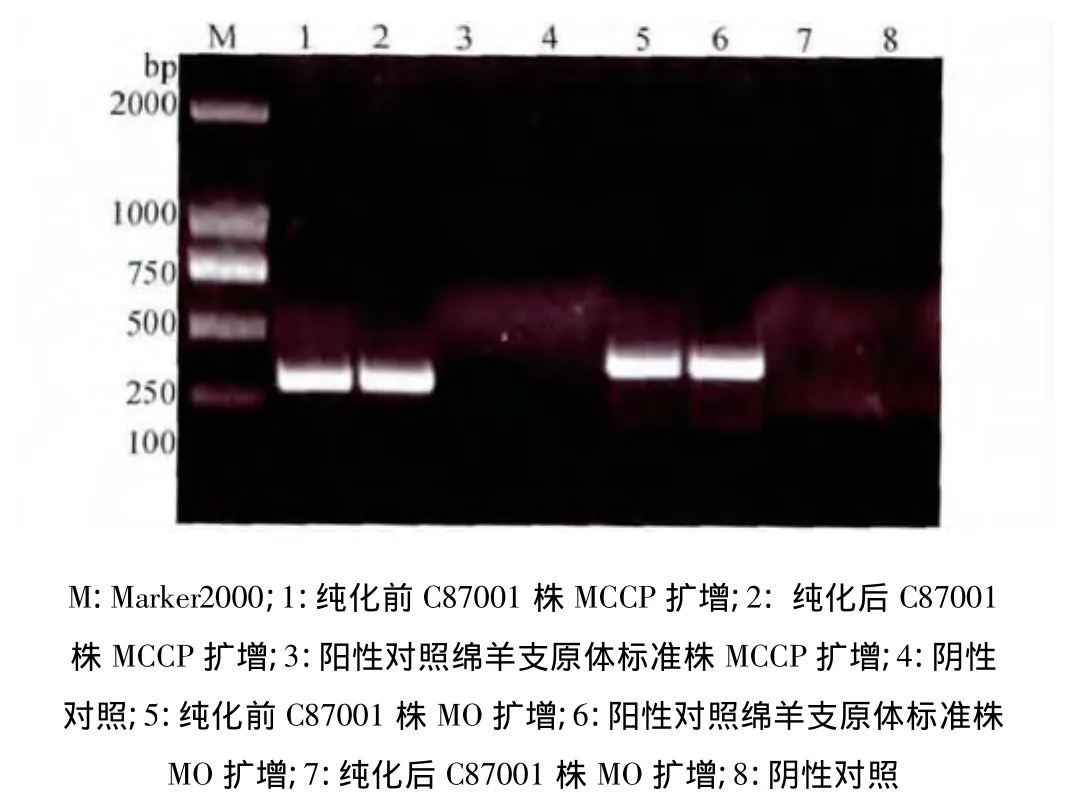
图5 纯化前后菌液PCR扩增结果
2.3 序列测定结果 PCR产物经英骏公司测序,测序结果与NCBI中的序列进行比对,所扩增的ArcD序列与山羊支原体山羊肺炎亚种支原体标准株F38的ArcD序列的同源性达到100%。
2.4 克隆株回归实验结果 气管注射10.0 mL/只C87001克隆纯化株F5代的山羊中有4/4在3~10 d体温升至40.5℃以上稽留热,兼有咳嗽、呼吸困难症状,剖检对照组山羊肺组织呈鲜红色(图6),剖检病山羊肺组织呈大理石样病变(图7)。
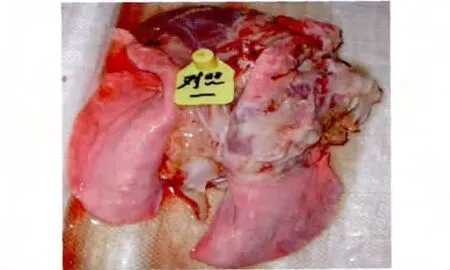
图6 对照组山羊肺组织
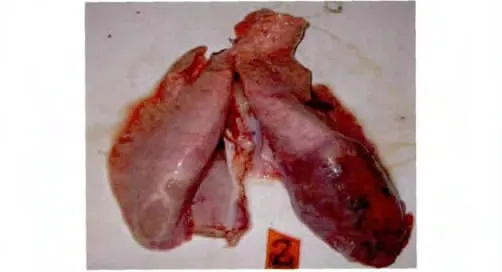
图7 剖检病山羊肺组织
2.5 克隆株形态和生化特性鉴定结果 克隆株经姬姆萨染色镜检,菌体呈球状、双球状、弧状等典型的多形态;具有代谢葡萄糖、不水解精氨酸、不分解尿素、膜斑试验阴性、对毛地黄皂苷敏感等特性。
2.6 克隆株培养特性鉴定结果 将克隆株接种支原体培养基,37℃培养5 d,呈轻度浑浊带乳光样纤细菌丝生长,无菌膜、沉淀或颗粒悬浮;克隆株接种支原体培养基培养,置密闭罐中,经37℃培养5 d,生长出细小圆形或椭圆形露滴状透明菌落,中央乳头状突起明显,呈“煎蛋”样。
2.7 克隆株纯粹检验结果 结果如表2所示。
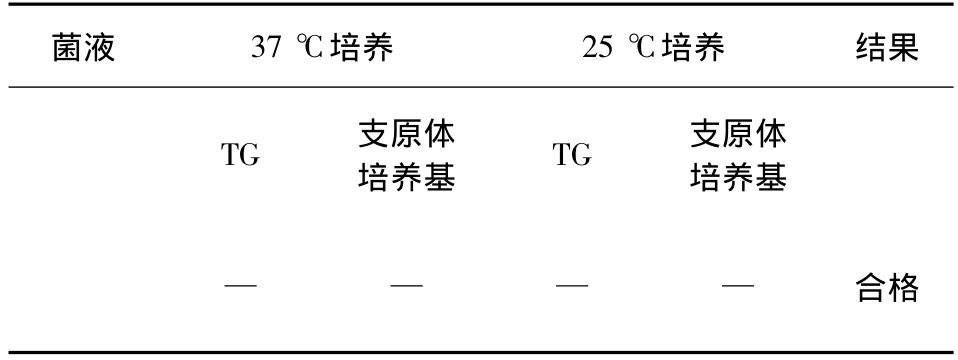
表2 克隆株菌液纯粹检验结果
2.8 克隆株免疫原性测定结果 免疫组山羊4/4保护;对照组山羊3/3发病死亡,剖检肺部有典型的山羊传染性胸膜肺组织病变。
3 讨论
在研制人工合成培养基山羊传染性胸膜肺炎灭活疫苗工作中,发现C87001株冻干肺组织传7代中低代次保护效果高于高代次菌种;用传至1~7代菌种制备灭活疫苗,攻毒后试验组发病率反而高于对照组。通过对菌种PCR检测,发现制苗用山羊传染性胸膜肺炎支原体C87001株被绵羊肺炎支原体污染,开启制苗用菌种后的1~3代培养物检出山羊支原体山羊肺炎亚种和绵羊肺炎支原体两种病原,在4~7代培养物中仅可以检出绵羊肺炎支原体,既而采用抗绵羊肺炎支原体血清代谢抑制试验、菌落克隆筛选方法对其进行纯化。纯化后制备灭活疫苗免疫山羊,攻毒保护为4/4(100%),对照组3/3发病,说明克隆株毒力未丢失,且免疫原性良好。
通过人工合成培养基培养的方法,生产的中试产品质量稳定、易保存、使用方便,同时通过对山羊的预防试验结果证实,按照该方法生产的疫苗安全;山羊传染性胸膜肺炎灭活疫苗免疫期可达12个月,达到或超过国内同类疫苗效果。生产工艺技术参数稳定,适合于GMP车间工厂化生产。既解决了困扰疫苗生产的效力不足问题,又避免了肺组织疫苗不适应GMP条件生产、易散毒等问题,降低了疫苗生产成本,提高了疫苗产量及效力,因此对该疫苗生产工艺的改进、质量的提高意义重大,对山羊养殖业预防和控制山羊传染性胸膜肺炎起到重要作用。
[1] Woubit S,Lorenzon S,Peyraud A,et al.A specific PCR for the identification of Mycoplasma capricolum subsp.capripneumoniae,the causative agent of contagious caprine pleuropneumonia(CCPP)[J].Veterinary microbiology,2004,104:125 -132.
[2] Besser T E,Cassirer E F,Potter K A,et al.Association of Mycoplasma ovipneumoniae infection with population-limiting respiratorydisease in free-ranging Rocky Mountain bighorn sheep(Ovis canadensis canadensis)[J].Journal of clinical microbiology,2008,46:423-430.
[3] 中华人民共和国国家质量监督检验检疫总局.SN/T2710-2012中华人民共和国出入境检验检疫行业标准[S].
[4] 吴移谋,叶元康.支原体学[M].北京:人民卫生出版社,2008:321.
[5] 张明月,刘晓松,常建华,等.羊肺炎支原体基因组DNA几种提取方法的比较[J].内蒙古农业大学学报,2012,33(3):9-12.
[6] 农业部兽用生物制品规程委员会.中华人民共和国兽用生物制品规程2000年版[S].
