OPN siRNA慢病毒载体的构建及其对大肠癌细胞增殖的抑制作用
2014-11-27邢译文范维宁周林林徐广贤
邢译文,白 静,范维宁,刘 鑫,周林林,徐广贤,2*
(宁夏医科大学 1.检验学院; 2.总医院 医学实验中心,宁夏 银川 750004)
OPN siRNA慢病毒载体的构建及其对大肠癌细胞增殖的抑制作用
邢译文1,白 静1,范维宁1,刘 鑫1,周林林1,徐广贤1,2*
(宁夏医科大学 1.检验学院; 2.总医院 医学实验中心,宁夏 银川 750004)
目的构建OPN-siRNA的慢病毒载体,探讨其对结肠癌SW480细胞增殖的调节作用。方法设计合成针对OPN的siRNA序列,退火形成双链DNA并克隆到pSicoR质粒后,包装重组慢病毒。应用Real-time PCR及Western blot检测病毒刺激SW480细胞后OPN的mRNA和蛋白的表达水平,应用MTT法检测慢病毒对SW480细胞增殖的调节作用。结果成功构建了携带OPN-siRNA的重组慢病毒。该重组慢病毒可使SW480细胞内OPN的mRNA和蛋白的表达降低,LV-siRNA-OPN慢病毒对SW480细胞增殖有明显的抑制作用(Plt;0.05)。结论成功构建的LV-siRNA-OPN慢病毒可以有效抑制SW480细胞内OPN的mRNA和蛋白表达, 并抑制SW480细胞的增殖。
OPN; siRNA;慢病毒;SW480细胞
骨桥蛋白(osteopontin,OPN)是一种具有多种功能的分泌型Ⅰ钙结合磷酸化糖蛋白,OPN分布广泛,并受多种因素的调控,能与多种物质结合,发挥不同的生物学作用。近年来有大量的研究表明,OPN可以参与肿瘤细胞的黏附、浸润和转移等过程,是一种与诸多肿瘤的发生、发展、浸润、转移相关的蛋白质[1]。其表达水平与肿瘤的恶性程度、预后和复发也具有密切的关系[2]。揭示OPN作为一个重要的肿瘤相关因子,具有重要的临床意义。RNA干扰技术(RNA interference,RNAi)是近年来被公认的研究基因功能最重要的技术之一,在肿瘤的靶向研究中显示了其强大的作用,RNA干扰技术能特异地抑制靶基因的转录,进而下调相应蛋白表达[3]。本研究利用RNA干扰技术,构建了能高效抑制OPN的慢病毒载体,侵染SW480细胞,细胞内OPN表达水平下降,并抑制SW480细胞增殖,为预防或治疗肿瘤的药物研究奠定实验基础。
1 材料与方法
1.1 材料
E.coliDH5α、pSicoR GFP载体、HEK-293细胞和SW480细胞(本实验室保存)。 pCMV-VSV-G和pCMV-dR8.91质粒(复旦大学医学院生化与分子生物学教研室惠赠)。质粒小提试剂盒、DNA凝胶回收试剂盒、无内毒素质粒大提试剂盒(天根生化科技有限公司);HpaⅠ、XhoⅠ和XbaⅠ限制性内切酶(Takara公司);T4 DNA连接酶和转染试剂(北京全式金公司); OPN抗体、β-actin抗体和抗鼠荧光二抗(Santa Cruz公司);OPNsiRNA序列由上海吉玛公司合成;DNA测序由上海生工生物工程技术服务有限公司完成。
1.2 方法
1.2.1 OPN-siRNA核苷酸的设计与合成: 设计针对OPN蛋白沉默位点的siRNA片段,同时设计Control siRNA序列,该序列为人类基因组中不存在的任何同源性的序列,茎环序列为5′-TTCAAGAGA-3′。人工合成一对寡核苷酸链,含有OPN-siRNA序列及其反向互补序列,并在上游5′端加入HpaⅠ酶切位点、在下游3′端加入XhoⅠ酶切位点,序列见(表1)。
1.2.2 OPN siRNA表达载体的构建与鉴定:取稀释好的正义链和反义链oligo溶液各5 μL加入0.5 mL小离心管中,再加入5 μL的10×Oligo退火缓冲液,35 μL的DNase/RNase-Free水,共50 μL;放入95 ℃水浴,5 min;反应结束后,室温放置30 min;4 ℃保存。退火后的短双链DNA两端带有HpaⅠ和XhoⅠ酶切位点(图1),将其插入pSicoR质粒中,按照1∶10的比例连接,反应条件为16 ℃,1 h;转化到E.coliDH5α中, 37 ℃ Amp抗性培养板上培养12 h;挑取单菌落,摇菌,提取质粒DNA,酶切鉴定并测序。取测序正确后的克隆,摇菌扩大培养,提取质粒DNA,用于后期的病毒包装。

表1 OPN-siRNA和control-siRNA序列Table 1 Suences of OPN-siRNA and control-siRNA
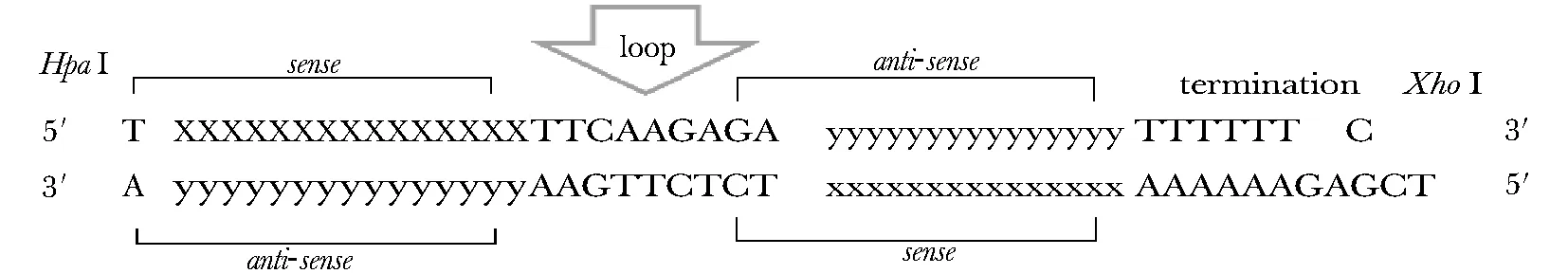
x.specific-sequence of siRNA-OPN molecule;y.specific-sequence of siRNA-OPN molecule of inverted complementary图1 退火后发夹状的siRNAFig 1 Annealed hairpin siRNA template insert
1.2.3 重组慢病毒OPN-siRNA的包装:用含有10%胎牛血清的DMEM培养基培养293细胞,37 ℃、5% CO2及100%饱和湿度的培养箱中培养。选择细胞汇合至70%~80%的处于增殖旺盛期的293细胞进行转染,转染前两个小时,将旧培养液倒掉,换成完全培养基。将构建好的重组质粒与pCMV-VSV-G和pCMV - dR8.91两个质粒共转染到HEK-293细胞中,4~6 h换新鲜培养基,24和48 h在荧光显微镜下观察细胞转染的效果,并收集病毒上清及细胞。应用TCID50法[公式:病毒滴度=10(X+0.8)(pfu/mL),x表示:从10-1到10-11依次稀释度下细胞病毒(cytopathic effect,CPE)阳性率孔数,单个孔阳性记为0.1。]计算病毒滴度。
1.2.4 Real-time PCR,Western blot 法检测慢病毒在SW480细胞中的抑制作用:用获得的两组病毒分别侵染SW480细胞,与感染后48 h收集细胞,并设计未处理的SW480细胞作为空白对照组,提取各组总RNA,反转录为cDNA,用特异性扩增OPN的引物(上游:GTGATAGCTTGGCTTATGG;下游:CTTTCCGTTGTTGTCCTG,188 bp),以β-actin(上游:CACTGTGCCCATCTACGA;下游:TGATGTCAC GCACGATTT,155 bp)作为内参进行Real-time PCR(PCR扩增参数:95 ℃ 3 min;95 ℃ 20 s,95 ℃ 20 s,72 ℃ 20 s,40个循环;65 ℃ 5 s,95 ℃),检测得到的数据根据2-△△Ct方法分析各组SW480细胞中OPN的mRNA表达水平。同时提取各组细胞的蛋白质,等量上样,SDS-PAGE电泳分离,半干转膜,脱脂奶粉封闭3 h后,加入一抗(OPN:1∶800;β-actin:1∶1 000),室温50r/min,过夜, TBST洗4次;加入二抗(山羊抗兔IgG:1∶5 000),室温50r/min,4 h, TBST洗后,ECL发光检测。实验重复3次。
1.2.5 MTT法检测慢病毒对SW480细胞增殖的影响:将SW480细胞铺于96孔板中,每孔100 μL,细胞密度为5 000~10 000个细胞/孔。次日更换无血清培养液,加入重组病毒,5% CO2,37 ℃孵育,分别于12、24、48和72 h后终止刺激。更换无血清培养液,每孔90 μL,加入10 μL MTT溶液(5 g/L),继续培养4 h,溶解结晶。检测490 nm的吸光度(A490)值。试验重复3次。
2 结果
2.1 重组质粒的构建和鉴定
重组质粒pSicoR-Control-siRNA和pSicoR-OPN-siRNA通过XhoⅠ和XbaⅠ酶切后得到的大片段约为7.3 kb,小片段分别为389 bp和393 bp,空pSicoR质粒小片段约为334 bp(图2),且测序结果与所设计的siRNA-OPN序列完全一致(图3)。
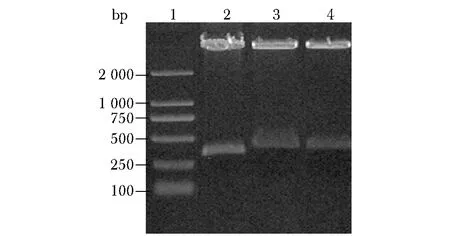
1.2 000 bp DNA marker; 2.the bland pSicoR group; 3.OPN-siRNA; 4.control siRNA图2 重组质粒酶切验证Fig 2 Enzymatic digestion of the recombinant plasmid

图3 插入DNA片段测序图Fig 3 Sequence of the inserts
2.2 重组慢病毒颗粒的制备及滴度的测定
成功包装慢病毒(图4);并测得病毒滴度:OPN与Control病毒的有效滴度分别为1×106pfu/mL和1×105pfu/mL。

(A/a)OPN lentivirus vector;(B/b)control lentivirus vector图4 重组质粒转染HEK293细胞Fig 4 Recombinant plasmid was transfected in HEK293 cells
2.3 慢病毒侵染SW480细胞mRNA与蛋白检测
OPN-siRNA病毒侵染后,SW480细胞mRNA(图5A)及蛋白(图5B)的表达较未侵染组与control-siRNA组明显降低,未侵染组较control-siRNA组无明显差异。
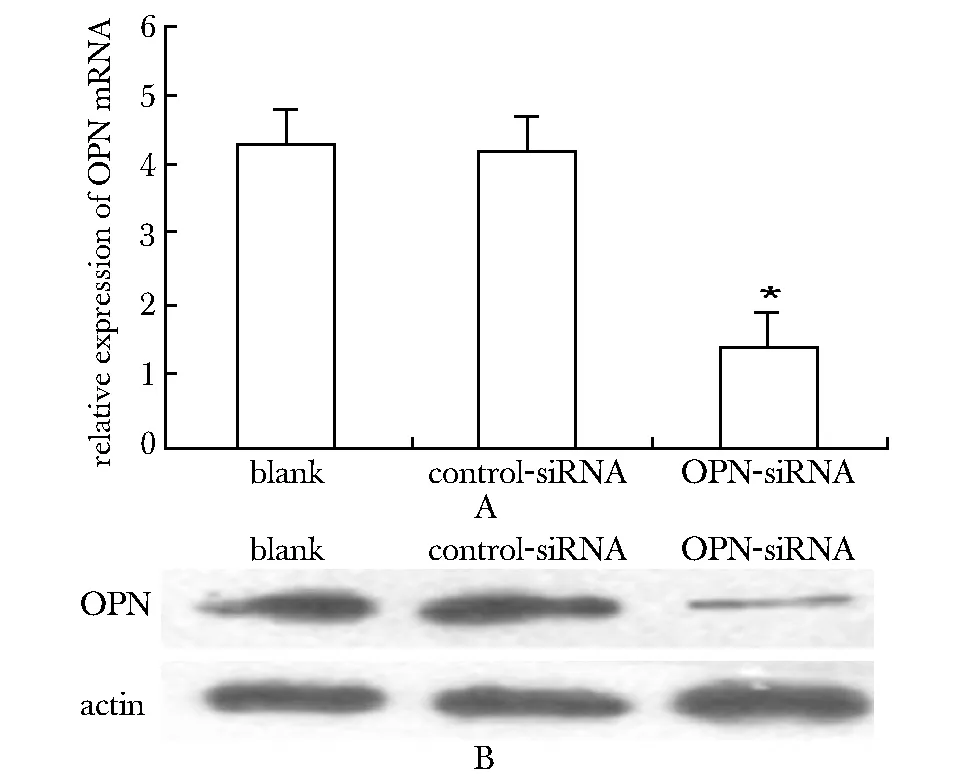
A.OPN mRNA expression in SW480 cells;*Plt;0.05 compared with control group and the blank group;B.OPN protein expression in SW480 cells图5 SW480细胞OPN mRNA与蛋白水平检测Fig 5 OPN mRNA and protein expression level of SW480 cells
2.4 慢病毒对SW480细胞增殖的影响
OPN-siRNA病毒侵染12 h后,SW480细胞较未侵染组与control-siRNA组的细胞增殖活性明显降低(Plt;0.05);而control-siRNA组与未侵染组的细胞增殖活性无明显改变(图6)。
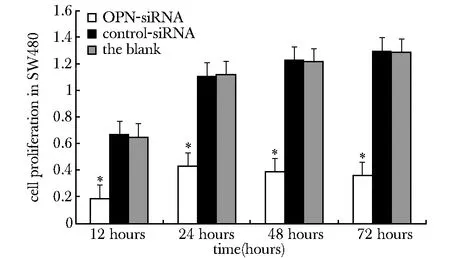
*Plt;0.05 compared with control group and the blank group图6 LV-siRNA-OPN 对SW480细胞增殖的影响Fig 6 LV-siRNA-OPN influenced the inhibition rate of SW480 cells
3 讨论
OPN是一种相对分子质量约44 kd的分泌型磷酸化糖蛋白,含有314个氨基酸残基[4]。OPN广泛分布于人体各种器官及组织,并与不同的受体结合,发挥不同的生物学功能,研究表明,OPN通过与整合素受体相结合,促进细胞的黏附和迁移, OPN还可以与CD44受体相结合,介导肿瘤细胞的进展和侵袭。OPN也可能通过上调其他基因表达来促进癌症的生长与转移,早期研究已将整合素蛋白和CD44视为治疗肿瘤的靶分子。阻断OPN与其受体结合,在体外实验中可以降低肿瘤的黏附、侵袭和侵润;在体内实验中可以降低肿瘤的进展和转移[5];抑制结直肠肿瘤的小鼠OPN的表达,可以提高小鼠的生存率[6]。因此,抑制OPN的表达有望成为新的治疗肿瘤的靶点来治疗对其具有依赖性的肿瘤。
RNA干扰是一种转录后水平的基因沉默机制,小分子双链mRNA能够特异性地降解与之互补靶基因的mRNA,沉默目的基因的表达,为基因功能的研究提供了一个重要的方法[7]。本研究利用RNA干扰技术,合成针对OPN的特异性的基因序列,克隆到慢病毒载体上,并成功包装重组慢病毒,将其作用于SW480细胞,发现所包装的病毒可有效地抑制OPN的表达,同时病毒能够抑制SW480细胞的增殖,与以往研究结果相符[8]。迄今为止,慢病毒已应用于多种恶性肿瘤的基础研究中,包括骨肉瘤、白血病、肝癌及鼻咽癌等,主要通过慢病毒将肿瘤的治疗基因安全地转移到靶细胞及组织内,来抑制肿瘤的生长,迁移和侵袭。将OPN RNA干扰技术与慢病毒载体相结合,并将成功包装的重组慢病毒直接导入瘤体部位,使其抑制作用更持久,扩大了载体感染细胞的范围,使其在细胞及组织内持续、高效的抑制OPN分子,降低其表达水平,并减少OPN与受体结合,从而达到治疗结肠癌的目的,为今后结肠癌的具体治疗研究提供了实验基础。
[1] Rittling SR, ChambersAF. Role of osteopontin in tumor progression[J]. Br JCancer, 2004, 90: 1877-1881.
[2] Shevde LA,Das S,Clark DW,etal. Osteopontin: an effector and an effect of tumor metastasis [J].Curr Mol Med,2010,10:71-81.
[3] 程晓刚,叶琬,张绍兰,等.SiRNA 沉默 JAB1 表达抑制肝癌细胞增殖[J].基础医学与临床,2012,11: 1288-1292.
[4] Hullinger TG, Pan Q,Viswanathan HL,etal. TGF beta and BMP-2 activation of the OPN promoter: roles of smad-and hox-binding elements [J].Exp Cell Res,2001, 262:69-74.
[5] Mi Z,Guo H,Russell MB,etal. RNA aptamer blockade of osteopontin inhibits growth and metastasis of MDA-MB231 breastcancer cells [J].Mol Ther,2009,17: 153-161.
[6] Zagani R,Hamzaoui N,Cacheux W,etal.Cyclooxygenase-2 inhibitors down-regulate osteopontin and Nr4A2-new therapeutic targets for colorectal cancers[J].Gastroenterology, 2009,137:1358-1366
[7] 刘月红,王科,孙笑笑,等.siRNA 干扰人 BMP9 重组腺病毒载体的构建及其促进乳腺癌 SK-BR-3 细胞增殖[J].基础医学与临床,2013,33:149-155.
[8] Likui W, Hong W, Shuwen Z,etal. The potential of osteopontin as a therapeutic target for human colorectal cancer[J].J Gastrointest Surg,2011,15:652-659.
Construction of osteopontin siRNA expression lentivirus vector and its inhibitory effect on the proliferation of SW480 cells
XING Yi-wen1,BAI Jing1,FAN Wei-ning1,LIU Xin1,ZHOU Lin-lin1,XU Guang-xian1,2*
(1.Institute of Laboratory Medicine; 2.Medical Experimental Center, General Hospital,Ningxia Medical University,Yinchuan 750004,China)
ObjectiveTo construct a recombinant lentivirus vector and explore its effects on colon cancer cell line SW480.MethodsThe siRNA interfering sequence targeting to osteopontin gene was designed and synthesized,then DNA segment was gained through annealing after chemosynthesis,and then was cloned to pSicoR vector, the recombinant lentivirus vector was constructed and used to challenge SW480 cells.The expression level of osteopontin mRNA and protein was detected by real time PCR and Western blot. The effects on SW480 cells proliferation were analyzed by MTT assay.ResultsThe restriction enzyme digestion,DNA sequencing and detection of GFP expression demonstrated that recombinant lentivirus vector was successfully constructed. Real time PCR and Western blot analysis confirmed that the expression of OPN mRNA and protein were inhibited.The MTT assay showed that the anti-proliferation effect of lentivirus vector of osteopontin-siRNA on SW480 cells were significant(Plt;0.05).ConclusionsThe recombinant lentivirus vector could effectively inhibit the expression of osteopontin in SW480 cells and depress the proliferation of SW480 cells.
osteopontin; siRNA; lentivirus; SW480 cell
2013-06-26
2013-10-29
宁夏高等学校科学技术研究项目(2011)
*通信作者(correspondingauthor): xuguangxianlab@aliyun.com
1001-6325(2014)03-0350-05
研究论文
R735
A
