RhoA/Rho激酶在2型糖尿病大鼠肝脏纤维化中的作用
2014-11-27房彩霞李贵芝王德峰
房彩霞,周 红*,李贵芝,王德峰,王 绵
(1.河北医科大学 第二医院 内分泌科, 河北 石家庄 050000;2.河北工程大学 附属医院 内分泌科, 河北 邯郸 056002)
RhoA/Rho激酶在2型糖尿病大鼠肝脏纤维化中的作用
房彩霞1,周 红1*,李贵芝1,王德峰2,王 绵1
(1.河北医科大学 第二医院 内分泌科, 河北 石家庄 050000;2.河北工程大学 附属医院 内分泌科, 河北 邯郸 056002)
目的阐明RhoA/Rho激酶在糖尿病大鼠肝纤维化中的作用。方法通过高脂饮食和小剂量链脲佐菌素(STZ,30 mg/kg)腹腔注射建立2型糖尿病大鼠模型。实验分为对照组、糖尿病组和法舒地尔干预组(法舒地尔10 mg/(kg·d),分两次腹腔注射)24周末。测定血糖、血脂、谷草转氨酶和谷丙转氨酶;Masson染色和羟脯氨酸测定评估肝胶原沉积;RT-PCR测定转化生长因子β1(TGF-β1)和结缔组织生长因子(CTGF)mRNA表达;免疫组化测定TGF-β1蛋白表达;Western blot测定肝组织肌球蛋白磷酸酯酶靶点亚单位1磷酸化(p-MYPT1)水平。结果与对照组比较,糖尿病组大鼠血糖、血脂和转氨酶显著增高,肝组织大量胶原沉积,p-MYPT1水平、TGF-β1与CTGF mRNA表达显著上调(Plt;0.01)。与糖尿病组比较,法舒地尔干预组大鼠转氨酶降低,肝胶原沉积明显减轻,p-MYPT1水平、TGF-β1与CTGF mRNA表达显著下降(Plt;0.01)。结论高血糖激活了肝组织RhoA/Rho激酶,通过调控 TGF-β1/CTGF表达,在糖尿病肝纤维化中起着重要作用。
糖尿病肝纤维化;Rho激酶;转化生长因子β1;结缔组织生长因子;法舒地尔
糖尿病能够引起多种慢性并发症,除了大血管和微血管病变,糖尿病肝脏损伤,尤其肝纤维化已日益受到学者们的关注。糖尿病引起的肝脏病变在早期主要表现为非酒精性脂肪肝(non-alcoholic fatty liver NAFLD),进一步发展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis NASH),肝纤维化,甚至进展为不可逆转的肝硬化[1]。糖尿病肝脏病变的分子机制还不十分明确,临床上除了对代谢的改善,尚未找到能够阻止肝病发生、发展的有效药物。Rho是小分子的鸟苷酸结合蛋白,Rho激酶(ROCK)是RhoA下游最主要的效应分子。近年的研究发现RhoA/ROCK信号通路的过度激活参与了多种组织结构的重塑[2-4],并且在糖尿病慢性并发症的发生、发展过程中起了重要作用[5]。研究也证实转化生长因子β1(transforming growth factor β1 TGF-β1)能够激活肝星状细胞并促进表达细胞外基质,在肝脏损伤中发挥着重要作用[6-7]。结缔组织生长因子(connective tissue growth factor CTGF) 是TGF-β1的下游效应器,TGF-β1的促组织纤维化作用可能是通过诱导CTGF的表达来实现的[8]。目前RhoA/ROCK通路与TGF-β1/CTGF通路的关系以及在糖尿病肝损伤中的作用国内外尚为鲜见。
本研究通过高脂饮食结合小剂量链脲佐菌素(streptozotocin STZ,30 mg/kg)腹腔注射建立2型糖尿病大鼠模型,探讨RhoA/ROCK在2型糖尿病肝纤维化中的作用,旨在为糖尿病肝脏病变的防治提供一个新的策略。
1 材料与方法
1.1 主要试剂
1.2 方法
1.2.1 动物及模型的建立:清洁级健康雌性SD大鼠[河北医科大学实验动物中心,许可证号:SCXK(冀)2012-1-003,动物质量合格证编号:1010399]42只,体质量约180~200 g,按清洁级大鼠要求饲养。建立2型糖尿病模型[2],10周末行高胰岛素正常血糖钳夹实验[9]。计算葡萄糖输注速率(glucose infusion rate, GIR),用以评价组织对胰岛素的敏感性。取血测空腹血糖(FBG)、胰岛素(FINS)、胆固醇(TC)和三酰甘油(TG);每周测体质量(BW)。将大鼠随机分为对照组(NC)、糖尿病组(DM)和法舒地尔干预组(FAS)(法舒地尔10 mg/kg·d, ip.),继续喂养14周。
1.2.2 血代谢指标和肝功能测定:第24周末,取血测定FBG、FINS、TC、TG、谷草转氨酶(AST)、谷丙转氨酶(ALT)和糖化血红蛋白(HbA1c)。根据公式计算胰岛素抵抗指数 HOMA-IR=FBG*FINS/22.5。
1.2.3 肝组织结构和胶原沉积:快速取出肝脏,4%多聚甲醛溶液固定用于HE染色观察肝组织结构,Masson染色观察胶原沉积。按照羟脯氨酸试剂盒说明书要求测定胶原含量。
1.2.4 免疫组化检测肝组织TGF-β1蛋白表达:一抗为兔抗大鼠TGF-β1抗体,1∶100稀释,二抗为HRP标记的山羊抗兔IgG,阴性对照一抗用PBS缓冲液。按试剂盒说明染色,中性树胶封片。细胞内有棕黄色颗粒弥漫分布者为阳性反应。
1.2.5 RT-PCR测定肝组织TGF-β1和CTGF mRNA表达:用Trizol提取肝脏组织总RNA,用Rotor-gene 3000荧光定量PCR仪测定A260/A280和RNA浓度。取3 μg RNA在M-MLV反转录酶作用下合成单链的cDNA; 取1 μL cDNA在PCR仪上进行扩增反应。TGF-β1上游引物序列:5′-CCAAGGAGACGGA ATACAGG-3′;下游引物序列:5′-GTGTTGGTTGTA GAGGGCAAG-3′;扩增产物长度为411 bp。CTGF上游引物序列:5′-GGCAGGGCCAACCACTGTGC-3′;下游引物序列:5′-CAGTGCACTTGCCTGGATGG-3′;扩增产物长度为167 bp。β-actin上游引物序列为5′-GAGACCTTCAACACCCAGCC-3′;下游引物序列为5′-GCGGGGCATCGGAACCGCTCA-3′;扩增产物全长374 bp。反应条件为:95 ℃预变性5 min;PCR扩增95 ℃变性40 s,55 ℃退火40 s,72 ℃延伸40 s,共进行30个循环;循环结束后72 ℃延伸5 min。取PCR产物10 μL进行1.5%琼脂糖凝胶电泳35 min,凝胶图像分析系统进行吸光度扫描。结果用目的基因与β-actin吸光度的比值表示。
1.2.6 Western blot测定磷酸化MYPT1(p-MYPT1):肝组织匀浆,提取蛋白、电泳和转膜。膜在室温下用5%脱脂奶粉封闭液封闭1.0~1.5 h,加入TBS稀释(1∶500)的兔抗大鼠磷酸化MYPT1(Thr696)多克隆抗体,并4 ℃孵育过夜,冲洗。加入荧光二抗(1∶10 000),孵育2~4 h。用TBST洗膜后放入双色红外荧光扫描成像系统上进行分析,磷酸化MYPT1水平以p-MYPT1与MYPT1的比值表示。
国家之强弱,视教育发达与否为标准。东西各国规定义务教育,凡学龄儿童已达就学之期,非有不得已事故不得废学,否则罪其父母,此教育之所以溥及而国乃以强盛。方今民国初定,百端待理,顾尤以普及教育为根本之要图。而谋普及教育,须从调查学龄儿童入手,某地应添设学校几所,某地应需经费若干,种种设施,皆恃是以为准则。而以学龄儿童之人数比较就学差数之多少,尤足觇各地文化之迟速。[13]
1.3 统计学分析
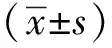
2 结果
2.1 血生化指标和BW
10周末,糖尿病大鼠FBG、FINS、TG、TC和BW显著高于对照组(Plt;0.01,Plt;0.05)(表1)。24周末,糖尿病组大鼠的FBG、FINS、TG、TC、HbA1c、ALT和AST较对照组大鼠显著升高(Plt;0.01),法舒地尔干预组大鼠的FBG、FINS、TG、TC和HbA1c与糖尿病组大鼠无差异,但ALT和AST较糖尿病组大鼠显著降低(Plt;0.01);糖尿病组大鼠的BW较对照组大鼠显著降低(Plt;0.05),与法舒地尔干预组大鼠无差异(表2,3)。
2.2 胰岛素敏感性指标
第10周末,血糖钳夹实验显示糖尿病大鼠GIR显著低于对照组大鼠(Plt;0.01)(表1)。第24周末,糖尿病和法舒地尔干预组大鼠的HOMA-IR显著高于对照组(Plt;0.01);糖尿病组和法舒地尔干预组大鼠HOMA-IR无差异性(Pgt;0.05)(表2)。
2.3 HE染色结果
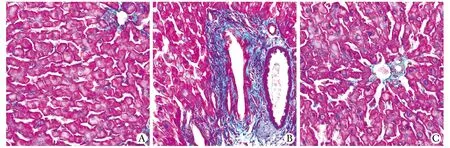
对照组大鼠肝小叶结构正常,肝细胞排列整齐,中央静脉周围呈放射状分布。肝细胞大小、形态正常,核结构清晰;糖尿病组大鼠肝小叶结构破坏,肝索排列紊乱,肝细胞明显肿胀,胞质内可见大小不等的球形脂滴,呈空泡变性,伴有炎性细胞的浸润,中央静脉周围可见纤维组织增生;法舒地尔干预组上述改变均较糖尿病组明显减轻(图 1)。
表1 10周末各组大鼠血生化、GIR和BW指标Table 1 Changes of biochemical index, GIR and BW at week 10(±s, n=6)
*Plt;0.05,**Plt;0.01 compared with control rats.
表2 24周末各组血生化指标Table 2 Changes of biochemical index at week 24(±s, n=8)
*Plt;0.01 compared with NC group.
2.4 Masson染色和胶原含量
对照组大鼠血管壁可见少量被染成绿色的胶原纤维;糖尿病组大鼠中央静脉周围可见大量胶原纤维,胶原面密度为0.083±0.109,显著高于对照组的0.051±0.008(Plt;0.01);法舒地尔干预组显著回降至0.059±0.009 (Plt;0.01) (图2)。糖尿病组大鼠肝脏胶原含量显著高于对照组大鼠(Plt;0.01);法舒地尔干预组大鼠的胶原含量显著回降(Plt;0.01)(表3)。
2.5 免疫组化染色结果
对照组大鼠肝组织中TGF-β1呈弱阳性表达。糖尿病组大鼠肝组织中TGF-β1广泛表达,呈棕黄色颗粒,阳性面积为0.231±0.104%,显著高于对照组0.169±0.100%(Plt;0.01);法舒地尔干预组显著回降至0.178±0.08%(Plt;0.01)(图3)。
2.6 基因表达结果
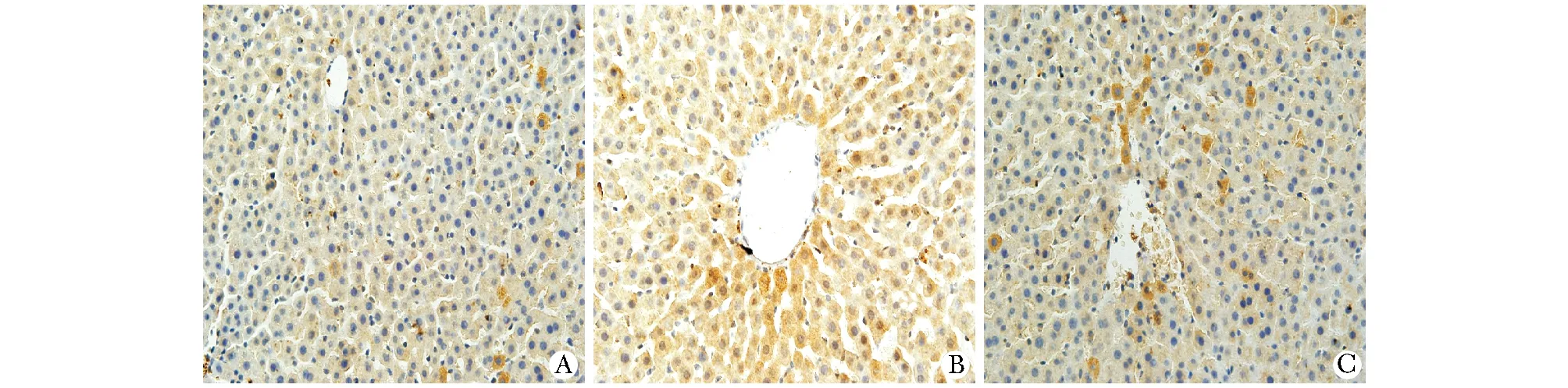
糖尿病组大鼠肝组织TGF-β1和CTGF mRNA表达较对照组显著上调(Plt;0.01);法舒地尔干预组大鼠肝组织TGF-β1和CTGF mRNA表达显著回降(Plt;0.01)(图4)。
2.7 蛋白表达结果
磷酸化MYPT1水平代表ROCK的活性。糖尿病组大鼠肝组织磷酸化MYPT1水平较对照组大鼠显著增加(Plt;0.01);法舒地尔干预组大鼠肝组织磷酸化MYPT1水平显著回降(Plt;0.01)(图5)。
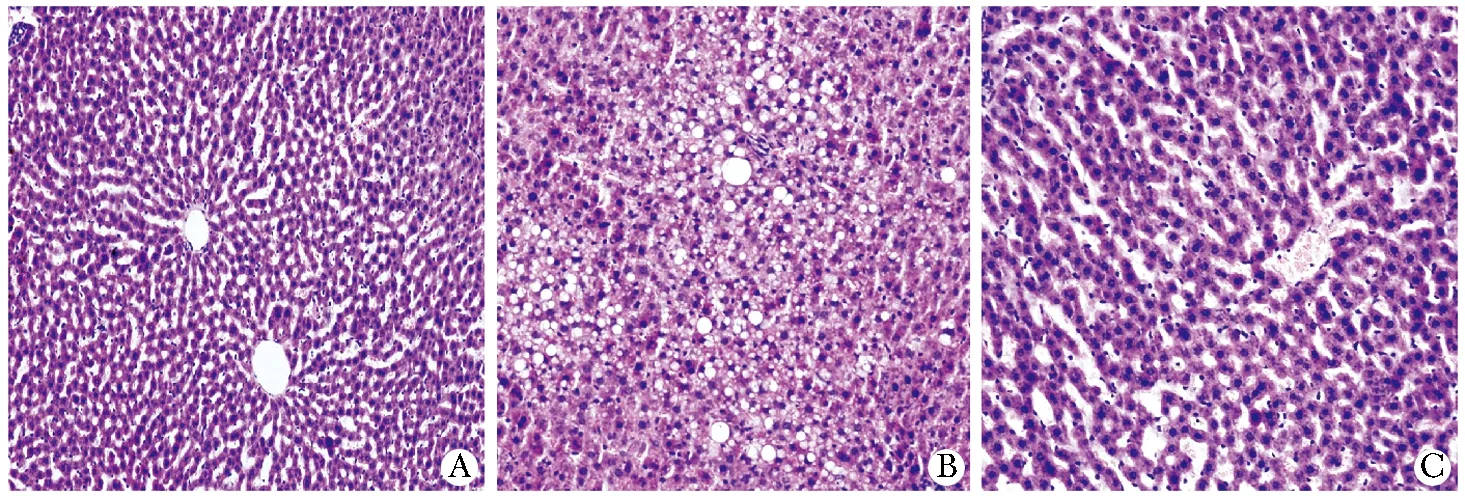
A.control rats; B.diabetic rats; C.fasudil-treated rats图1 肝组织HE染色特征Fig 1 The features of HE-staining in liver tissue of different groups (×200)
A.control rats; B.diabetic rats; C.fasudil-treated rats; Liver tissues from the diabetic rats show regions of fibrosis (blue) in the interstitium
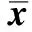
图2 肝组织Masson染色的结果Fig 2 The result of Masson-staining in liver tissue of different groups (×400)
*Plt;0.05,**Plt;0.01 compared with NC group;#Plt;0.01 compared with DM group.
A.control rats; B.diabetic rats; C.fasudil-treated rats; a brown color denotes positive staining图3 肝组织TGF-β1免疫化学染色结果Fig 3 Immunostaining for TGF-β1 in the liver tissues of different groups (×200)
A.tThe expression of TGF-β1 mRNA in liver tissues; B.the expression of CTGF mRNA in liver tissues;*Plt;0.01 compared with NC group;#Plt;0.01 compared with DM group
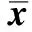
3 讨论
近年来动物实验和临床研究都证实糖尿病可以促进肝纤维化的发生,发展。在糖尿病患者中,终末期肝病的死亡率比心血管疾病高[10]。本研究发现24周末,糖尿病组大鼠的ALT、AST水平显著增高,肝细胞出现明显的脂肪变性及中央静脉周围大量胶原纤维沉积,且胶原含量显著增加,这些结果都证实糖尿病大鼠发生了肝纤维化,这与Paradis等人的研究结果相一致[11-13]。
Rho是小分子鸟苷酸结合蛋白,是Ras超家族成员之一,起着“分子开关”的作用。ROCK属于丝氨酸/苏氨酸蛋白激酶家族成员,是RhoA下游最主要的效应分子,通过促进肌动蛋白微丝骨架的聚合,调控着细胞收缩、黏附、迁移、形态改变以及增殖等多种生物学行为和功能,同时RhoA/ROCK通路位于多种信号分子的上游,调控着多种信号通路和基因表达[5]。有研究显示RhoA/ROCK在肝星形细胞增殖及胶原合成中起了重要作用[14]。TGF-β1是最重要的促纤维化生长因子,CTGF是TGF-β1的下游效应器,介导了TGF-β1促细胞增殖和细胞外基质合成的负面效应[15]。
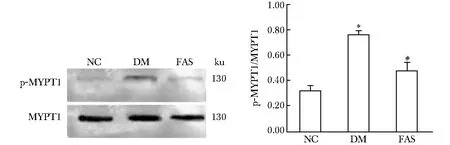
The phosphorylation of MYPT1 (p-MYPT1) and total MYPT1 were measured by western blot analyses; The extent of MYPT1 phosphorylation was quantified by p-MYPT1/MYPT1;*Plt;0.01 compared with NC;#Plt;0.01 compared with DM
本研究发现,糖尿病组大鼠的肝组织MYPT1磷酸化水平升高,ROCK活性增强,同时糖尿病组大鼠肝组织TGF-β1 mRNA和蛋白表达增加,CTGF mRNA表达上调。应用ROCK特异性抑制剂法舒地尔干预后,不仅抑制了ROCK的活性,也抑制了TGF-β1/CTGF的表达,改善了肝纤维化,肝功能亦恢复正常。这些结果提示高糖激活了肝组织上RhoA/ROCK通路,可能通过调控TGF-β1/CTGF的表达从而介导了肝纤维化的发生。有研究报道ROCK抑制剂Y-27632在CCl4介导的急性肝损伤能够降低血清转氨酶水平,通过抑制ROCK的活性起到了肝细胞的保护作用[16-17]。研究中还发现法舒地尔对糖尿病大鼠的血糖、血脂和胰岛素抵抗没有影响,这意味着法舒地尔的肝保护作用是不依赖于代谢改善的,这与糖尿病心肌纤维化和肾病的研究结果相一致[2, 4]。
本研究证实高糖激活了肝脏RhoA/ROCK通路,在2型糖尿病大鼠肝纤维化中起着重要作用,ROCK有可能成为糖尿病肝纤维化新的治疗靶点。法舒地尔是目前唯一能应用于临床的ROCK抑制剂[18],临床研究正在证实法舒地尔在心、脑血管疾病方面的获益,本研究为更深地理解和治疗糖尿病肝脏病变提供了一个理论依据。
[1] Ismail, MH. Nonalcoholic fatty liver disease and type 2 diabetes mellitus: the hidden epidemic [J]. Am J Med Sci, 2011,341:485-492.
[2] Zhou H, Li YJ, Wang M,etal. Involvement of RhoA/ROCK in myocardial fibrosis in a rat model of type 2 diabetes [J]. Acta Pharmacol Sin, 2011, 32: 999-1008.
[3] Murata T, Arii S, Nakamura T,etal. Inhibitory effect of Y-27632, a ROCK inhibitor, on progression of rat liver fibrosis in association with inactivation of hepatic stellate cells [J]. J Hepatol, 2001, 35: 474-481.
[4] Kolavennu V, Zeng L, Peng H,etal. Targeting of RhoA/ROCK signaling ameliorates progression of diabetic nephropathy independent of glucose control [J]. Diabetes, 2008, 57: 714-723.
[5] Zhou H, Li YJ. Long-term diabetic complications may be ameliorated by targeting Rho kinase [J]. Diabetes Metab Res Rev, 2011, 27: 318-330.
[6] Liu X, Hu H, Yin JQ. Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis [J]. Liver Int, 2006, 26: 8-22.
[7] Cutroneo KR. TGF-beta-induced fibrosis and SMAD signaling: oligo decoys as natural therapeutics for inhibition of tissue fibrosis and scarring [J]. Wound Repair Regen, 2007, 15: 54-60.
[8] Rachfal AW, Brigstock DR. Connective tissue growth factor (CTGF/CCN2) in hepatic fibrosis [J]. Hepatol Res, 2003, 26:1-9.
[9] Kim JK. Hyperinsulinemic-euglycemic clamp to assess insulin sensitivityinvivo[J]. Methods Mol Biol, 2009, 560: 221-238.
[10] Tolman KG, Fonseca V, Tan MH,etal. Narrative review: hepatobiliary disease in type 2 diabetes mellitus [J]. Ann Intern Med, 2004, 141: 946-956.
[11] Paradis V, Perlemuter G, Bonvoust F,etal. High glucose and hyperinsulinemia stimulate connective tissue growth factor expression: A potential mechanism involved in progression to fibrosis in nonalcoholic steatohepatitis [J]. Hepatology, 2001, 34: 738-744.
[12] Wang X, Li H, Fan Z,etal. Effect of zinc supplementation on type 2 diabetes parameters and liver metallothionein expressions in Wistar rats [J]. J Physiol Biochem, 2012, 68: 563-572.
[13] Qiang G, Zhang L, Yang X,etal. Effect of valsartan on the pathological progression of hepatic fibrosis in rats with type 2 diabetes [J]. Eur J Pharmacol, 2012, 685:156-164.
[14] Fukushima M, Nakamuta M, Kohjima M,etal. Fasudil hydrochloride hydrate, a Rho-kinase (ROCK) inhibitor, suppresses collagen production and enhances collagenase activity in hepatic stellate cells [J]. Liver Int, 2005, 25: 829-838.
[15] Hahn A, Heusinger-Ribeiro J, Lanz T,etal. Induction of connective tissue growth factor by activation of heptahelical receptors. Modulation by Rho proteins and the actin cytoskeleton [J]. J Biol Chem, 2000, 275: 37429-37435.
[16] Ikeda H, Kume Y, Tejima K,etal. Rho-kinase inhibitor prevents hepatocyte damage in acute liver injury induced by carbon tetrachloride in rats [J]. Am J Physiol Gastrointest Liver Physiol, 2007, 293: 911-917.
[17] Laschke MW, Dold S, Jeppsson B,etal. Rho-kinase inhibitor attenuates cholestasis-induced CXC chemokine formation, leukocyte recruitment and hepatocellular damage in the liver [J]. J Sur Res, 2010, 159: 666-673.
[18] Zhou H, Li YJ. Rho kinase inhibitors: potential treatments for diabetes and diabetic complications [J]. Curr Pharm Des, 2012, 18, 2964-2973.
The roles of RhoA/Rho kinase in hepatic fibrosis of rats with type 2 diabetes
FANG Cai-xia1, ZHOU Hong1*, LI Gui-zhi1, WANG De-feng2, WANG Mian1
(1.Dept. of Endocrinology, the Second Hospital of Hebei Medical University, Shijiazhuang 050000;2.Dept. of Endocrinology, Affiliated Hospital of Hebei University of Engineering, Handan 056002, China)
ObjectiveTo determine whether RhoA/Rho-kinase is involved in the pathogenesis of hepatic fibrosis in rats with type 2 diabetes.MethodsAn animal model of type 2 diabetes was developed by high fat diet combined with intraperitoneal injection of low-dose streptozotocin (STZ, 30 mg/kg, i.p.). At week 24, fasting blood glucose, triglycerides, cholesterol, aspartate aminotransferase and alanine aminotransferase were measured. The deposition of collagen in liver was evaluated by Masson staining and the hydroxyproline determination. The mRNA expressions of transforming growth factor (TGF-β1) and connective tissue growth factor (CTGF) in liver tissue were assessed by RT-PCR. Immunohistochemistry staining for TGF-β1 was performed. The phosphorylation of myosin phosphatase target subunit 1(p-MYPT1) was measured by Western blot analysis.ResultsCompared with control rats, blood glucose, blood fat, aminotransferase and the deposition of collagen in the liver in the untreated diabetic rats were significantly increased (Plt;0.01); p-MYPT1 and TGF-β1 protein, the mRNA expression of TGF-β1 and CTGF was significantly enhanced (Plt;0.01). Compared with untreated diabetic rats, treatment with fasudil signi-ficantly decreased aminotransferase, deposition of collagen, p-MYPT1, mRNA expression of TGF-β1 and CTGF(Plt;0.01).ConclusionsHyperglycemia can activate the RhoA/Rho-kinase which maybe regulates TGF-β1/CTGF expression in liver tissues. RhoA/Rho-kinase plays an importent role in the development of diabetic liver fibrosis.
diabetic liver fibrosis;Rho-kinase; transforming growth factor beta 1; connective tissue growth factor; fasudil
2013-06-05
2013-10-09
河北省卫生厅重大课题(20090007)
*通信作者(correspondingauthor): zhoubs2013@163.com
1001-6325(2014)03-0332-07
研究论文
R 364.3
A
