促红细胞生成素抑制AngⅡ诱导的大鼠心肌细胞肥大及其可能的信号通路
2014-11-27赵金红张新金李建美
赵金红,王 伟,张新金,李建美
(云南省第二人民医院 心内科, 云南 昆明 650021)
促红细胞生成素抑制AngⅡ诱导的大鼠心肌细胞肥大及其可能的信号通路
赵金红,王 伟,张新金*,李建美
(云南省第二人民医院 心内科, 云南 昆明 650021)
目的观察促红细胞生成素(EPO)对新生大鼠心肌细胞肥大中信号通路蛋白表达的影响。方法用血管紧张素Ⅱ(AngⅡ, 10-6mol/L)诱导心肌细胞肥大,分别以EPO(2×104U/L)或/和P38丝裂原活化蛋白激酶(MAPK)抑制剂SB203580(15 μmol/L)进行干预,检测心肌细胞表面积、蛋白合成、胚胎基因ANF及β-MHC表达,Real-time-Q-PCR检测转化生长因子β(TGF-β)1及P38MAPKmRNA表达;Western blot法检测TGF-β1、TGF-β激活性激酶1(TAK1)、phospho-TAK1、P38MAPK和phospho-P38MAPK蛋白的表达。结果EPO能有效抑制AngⅡ诱导的心肌细胞肥大(Plt;0.05),抑制TGF-β1、TAK1、phospho-TAK1、P38MAPK和phospho-P38MAPK表达(Plt;0.05);SB203580能增强EPO抑制心肌细胞肥大的作用。结论EPO能减轻AngⅡ诱导的心肌细胞肥大,其可能与TGF-β1-TAK1-P38 MAPK信号通路有关。
促红细胞生成素,心肌细胞肥大,TGF-β1,TAK1,P38MAPK
心肌细胞肥大是心脏重构的重要环节,成体心肌细胞在遭受病理刺激时通过各种信号途径介导心肌细胞发生肥大,即心肌细胞面积及蛋白合成增加,而心肌细胞数量并不相应增加,同时伴随心肌胚胎基因的激活[1-4]。促红细胞生成素(erythropoietin,EPO)已被众多研究证实具有心脏保护作用,它通过介导不同细胞内信号传导机制抑制心肌细胞肥大。本研究通过血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导心肌细胞肥大探讨转化生长因子β(transforming growth factor beta,TGF-β)1- TGF-β激活性激酶1(TGF-beta-activated kinase 1,TAK1)-P38丝裂原活化蛋白激酶(mitogen activated protein kinases, MAPK)信号通路在EPO抑制心肌肥大中的作用。
1 材料与方法
1.1 实验动物
1~3日龄SPF级SD鼠15只(昆明医科大学实验动物中心提供,许可证号:SCXKC滇2011- 0004),雌雄不限。
1.2 主要试剂
胎牛血清(Gibco公司),AngⅡ及EPO(Merck公司),Ⅱ型胶原蛋白酶、5-溴脱氧尿苷(5-BrdU)及SB203580(Sigma公司),[3H]-亮氨酸(北京原子高科公司),TGF-β1兔抗鼠多克隆抗体(Santa Crusz公司),TAK1、P38MAPK及其磷酸化兔抗鼠单克隆抗体(Epitomics公司),β-actin小鼠抗大鼠抗体(Abmart公司)。磷酸酶抑制剂(Roche公司),蛋白提取、BCA定量及Western blot试剂(北京碧云天公司),Gel DoxTMXR+凝胶成像系统(BIO-RAD公司);RNA提取及PCR试剂(大连宝生物公司),引物由上海生工生物公司合成,引物ANF序列为:上游5′-GGCTCCTTCTCCATCACCAA-3′,下游5′-GGGC TCCAATCCTGTCAATC-3′,片段长度415 bp;β-MHC序列:上游5′-CCTTCCTGCGAAAATCTGAG-3′,下游5′-GGTAGGCAGCTACCACTTGC-3′,片段长度387 bp;TGF-β1序列:上游5′-TGAGTGGCTGTCTTTTGACG-3′,下游5′-GTTTGGGACTGATCCCATTG-3′,片段长度149 bp;P38MAPK序列:上游5′-ATGACGAAATG ACCGGCTAC-3′,下游5′-ACAACGTTCTTCCGGTCA AC-3′,片段长度141 bp;GAPDH序列:上游5′-GAC AACTTTGGCATCGTGGA-3′,下游5′-ATGCAGGGAT GATGTTCTGG -3′,片段长度133 bp。
1.3 心肌细胞的分离培养
按文献[5]描述的方法加以改进培养乳鼠心肌细胞。0.1%胰蛋白酶及0.5 g/L Ⅱ型胶原蛋白酶联合消化分离心肌细胞[1]。在含20%胎牛血清的DMEM/F12(1∶1)培养液中加入100 μmol/L的5-BrdU以抑制非心肌细胞的增殖,差速贴壁1 h除去非心肌细胞后于37 ℃、5% CO2培养箱培养。
1.4 实验分组及药物干预
取原代培养7~8 d后同步化培养24 h的心肌细胞随机分为5组,空白对照组(control):心肌细胞培养;EPO组、AngⅡ组、AngⅡ+EPO组及AngⅡ+EPO+SB203580组分别加入EPO、AngⅡ、EPO及AngⅡ培养、EPO与SB203580及AngⅡ培养。EPO及SB203580需提前加入处理1 h后再按分组加入AngⅡ处理30 min/48 h 结束实验,各组加入EPO、AngⅡ及SB203580浓度分别为2×104U/L、10-6mol/L及15 μmol/L[1,6]。
1.5 心肌细胞面积的计算
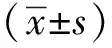
1.6[3H]-亮氨酸渗入测定心肌细胞蛋白含量
收集细胞前12 h按3.7×1010mBq/L培养基加入[3H]-亮氨酸,操作参照文献[2]的方法,实验重复4次,单位用count/min。
1.7PCR及实时荧光定量PCR(RT-Q-PCR)反应检测相关基因mRNA表达
药物处理48 h后按TrizolTM试剂盒说明书提取总RNA,测定RNA的浓度和纯度,取1 μg总RNA反转录合成cDNA,取2 μL cDNA为模板,分别以ANF、β-MHC和GAPDH的引物扩增,反应条件:94 ℃预变性3 min;94 ℃变性30 s;58 ℃退火;72 ℃延伸30 s;分别进行35个循环,72 ℃延伸5 min。取PCR产物进行2%琼脂糖凝胶电泳,Gel DoxTMXR+凝胶成像系统获取图像,以检测基因与内参吸光度比值作为产物的相对表达量,实验重复3次。取5 μL cDNA稀释4倍后,取2 μL做模板,分别以TGF-β1、P38MAPK和GAPDH的引物进行RT-PCT,条件为:95 ℃变性30 s;95 ℃变性10 s、60 ℃退火/延伸30 s,重复40个循环;65~95 ℃每增加0.5 ℃进行5 s读板,形成溶解曲线。所有样品均设置3个平行管,基因表达量以平行管平均循环阈值(cycle- threshold,Ct)表示。应用2-ΔΔCt法计算TGF-β1和P38MAPKmRNA的相对表达量,实验重复3遍。
1.8细胞总蛋白提取和Westernblot检测信号蛋白
药物处理30 min后提取含磷酸化蛋白的总蛋白(裂解细胞时加入磷酸酶抑制剂),处理48 h后提取总蛋白,按产品说明书用蛋白裂解液裂解30~60 min,4 ℃,12 000×g离心5 min获得总蛋白,BCA法测浓度后各取30 μg蛋白在聚丙烯酰胺凝胶上电泳,100 V恒压转膜60~90 min;5%脱脂奶粉/TBST室温封闭1~2 h,1∶500 TGF-β1、1∶3 000 TAK1、1∶3 000 P38MAPK、1∶1 000 phospho-P38MAPK和1∶2 500 phospho-TAK1抗体4 ℃孵育过夜,1∶5 000 β-actin室温孵育1.5 h,TBST洗膜10 min×3次,辣根酶标记的羊抗兔/鼠二抗室温孵育2 h,TBST洗膜10 min×2次,TBS洗膜5 min,ECL发光试剂盒显色,显影,Gel DoxTMXR+凝胶成像系统成像,取各条带透光体积(Int)与内参条带的比值作为目标蛋白相对表达量,实验重复4次。
1.9 统计学分析
2 结果
2.1 心肌细胞面积测定
AngⅡ可使心肌细胞面积增大(Plt;0.05),EPO和EPO+SB203580可使AngⅡ诱导细胞肥大的作用减弱(Plt;0.05),SB203580使EPO抑制AngⅡ诱导心肌细胞肥大的作用加强(Plt;0.05)(表1)。
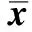
表1 心肌细胞面积Table 1 Surface area of cardiomyocytes(±s,n=4)
△Plt;0.05 compared with control;*Plt;0.05 compared with AngⅡ;#Plt;0.05 compared with AngⅡ+EPO.
2.2[3H]-亮氨酸渗入测定
用[3H]-亮氨渗入的方法可显示心肌细胞的蛋白含量(图1)。AngⅡ使心肌细胞内蛋白合成明显增加(Plt;0.05),EPO和EPO+SB203580可抑制AngⅡ诱导的蛋白合成增加(均为Plt;0.05),SB203580可加强EPO的抑制蛋白合成作用(Plt;0.05)。
2.3 ANF及β-MHC基因表达
AngⅡ可使心肌细胞ANF和β-MHCmRNA表达增加(Plt;0.05),EPO和EPO+SB203580可减弱AngⅡ诱导的ANF和β-MHCmRNA表达增加(Plt;0.05)(图2)。
2.4 Real-time-Q-PCR检测信号分子核酸表达
经AngⅡ诱导后的心肌细胞中P38MAPK和TGF-β1 mRNA表达量明显升高(均为Plt;0.05);EPO和EPO+SB203580处理后,P38MAPK和TGF-β1 mRNA表达量均较AngⅡ组明显下降(均为Plt;0.05)(表2)。

△Plt;0.05 compared with control; *Plt;0.05 compared with AngⅡ;#Plt;0.05 compared with AngⅡ+EPO.图1心肌细胞[3H]-leu渗入量的比较Fig 1 [3H]-leucine incorporation of cardiomyocytes

表2 TGF-β1及P38MAPK mRNA表达Table 2 TGF-β1 and P38MAPK mRNA expression
Quantitative analysis of TGF-β1 and P38MAPK mRNA expression by real-time PCR;the fold inductions over control are calculated as TGF-β1 and P38MAPK mRNA expression;*Plt;0.05 compared with control;#Plt;0.05 compared with AngⅡ.

A,B.representative electrophoretic image ofANFandβ-MHCmRNA expression respectively by PCR; M.marker; 1.control; 2.AngⅡ; 3.EPO; 4.AngⅡ+EPO; 5.AngⅡ+EPO+SB203580; C,D.representative quantitative analysis ofANFandβ-MHCmRNA expression respectively;△Plt;0.05 compared with control;*Plt;0.05 compared with AngⅡ
图2ANF和β-MHCmRNA的表达
Fig2ANFandβ-MHCmRNAexpression
2.5 Western bolt检测信号蛋白表达
AngⅡ可诱导TGF-β1、phospho-TAK1、phospho-P38MAPK、TAK1和P38MAPK蛋白表达明显增加(均为Plt;0.05);EPO可使该作用减弱(Plt;0.05)(图3)。
3 讨论
EPO通过介导各种信号传导通路减轻心肌细胞凋亡,促进新生血管形成,抑制炎性反应,减轻间质纤维化程度,从而减轻心肌缺血再灌注损伤,缩小左室收缩容积,改善心脏射血功能[7-8]。本文用AngⅡ诱导大鼠心肌细胞肥大,后者可被EPO抑制,包括抑制心肌细胞面积增加及蛋白合成,使胚胎基因ANF及β-MHCmRNA表达下调。
各种原因诱导的心肌肥厚均伴有TGF-β1表达上调,AngⅡ持续注入TGF-β1基因敲除后的大鼠不发生心肌肥厚[3]。TGF-β1诱导P27Kip1基因表达,后者通过调节细胞周期使DNA增殖停止,而RNA及胞质合成却增加,表现为细胞增殖受抑制但发生肥大[1]。TGF-β1在心肌肥大中发挥着关键作用,肥大刺激可通过介导TGF-β1使心肌细胞发生肥大[9-10],TGF-β1单独作用亦可使心肌细胞发生肥大[2]。EPO可抑制TGF-β1介导的心肌肥大作用[1]。
心肌梗死等刺激可诱导心肌细胞肥大,而RWJ(P38MAPK抑制剂)治疗可减轻体内外刺激诱导的心肌肥大[11]。P38αMAPK基因显性失活型糖尿病小鼠的左室心肌细胞肥大及ANP基因表达增加均较野生型糖尿病鼠明显减弱,表明P38介导心肌细胞肥大[12]。TAK1作为P38MAPK的上游信号分子,可通过MKK3和MKK6激活P38MAPK,还可通过TAK1结合蛋白使P38MAPK活化[13]。TGFβ1可通过MAPK激酶家族成员-TAK1改变心肌基因表达,导致心肌肥大,研究发现与TGF-β1-TAK1-P38MAPK途径激活相平行的心肌肥大标志基因β-MHC及ANP转录上调,因此TGF-β1可能通过TGF-β1-TAK1-MKK3/6-P38MAPK途径导致心肌肥大[14]。

A:electrophoretic image of TGF-β1,phospho-TAK1,TAK1,phospho-P38 MAPK and P38 MAPK protein expression by Western blot; C.control; A.AngⅡ; E.EPO; AE.AngⅡ+EPO; AES.AngⅡ+EPO+SB203580; B,C,D,E,F:representative quantitative analysis of TGF-β1,phospho-TAK1,TAK1,phospho-P38 MAPK and P38 MAPK protein expression respectively;△Plt;0.05 compared with control;*Plt;0.05 compared with AngⅡ
图3TGF-β1、phospho-TAK1、TAK1、phospho-P38MAPK及P38MAPK蛋白表达
Fig3TGF-β1,phospho-TAK1,TAK1,phospho-P38MAPKandP38MAPKproteinexpression
本实验中TGF-β1、P38MAPKmRNA,TGF-β1、phospho-TAK1、phospho-P38MAPK、TAK1和P38MAPK蛋白在AngⅡ诱导心肌细胞肥大时表达明显升高,而在EPO抑制心肌细胞肥大时则表达下降,提示TGF-β1-TAK1-P38MAPK信号通路激活参与心肌细胞肥大的发生[13],EPO可能通过抑制TGF-β1-TAK1-P38MAPK信号途径发挥抑制心肌肥大作用[14]。
[1] 文渊,马业新,洪李锋,等. 促红细胞生成素对培养的乳鼠心肌细胞肥大的影响[J].临床心血管病杂志,2009,25:219-222.
[2] Huang J, Qin GH, Hu CX,etal. Effects of transforming growth factor-beta1 and signal protein Smad3 on rat cardiomyocyte hypertrophy[J]. Chin Med J (Engl), 2004,117:1471-1475.
[3] Schultz JJ,Witt SA,Glascock BJ,etal.TGF-beta1 mediates the hypertrophic cardiomyocyte growth induced by ang iotensinⅡ.[J] Clin Invest, 2002, 109:787-796.
[4] 李琳,刘华,蔡红雁,等. 异丙肾上腺素活化蛋白激酶Cε诱导心肌细胞ERK磷酸化[J].基础医学与临床,2012,32:948-952.
[5] Simpson P, Savion S. Differentiation of rat myocytes in s ingle cell cultures with and without proliferating nonmyocardial cells. Cross-striations, ultrastructure, and chronotropic response to isoproterenol[J]. Circ Res, 1982, 50: 101-116.
[6] 王秋月,佟健华,杜娟,等. TGF-β1通过P38MAPK信号通路调控肾小球系膜细胞分泌纤维连接蛋白的研究[J].中国医科大学学报,2006,35:246-248.
[7] 郭晋村,黄卫斌,王挹青,等. 促红细胞生成素减轻大鼠心肌缺血再灌注损伤[J].基础医学与临床,2010,30:289-292.
[8] Wang W, Kagaya Y, Asaumi Y,etal. Protective effects of recombinant human erythropoietin against pressure overload-induced left ventricular remodeling and premature death in mice[J]. Tohoku J Exp Med, 2011,225:131-143.
[9] Pan Z, Zhao W, Zhang X,etal. Scutellarin alleviates interstitial fibrosis and cardiac dysfunction of infarct rats by inhibiting TGFβ1 expression and activation of P38-MAPK and ERK1/2[J].Br J Pharmacol,2011, 162: 688-700.
[10] Chen Z, Qian J, Ma J,etal. Glucocorticoid ameliorates early cardiac dysfunction after coronary microembolization and suppresses TGF-β1/Smad3 and CTGF expression[J]. Int J Cardiol.2012,22. doi:10.1016/j.ijcard.2012.06.002.
[11] Vahtola E, Louhelainen M, Forstén H,etal. Sirtuin1-p53, forkhead box O3a, P38 and postinfarct cardiac remodeling in the spontaneously diabetic Goto-Kakizaki rat[J]. Cardiovasc Diabetol,2010,9:5. doi: 10.1186/1475-2840-9-5.
[12] Thandavarayan RA, Watanabe K, Ma M,etal. Dominant-negative P38alpha mitogen-activated protein kinase prevents cardiac apoptosis and remodeling after streptozotocin-induced diabetes mellitus[J]. Am J Physiol Heart Circ Physiol,2009, 297: 911-919.
[13] Lu G, Kang YJ, Han J,etal. TAB-1 modulates intracellular localization of P38 MAP kinase and downstream signaling[J].J Biol Chem,2006,281:6087-6095.
[14] Matsumoto-Ida M, Takimoto Y, Aoyama T,etal. Activation of TGF-β1-TAK1-P38 MAPK pathway in spared cardiomyocytes is involved in left ventricular remodeling after myocardial infarction in rats[J]. Am J Physiol Heart Circ Physiol, 2006,290: 709-715.
Erythropoietin attenuates Cardiomyocytes hypertrophy induced by Ang Ⅱ and its possible signal pathway in rats
ZHAO Jin-hong, WANG Wei, ZHANG Xin-jin*, LI Jian-mei
(Dept. of Cardiology, the Second People’s Hospital of Yunnan, Kunming 650021,China)
ObjectiveTo observe the effects of erythropoietin (EPO) on angiotensinⅡ (AngⅡ) induced neonatal rat cardiomyocyte hypertrophy and its signal protein expression.MethodsCardiomyocytes were isolated from new-born Sprague-Dawley rats and were used to establish the model of hypertrophy by AngIIinvitro.The cells were treated with EPO or/and P38MAPK inhibitor SB203580. The cell surface area size, [3H]-leucine incorporation,mRNA expression of atrial natriuretic factor(ANF) and β-myosin heavy chain(β-MHC) of cardiomyocytes were employed as indicators to measure cardiomyocyte hypertrophy. The mRNA levels ofTGF-β1 andP38MAPKwere analyzed by real-time quantitative PCR. The protein expression of TGF-β1,TAK1,P38MAPK and phosphorylation of TAK1 and P38MAPK were analyzed by Western blot.ResultsEPO attenuated hypertrophy of cardiomyocytes. EPO significantly suppressed TGF-β1,TAK1,P38MAPK,phosphrylation of TAK1 and P38MAPK expression. SB203580 represses cardiac hypertrophy.ConclusionsEPO attenuates cardiomyocytes hypertrophy induced by Ang II,and it is potentially associated with TGF β1-TAK1-P38MAPK signaling pathway.
erythropoietin; cardiocyte hypertrophy; TGF-β1; TAK1; P38MAPK
2013-02-27
2013-06-25
国家自然科学基金(30960138);云南省自然科学基金(2009ZC176M)
*通信作者(correspondingauthor): zxjgry2004@sina.com
1001-6325(2014)03-0295-06
研究论文
R 542.2
A
