烟草SOC1基因的克隆和表达分析
2014-11-24石永春杨永银刘卫群
石永春,杨永银,刘卫群
河南农业大学生命科学学院,郑州文化路95号 450002
生物技术
烟草SOC1基因的克隆和表达分析
石永春,杨永银,刘卫群
河南农业大学生命科学学院,郑州文化路95号 450002
为明确SOC1基因在叶片中的生理作用,克隆到烟草中SOC1基因的完整开放阅读框,全长806 bp。农杆菌介导转化烟草后,获得26棵转基因植株,其中23棵鉴定为阳性植株,转化率为88.46%。与野生型烟草K326相比,获得的SOC1过表达烟株开花提前,株高增加,叶片宽大。半定量RT-PCR结果显示,SOC1过表达不影响叶片中Rubisco大亚基、蔗糖磷酸合成酶和蔗糖合成酶基因的表达水平,但提高了抗坏血酸氧化酶的表达水平;提高了碳酸酐酶活性、蔗糖含量和还原性抗坏血酸含量,并降低了抗坏血酸过氧化物酶活性。表明SOC1可能通过影响氧化还原状态而提高碳酸酐酶活性和光合速率。
烟草;SOC1;转基因;光合;抗坏血酸
MADS-box类转录因子参与植物生长发育的多个方面,尤其在生殖器官发育方面起到重要作用,但也参与营养生长的调控[1]。SUPPRESSOR OF OVEREXPRESSION OF CONSTANTS 1(SOC1) 基因属MADS-box转录因子家族,在植物的茎顶端分生组织和叶片中都有表达,和成花诱导关系密切[2]。拟南芥中存在四种成花途径——春化(低温)、赤霉素、自主途径和光周期途径,前三条途径都通过促进茎顶端分生组织中SOC1的表达[3]激活LEAFY(LFY)基因,最终导致顶端分生组织形成花原基[4]。SOC1基因还与植物对短期或长期低温响应的切换密切相关[5]。
值得注意的是,SOC1也被发现在叶片中表达[2]。已发现在拟南芥的叶片中,光周期通过促进CO基因的表达而增加韧皮部Flowering locus T(FT)蛋白的产量。FT蛋白经韧皮部转运至顶端分生组织中,与Flowering locus D(FD)蛋白一起激活SOC1的表达并促进成花[6]。但在叶片中,SOC1是否与光周期有关,是否参与叶片生长的调控,未见报道。
烟草是以叶片为收获对象的经济作物,明晰叶片发育的调控机理是获得优质烟叶的分子理论基础。因此,获得SOC1转基因烟草,不仅是研究SOC1基因在烟叶中生理功能的必要材料,还为研究SOC1是否影响烟叶发育和品质的分子机理做一铺垫。本研究对烟草中的SOC1基因进行克隆和转化,并对SOC1在叶片中的生理作用做一初步探讨。
1 材料与方法
1.1 材料
烟草(Nicotiana tabacum cv.K326)种子放在衬有湿润滤纸的平皿里萌发,而后放在25/16 ℃ day/night的培养间中,每天给予16 h的250 µM m-2·s-1光照。相对湿度为65%~75%。10 d后,小苗被转入单独的营养钵中培养至8叶期,并在上午9点的光照时间采收检测。
菌种Escherichia coli DH5α从大连宝生物公司购得,农杆菌GV3101和真核表达载体pROK2由本实验室保存提供。DNA凝胶回收试剂盒购自Axygen公 司,Taq酶、RNase抑 制 剂、pMD18-T载 体、T4DNA连接酶和限制性内切酶等均购自大连宝生物公司。引物合成和DNA测序由华大基因科技股份有限公司完成。
1.2 方法
1.2.1 NtSOC1的克隆和表达载体的构建 根据GenBank上NtSOC1序列(GB:431907)设计引物(F:5‘-CTATATTTCCTCATACCTGCAACC-3’;R:5‘-ACACATCCCAGTACAAATCATCTC-3’),RTPCR克隆序列,连接pMD18-T载体后转化大肠杆菌DH5α。测序无误后,连接真核表达载体pROK2(载体构建如下),转化农杆菌GV3101。
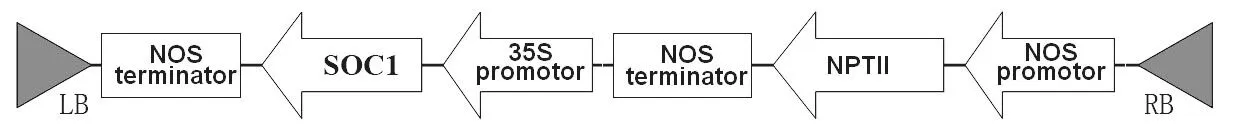
1.2.2 农杆菌介导的转化 农杆菌GV3101(pROK2-SOC1)在添加利福平50 mg/L、卡那霉素50 mg/L的YEB液体培养基中常规活化,培养至OD 约为0.6~0.8。将烟草无菌苗叶片的边缘和叶脉剪去,切成1 cm×2cm大小,在准备好的农杆菌菌液中浸泡5 min。用无菌滤纸吸干植物材料表面的菌液,转入MS固体培养基,叶面向下于28℃下暗培养,转化空载体作为对照。3 d后将叶片转到附加20 mg/L 利福平、300 mg/L头孢霉素的MS分化培养基上,进行光照培养,每3周继代培养1次。约1~2月后,将约2 cm高的幼苗转到1/2 MS生根培养基上生根。待根系发育良好后,移栽到土壤中。
1.2.3 半定量RT-PCR 根据GenBank公布的烟草(Nicotiana tabacum)SS(AB055497)、SPSC(DQ213014)、DHAR(AY074787)、Rubisco(U35620)、SOC1(431907)、AO(D43624.1)和Actin(AB158612)的mRNA序列,设计引物用于RT-PCR扩增。RNA的提取参照Trizol试剂盒(Invitrogen)的说明书进行,反转录参考试剂盒(Promega)实验步骤进行。PCR扩增后,经1 %琼脂糖凝胶电泳鉴定目的条带。
1.2.4 酶活性检测 碳酸酐酶(Carbonic Anhydrase,CA)活性测定按照Hatch[7]的方法进行。抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性检测参考Vanacker[8]的方法进行检测。
1.2.5 物质含量检测 蔗糖含量检测按照蔗糖检测试剂盒(Sigma)的说明书进行。叶绿素含量检测按照Moran[9]的方法进行。抗坏血酸按照Takahama[10]的方法进行检测。
2 结果
2.1 NtSOC1基因的克隆
按照烟草中SOC1的已知序列在ORF框两侧设计引物,以烟草叶片cDNA为模板,RT-PCR获得长为806 bp的清晰目标序列(图1A),切胶回收后连接T载体,转化大肠杆菌DH5α,挑白斑扩繁过夜后用菌液PCR的方法进行初筛(图1B),挑选一个阳性克隆送出测序。
将测序结果(NSC)与目标序列(SOC1)比对后发现,二者之间仅有一个碱基的差异(图2A)。预测所获片段的氨基酸序列并与NtSOC1的氨基酸序列进行比对,发现二者序列完全一致(图2B)。从而认为克隆到了NtSOC1的完整ORF序列。
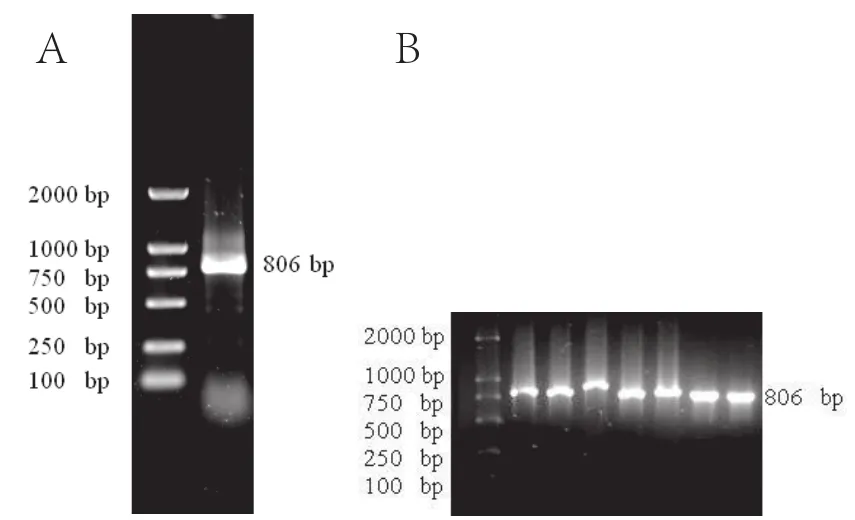
图1 PCR克隆和菌液PCRFig.1 Result of RT-PCR and PCR cloning

图2 测序结果(NSC)与NtSOC1的核酸及氨基酸序列比对Fig.2 Sequence alignment between sequencing result (NSC)and NtSOC1 of nuclear acid and amino acid sequences
2.2 NtSOC1的表达载体的构建和转化
将克隆引物加酶切位点后重新PCR,回收片段并酶切后连接真核表达载体pRoK2,转化大肠杆菌DH5α。菌液PCR初筛后挑选阳性克隆提取质粒,BamHI和Kpn I双酶切验证(图3),证明含有克隆序列的真核表达载体构建正确。提取重组质粒转化农杆菌GV3101。
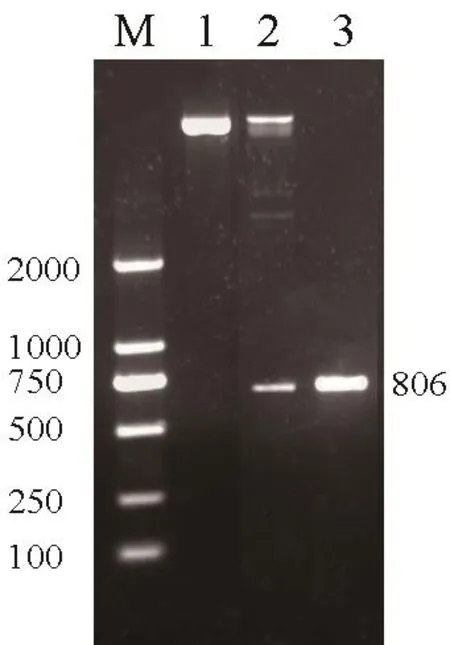
图3 构建载体的酶切验证Fig.3 Identification of constructed vector digested with enzymes
采用农杆菌介导的叶盘转化法,将重组质粒pRoK2-SOC1转化烟草,诱导成苗(图4)。PCR检测表明,在获得的26棵转基因材料中,有23棵扩增到了35S启动子的序列和SOC1的序列,转化率为88.46 %。形态学观察发现,SOC1过表达导致烟草株高增加,叶片宽大,开花提前。

图4 获得的转基因烟苗Fig.4 Transgenic tobacco seedlings
2.3 SOC1过表达影响叶片碳代谢和氧化还原状态
为明确过表达SOC1造成烟株形态学改变的原因,及SOC1在叶片中的作用,初步调查了野生型烟草K326和SOC1过表达植株叶片中光合作用和糖代谢相关基因的表达水平。发现SOC1过表达不影响Rubisco大亚基、蔗糖磷酸合成酶(sucrose phosphate synthetase,SPSC)和蔗糖合成酶(sucrose synthetase,SS)的表达水平,但提高了抗坏血酸氧化酶(ascorbate oxidase,AO)的表达水平(图5)。
进一步的检测结果表明,SOC1过表达对叶片中的叶绿素a、叶绿素b和类胡萝卜素浓度影响不大(图6A),但光合速率(图6B)、蔗糖含量(图6C)和碳酸酐酶活性(图6D)增加。意味着SOC1过表达促进了叶片中CO2的固定和蔗糖的合成。
AO定位于细胞壁,催化抗坏血酸(ascorbic acid,AsA)氧化生成单脱氢抗坏血酸,而后自发歧化生成脱氢抗坏血酸(dehydroascorbate,DHA)[11]。AO表达水平的升高意味着细胞内外氧化还原状态可能被改变,为此,检测了叶片中的抗坏血酸含量和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)的活性。发现与野生型烟草相比,SOC1过表达增加了叶片中的AsA含量,降低了DHA含量(图6E);并降低了APX活性(图6F);表明SOC1过表达导致叶片抗坏血酸库趋于还原态。
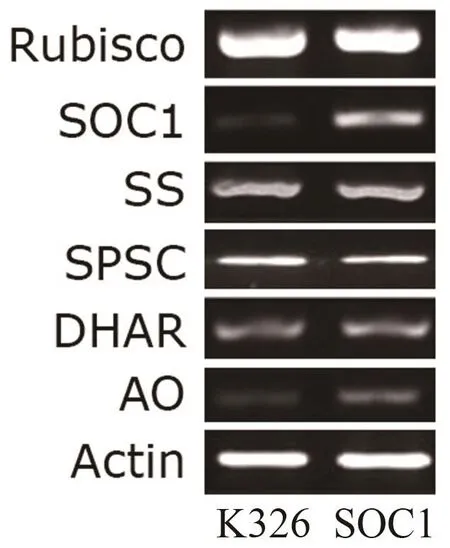
图5 野生型烟草(K326)与SOC1过表达植株(SOC1)叶片中基因表达的差异Fig.5 Different gene expression levels in leaves of wild type(K326) and SOC1 over-expression tobacco plants (SOC1)
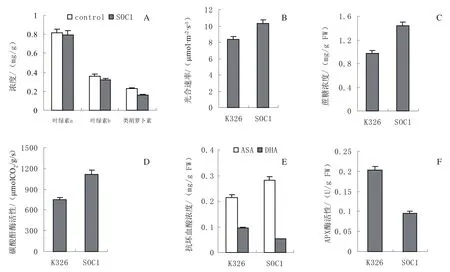
图6 野生型烟草(K326)与SOC1过表达植株(SOC1)叶片中光合差异Fig.6 Photosynthetic difference between wild wild type (K326) and SOC1 over-expression tobacco leaves (SOC1)
3 结论与讨论
MADS-box类转录因子主要参与植物生殖器官的发育调控,近年来,该类转录因子在营养器官生长调控方面的作用正逐渐受到关注。将克隆的NtSOC1构建真核表达载体,由农杆菌介导转化烟草后发现,过表达SOC1导致烟草开花提前,与Smykal等[2]获得的结果一致。同时导致株高增加,叶片增大。为明确SOC1过表达引起形态学变化的原因,调查了转基因和野生型烟草叶片中光合作用差异。光合作用的关键酶是负责碳固定的核酮糖-1,5-二磷酸羧化酶(Rubisco)[12]。在C3 植物中,Rubisco 活性升高提高了叶片对可溶性CO2的需求,从而影响碳酸酐酶活性。碳酸酐酶(carbonic anhydrase,CA)催化CO2+H2O↔HCO3-+H+的可逆水合反应,能提高叶片中CO2固定效率[13]。光合作用形成的葡萄糖在蔗糖磷酸合成酶(SPS)的催化下形成蔗糖,经由韧皮部装载运往库组织。半定量RT-PCR结果显示,叶片中过表达SOC1不影响Rubisco大亚基的表达水平,也不影响负责合成蔗糖的蔗糖磷酸合成酶(SPSC)和负责降解蔗糖的蔗糖合成酶(SS)的表达水平(图5)。但提高了叶片中的光合速率、碳酸酐酶活性和蔗糖含量(图6)。表明过表达SOC1提高了叶片中的光合作用和蔗糖含量,可能与碳酸酐酶的活性增加密切相关。
碳酸酐酶的活性受细胞内氧化还原状态的调控[14],故而检测了叶片中抗坏血酸相关酶的表达水平或活性变化。发现生型烟草K326相比,过表达SOC1提高了叶片中AO的表达水平,降低了APX活性,并使叶片中的还原型抗坏血酸(AsA)浓度增加,氧化性抗坏血酸(DHA)浓度降低(图6)。AO定位于细胞壁,催化抗坏血酸与氧反应生成单脱氢抗坏血酸[15],APX以抗坏血酸为氢供体,清除H2O2。叶片中总抗坏血酸含量的增加和APX活性的降低,意味着过表达SOC1影响了叶片中抗坏血酸库的氧化还原状态,使之趋于还原态。从而可能提高光合作用,促进叶片生长。
[1]Adamczyk B J,Fernandez D E.MIKC* MADS domain heterodimers are required for pollen maturation and tube growth in Arabidopsis [J].Plant Physiol,2009,149: 1713-1723.
[2]Smykal P,Gennen J,De Bodt S,et al.Flowering of strict photoperiodic Nicotiana varieties in non-inductive conditions by transgenic approaches [J].Plant Mol Biol,2007,65:233-242.
[3]Blazquez M A,Weigel D.Integration of floral inductive signals in Arabidopsis [J].Nature,2000,404:889-892.
[4]Lee J,Lee I.Regulation and function of SOC1,a flowering pathway integrator [J].J Exp Bot,2010,61(9): 2247-2254.
[5]Seo E,Lee H,Jeon J,et al.Crosstalk between cold response and flowering in Arabidopsis is mediated through the flowering-time gene SOC1 and its upstream negative regulator FLC [J].Plant Cell,2009,21: 3185-3197.
[6]Searle I,He Y H,Turck F,et al.The transcription factor FLC confers a flowering response to vernalization by repressing meristem competence and systemic signalling in Arabidopsis [J].Genes Dev,2006,20,898-912.
[7]Hatch M D,Burnell J N.Carbonic anhydrase activity in leaves and its role in the first step of C4 photosynthesis [J].Plant Physiol,1990,93:825-828.
[8]Vanacker H,Carver T L W,Foyer C H.Pathogen-induced changes in the antioxidant status of the apoplast in barley leaves [J].Plant Physiol,1998,117: 1103-1114.
[9]Moran R,Porath D.Chlorophyll determination in intact tissues using N,N-Dimethylformamide [J].Plant Physiol,1980,65: 478-479.
[10]Takahama U,Oniki T.Regulation of peroxidase-dependent oxidation of phenolics in the apoplast of spinach leaves by ascorbate [J].Plant Cell Physiol,1992,33: 379-387.
[11]Sanmartin M,Drogoudi PD,Lyons T,et al.Over-expression of ascorbate oxidase in the apoplast of transgenic tobacco results in altered ascorbate and glutathione redox states and increased sensitivity to ozone [J].Planta,2003,216: 918-928.
[12]Portis A R Jr.Regulation of Ribulose 1,5-Bisphosphate Carboxylase/Oxygenase Activity [J].Ann Rev Plant Physiol Mol Bio,1992,43: 415-437.
[13]Hewett E D,Tashian R E.Functional diversity,conservation and convergence in the evolution of the α-,β-,and γ-carbonic anhydrase gene families [J].Mol Phylogenet Evol,1996,5:50-77.
[14]Kikutani S,Tanaka R,Yamazaki Y,et al.Redox regulation of carbonic anhydrases via thioredoxin in chloroplast of the marine diatom Phaeodactylum tricornutum [J].J Biol Chem,2012,287(24):20689-20700.
[15]De Tullio M C,Samantha Ciraci,Rosalia Liso,et al.Ascorbic acid oxidase is dynamically regulated by light and oxygen.A tool for oxygen management in plants [J].J Plant Physiol,2007,164: 39-46.
Cloning and expression of SOC1 gene in tobacco
SHI Yongchun,YANG Yongyin,LIU Weiqun
College of Life Science,Henan Agricultural University,Zhengzhou 450002,China
Open reading frame of SUPPRESSOR OF OVEREXPRESSION OF CONSTANTS 1 (SOC1) gene in tobacco was cloned with full length of 806 bp to investigate its physiological function in tobacco.Agrobacterium-mediated leaf-disk transformations were used to create 26 SOC1 transgenic tobacco plants.Among which 23 were identified as positive plants with transformation rate of 88.46%.Compared with tobacco variety K326,SOC1 over-expression plants had early floral time,higher plant heights and wider and longer leaves.Semi-quantitative RT-PCR results showed that over-expression of SOC1 did not affect expression levels of Rubisco large subunit,sucrose phosphate synthetase and sucrose synthetase in leaves,but increased the level of ascorbare oxidase.It also increased carbonic anhydrase activity,concentrations of sucrose and ascorbic acid,and reduced ascorbate peroxidase activities.These results suggested that SOC1 increase carbonic anhydrase activity and photosynthesis by changing ascorbate redox state.
tobacco; SOC1; transgene; photosynthetic; ascorbic acid
10.3969/j.issn.1004-5708.2014.02.017
Q78;S572.01 文献标志码: A 文章编号:1004-5708(2014)02-0099-05
河南省烟草公司科技项目(HYKJ201005)
石永春(1978—),副教授,主要从事烟草生理生化研究,Email:shiyongchun369@126.com
刘卫群(1956—),博士,教授,主要从事烟草生理生化研究,Email:liuweiqun2004@126.com
2013-04-22
