管腔类手术器械清洗质量控制方法的改进及效果观察
2014-09-27魏静蓉任晓梅张琦霞第三军医大学西南医院消毒供应中心重庆400038
周 雪,魏静蓉,任晓梅,张琦霞 (第三军医大学西南医院消毒供应中心,重庆 400038)
管腔类手术器械广泛应用于微创手术,在手术中与患者的血液、脓液、分泌物和绒毛组织接触频繁,许多经血液、体液传播的病原微生物极易隐藏和粘附在管腔内壁,如清洗不及时和不彻底,则容易引起患者发生交叉感染。但是,管腔类手术器械通常都具有精密度高、结构复杂和管腔内径细长的特点,常规的手术器械清洗方法难以将管腔内残留的污染物彻底去除。因此,管腔类手术器械术后的清洗成为医院护理人员操作的难点,也是医院感染控制部门监督管理的重点[1]。为了提高管腔类手术器械的清洗质量,我们在2012年12月实施了400例对比清洗试验,并通过实验结果及时改进管腔类手术器械的清洗及效果监测方法,取得了较好的效果,现报告如下。
1 材料与方法
1.1 材料
试验样本器械:以我院手术使用后的人流宫腔刮吸头和颅脑侧孔穿刺吸引头为试验样本器械,器械管腔内径为3~5 mm;将试验器械分成对照组和试验组,分成20次试验,每次试验时各抽取污染程度相近的试验器械10件次,2组试验各抽取200件次试验器械。器械清洗及效果监测设施:全自动喷淋清洗器(瑞典洁定)、超声清洗器(重庆亚宏)、管腔清洗喷枪、8倍带光源放大镜和ATP器械清洁质量生物荧光测试仪等。清洗及清洗质量检测耗材:全效型多酶清洗剂(美国鲁沃夫)、软化水、纯化水、管腔清洗小毛刷、一次性注射器和95%乙醇等。清洗防护用品:口罩、面罩、防水衣、防水鞋和手套等。
1.2 方法
1.2.1 对照组清洗方法 依据卫生部《医院消毒供应中心管理规范》第二部分(2009年版)的有关规定和管腔类器械的常规清洗方法,将对照组的试验器械按以下步骤实施清洗操作:①在流动水下冲洗管腔表面及内腔大部污物,并使用管腔清洗喷枪冲洗管腔内部;②将冲洗后的器械置于多酶清洗液(稀释比例1∶270)中浸泡5 min,管腔内用注射器灌注多酶清洗液,然后在液面下使用小毛刷反复刷洗(试验器械管腔较小,多数小毛刷仅能刷洗器械表面,不能伸入管腔内刷洗);③用流动软化水冲洗器械表面及管腔;④将器械放入盛有多酶清洗液(稀释比例1∶270)的超声清洗器中超声震荡清洗3~5 min;⑤在流动软化水和纯化水中对器械进行漂洗,并结合管腔清洗喷枪冲洗管腔内壁;⑥用洁净压缩空气吹干器械表面及管腔,最后进行清洗质量检测。
1.2.2 试验组器械清洗方法 基于对照组的清洗方法而改进。将对照组②操作过程改进为:把多酶清洗液置于超声清洗器的清洗槽中,启动设备加热程序使多酶清洗液恒定在40℃,然后放入试验器械浸泡5 min,并使用设备配置的管腔清洗喷枪在器械管腔中循环灌注40℃的多酶清洗液,最后在40℃的多酶清洗液的液面下使用小毛刷反复刷洗器械表面及管腔端口;在对照组⑤操作过程结束后,将试验器械放入全自动喷淋清洗机中按普通器械清洗消毒程序(冲洗、多酶清洗液洗涤、软化水漂洗、纯水终末漂洗、90℃热力消毒5 min)处理;其余步骤与对照组的清洗方法相同。
1.2.3 清洗质量检测 本次试验的全部管腔类器械,均依次采用常规目测、ATP生物荧光检测和95%乙醇检测等3种方法进行管腔内的清洗质量检测,以确定管腔类器械清洗的有效性。常规目测根据卫生部《医院消毒供应中心管理规范》(2009年版)第三部分的相关规定,管腔类器械清洗后都应采用带光源放大镜进行目测,且目测的合格标准为:经清洗并干燥的器械,器械表面、关节、齿牙和管腔应光洁,无血渍、污渍、水垢等残留物质,锈斑器械采用带光源的放大镜检查管腔器械的清洁度,无污渍、血渍。本次试验增加器械清洗质量检测新技术ATP生物荧光检测法,对器械管腔内的残留污染物进行定量检测,以准确测定2组器械清洗后管腔内污染物的残留情况。基本检测步骤为:①用生物荧光测试管中专用棉拭子插入待检测器械管腔中;②用无菌一次性注射器抽取专用增湿剂1~2 mL,从棉拭子处缓慢注入,使棉拭子被充分浸湿;③反复转动棉拭子,然后从管腔中取出棉拭子放回生物荧光测试管中,并快速掰断拭子上端的节流阀,挤下试剂并震荡约15次,再将试管放入荧光光度计量测定仪中测定相对光单位值(RLU值)。检测结果判定:RLU值小于2 000为清洁质量合格,RLU值大于2 000为清洁质量不合格。采用乙醇检测器械管腔清洗质量,是本次试验的自制检测方法,基本检测步骤为:①取1个肾形盘平放于桌面,并在盘中平铺大小合适的白纱布;②用清洁白纱布堵住待检测器械管腔的一端,再取1支一次性50 mL注射器抽取95%乙醇,从待检测器械管腔的另一端注入适量95%乙醇,然后快速用清洁白纱布堵住管腔的乙醇注入端口;③用手指压在堵住器械管腔两端的白纱布,然后反复摇晃震荡器械约30 s;④将器械管腔的一端倾斜放在平铺有白纱布的肾形盘上,再将堵在该端口的白纱布快速拉开,使管腔内的95%乙醇浸在肾形盘的白纱布上,最后在浸过95%乙醇的白纱布上观测颜色变化,以此判定器械管腔内的清洗质量。
1.3 检测结果判定
参照常规目测标准,如浸过95%乙醇的白纱布颜色未发生改变,判定为器械管腔的清洗质量合格;如浸过95%乙醇的白纱布颜色变黄或有可见污物残留,则判定器械管腔的清洗质量不合格。
2 结果
2.1 器械的清洗效果
对照组方法清洗后的管腔类手术器械,清洗质量平均合格率为88.7%,而试验组方法清洗后的管腔类手术器械,清洗质量平均合格率为97.8%,2组管腔类手术器械的清洗质量差异性较显著,见表1。
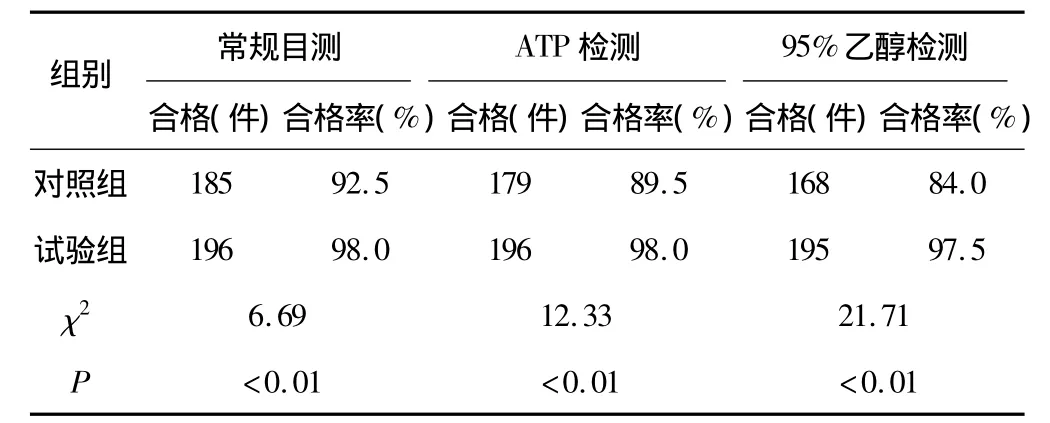
表1 2组管腔类器械的清洗质量检测结果比较(n=200)
2.2 器械清洗质量检测的效果
对照组的管腔类手术器械清洗后,采用常规目测、ATP生物荧光检测和95%乙醇检测的合格率分别为92.5%、89.5%和84.0%,3种清洗质量检测结果存在较大的差异;而试验组的管腔类手术器械同比的清洗质量检测结果的差异较小。
3 讨论
清洗是保证手术器械消毒灭菌成功的前提,没有合格的清洗,管腔内就有可能在其缝隙或表面造成病原微生物粘附,形成有机生物膜,阻碍消毒灭菌因子的穿透,器械的消毒灭菌就很容易失败[2-3]。本次试验结果表明,管腔类手术器械因具有构造的特殊性,传统的清洗方法和清洗质量检测方法对于管腔类手术器械的清洗质量控制都具有一定的缺陷,需要针对管腔类手术器械的构造特点进行必要的改进,促进其污染物的彻底去除,确保医疗安全。
本次试验中,对照组器械采用传统的管腔类手术器械清洗方法,而试验组器械的清洗方法在对照组清洗方法的基础上,改进了保温超声波处理、加大了管腔内多酶清洗液的灌洗力度和清洗后期的全自动喷淋清洗及消毒处理过程,结果使器械的平均清洗质量合格率从88.7%提高到97.8%,其原因在于:①多酶清洗液中含蛋白水解酶、脂肪酶和淀粉酶等生物活性酶,水温对酶活性具有显著的影响,实验证明40℃左右的水温是酶分解有机污染物的最佳温度,温度过低则会降低酶的作用力[4],而对照组的清洗方法缺乏合适的多酶清洗液加热设备,不能在清洗过程中提供合适的水温;②管腔类手术器械的管腔长且细小,毛刷常不能进入管腔内进行刷洗,采用注射器灌注多酶清洗液的力度和作用时间都不足以保证管腔壁附着的污染物被充分去除,而试验组采用高压清洗喷枪吸多酶清洗液对器械管腔进行持续冲洗,管腔内壁的污染物就容易被软化和冲洗去除;③试验组器械清洗的后期放入全自动清洗消毒器中进行处理,既能进一步去除器械管腔内壁残余的污染物,又能起到可靠的热力消毒作用。由此可见,管腔类手术器械在清洗过程中,除了需要恰当的清洗程序外,更应关注清洗剂适用环境、管腔内清洗作用力及作用时间等影响清洗质量的相关因素。
器械清洗的可靠性,需要借助有效的清洗质量检测方法进行评判。对于结构简单的普通手术器械而言,目测是判定其清洗质量最简单、最实用的方法,但目测方法用于管腔类器械的清洗质量检测具有较大的视觉局限性,即使是借助带光源放大镜目测也不能有效观测管腔的深处[5]。ATP生物荧光检测是使用较多的新型器械清洗质量检测方法,可定量检测出微生物在器械上的残留情况,但因检测过程较繁琐和检测成本较高,通常都仅用于器械清洗质量的定期检测[6]。95%乙醇检测为作者自创的器械管腔内清洗质量检测方法,是根据业内人员常用的白纱布检测方法改进而来(白纱布检测方法为干纱布擦拭,可在纱布上直观擦拭后附着在纱布上的污染物,但细小管腔内纱布不能进入,某些干涸的污染物也不容易擦除)[7],主要是利用95%乙醇无污染和溶解性强的特性,灌注在管腔内部并震荡后可较好将管壁附着的污染物溶解或松动,最后被95%乙醇带出管腔。本次试验采用了常规目测、ATP生物荧光检测和95%乙醇检测3种清洗质量检测方法,用于试验组器械管腔清洗质量检测的结果相近,但用于对照组器械管腔清洗质量检测的结果却产生了较大的差异。其原因在于对照组器械管腔的清洗存在缺陷,虽器械管腔两个端口附近的污染物容易被去除,但管腔内部的某些污染物特别是陈旧性污垢却未被有效去除,以至于常规目测端口附近的清洁质量合格率达到92.5%,而能检测到管腔内部清洁质量的ATP生物荧光检测和95%乙醇检测的检测结果仅分别为89.5%和84.0%,特别是采用95%乙醇检测方法还将部分器械管腔内黑色的块状污垢带出。试验组采用的清洗措施效果更可靠,器械管腔内壁残留的新鲜污染物和陈旧性污垢都被有效去除,清洗后不管在器械管腔的端口检测还是在管腔内部检测均达到较高的清洗质量合格率。从本次试验中可看出,自创的95%乙醇检测方法用于器械管腔的清洗质量检测的效果较可靠,且可操作性强,检测成本低,检测后器械管腔内干燥速度快,也不污染器械,如通过进一步的效果验证后,可用于日常的管腔类手术器械清洗质量检测。
[1]徐惠莲,邵文博,张惠民.多酶清洗剂对器械清洗效果的观察[J].中华医院感染学杂志,2009,19(10):1238-1239.
[2]戚丽彬.手术室腔镜仪器管理与器械清洗保养[J].局解手术学杂志,2010,19(5):442.
[3]施建辉,魏静蓉,任 辉,等.手术室穿刺清洗质量控制方法的改进研究[J].局解手术学杂志,2014,23(3)265 -267.
[4]李良芳,刘婉薇,陈 琼,等.多酶清洗剂温度及清洗时间对清洗效果的影响[J].护理研究,2012,26(3):611 -612.
[5]苏清彩,陈云超,张 晖,等.多酶溶液加超声清洗对腹腔镜器械清洗和维护的效果评估[J].护士进修杂志,2010,25(1):72 -73.
[6]邹丽娟,常后婵,戴红霞,等.应用ATP荧光法监测腔镜器械清洗各环节的效果分析[J].护士进修杂志,2012,27(14):1258 -1260.
[7]赵体玉,罗艳霞,王 姝.管腔类器械清洗效果检测方法的对比研究[J].中华医院感染学杂志,2010,20(10):1426 -1427.
