气孔对环境因子的感知及趋适应答
2014-09-16王瑞云连帅刘笑瑜
王瑞云,连帅,刘笑瑜
(1.山西农业大学 农学院, 山西 太谷 030801; 2.农业部黄土高原作物基因资源与种质创制重点实验室, 山西 太原 030031)
气孔对环境因子的感知及趋适应答
王瑞云1, 2,连帅1,刘笑瑜1
(1.山西农业大学 农学院, 山西 太谷 030801; 2.农业部黄土高原作物基因资源与种质创制重点实验室, 山西 太原 030031)
作为气体(主要为CO2和水蒸气)进出植物体的门户,气孔分布于植物茎、叶、果实和种子等器官的表皮上。气孔感知外界环境的时限可以短至几分钟,也可以长达上百万年,可以适应局部或全球的气候变化。近年来,对气孔在形态、解剖、生理、遗传进化、分子调控机制及全球生态等众多领域的研究取得了重大进展。气孔的形态、分布及其行为是对小到胞内信号、大到全球气候变化一系列信号系统的响应结果。以上一系列适应策略的调控系统是一张无尺度的网络,将现有的有关气孔的各个层面的研究整合起来可以更好地了解这个网络。文章从气孔对光合作用及蒸腾作用的影响、气孔的进化、气孔发育的环境调控、气孔孔径对环境信号的趋适响应等方面阐述气孔的研究进展。
气孔;环境因子;感知;趋适应答
气孔影响全球范围的碳循环和水分循环。大气中总的含碳量为730×1015g,陆生植物每年光合固碳120×1015g[1],即大气中近1/6的碳由气孔吸收而来。气孔总面积仅占叶片表面积的5%[2],但水分散失率则高达70%。地球上大气含水量为15×1015kg·年-1,热带雨林的水分最大蒸腾率为32×1015kg·年-1,超出大气含水量的2倍。地球上的年降水量是110×1015kg[3],蒸发和转化总量达70×1015kg。气孔蒸腾在全球水循环中的贡献可以用动态营养模型决定[4,5]。可见,气孔在协调CO2吸收和水分蒸腾方面具有全球性意义。
气孔是植物体茎、叶、果实和种子等器官表皮上的小孔,由一对保卫细胞围合而成。其功能是控制水分CO2和在叶片等器官内与外界气体的交换。其能力大小直接影响植物体对水分的调节和获得CO2的程度。气体交换通过控制气孔的大小和数目来实现。光质等环境信号共同调节气孔的大小及发育。气孔和角质层是高等陆生植物在进化中形成的关键结构,该结构使植物体可以适应各种环境变化以保证其含水量[6]。
1 气孔对光合作用及蒸腾作用的影响
光合过程中CO2从大气进入到叶片及蒸腾过程中,水蒸气从叶片散失到大气的过程均由气孔的开闭来调控。适宜条件下,最大气孔导度和最大光合速率间的关系可以衡量气孔的调控程度。田间试验证明了光合速率和气孔导度的最大变幅。C4植物光合速率高于C3植物;胞间CO2浓度与气室中CO2浓度的比率稳定:C3和C4植物中分别为0.65~0.80和0.4~0.6。这说明CO2吸收到叶绿体中的量与光合作用中酶的需量之间保持一致[7]。
C3植物最大光合速率与气孔导度呈负相关,可以用以度量水分利用率[5]。较低的气孔导度阶段光合速率最大,当气孔导度大于0.4 mol·m-2· s-1时,最大光合速率迅速变得平缓。蒸腾速率与气孔导度的关系类似于最大光合速度与气孔导度的关系,但是叶片温度响应与气孔导度负相关。这就说明气孔可以同时调控叶片温度和气体扩散。当气孔导度小时,其微小的差异即可极大地影响叶温,当气孔导度大于0.4 mol·m-2· s-1时,对叶温影响变化不明显。气孔导度越大,光合效率变化越小,叶温变化也越小,表明水分高效利用不受水分供应局限。相反,在缺水环境中,气孔导度小,水分利用率高。在C3植物中,CO2浓度的持续增加可使光合作用增强。气孔导度降低[8],植物对水分的需要量更少,但利用率更高[9]。然而,物种不同,对CO2的响应也有差异,一些物种偏爱高浓度的CO2,气孔导度及光合效率在种间存在差异[10]。
水分供应的差异在不同物种间具有较宽的变幅,干旱环境中,约有一半的植物气孔导度小于0.4 mol·m-2· s-1,而其中40%的气孔导度大于0.4 mol·m-2· s-1。干旱条件下,气孔导度高,短期内获得水分多,生长迅速,这种情况下,高的气孔导度和光合能力便于植物快速生长。
对棉花和小麦而言,产量与最大气孔导度呈正相关,但与光合效率不呈正相关[11]。在这种情形下,高的气孔导度引起作物的蒸发冷却,使叶片温度降低到减产的范围。生长在较冷环境中的海马康草(cakileedentula)表现出对干旱的适应,水分利用率最高[12],表明了叶片权衡CO2吸收及水分散失后保持一定的水平。在潮湿的环境中,水分利用率不作为选择目标。气孔对水分利用的选择行为在生长在同一地域的雌雄同株和雌雄异株两个百合群体中得到证实[13]。其中,雌雄同株群体的微生境潮湿,其特点是调整气孔导度到最小失水范围,这样一来,光合效率最高,产出最大;雌雄异株群体微生境干燥,CO2摄入量最大、同化产物多,蒸腾量最大,气孔导度最大。
2 气孔的进化
气孔通过控制水分的进出使植物适应环境,其对物种形成及进化起重要的作用。四亿年前,气孔首先在陆生植物表皮中出现,之后便在大小和密度方面渐次变化[14]。气孔有禾本科植物的哑铃型和其他植物中的肾形两种形态。
四亿年前的显生宙,大气中CO2浓度低,植物的气孔密度高[15],并且出现了蕨类植物和被子植物[16],其中是否有某种互作,尚有待研究。在全球气候剧变的新生代(6600万年前),山龙眼目及禾本科植物中哑铃型气孔的进化可以证实环境变化与气孔进化间的联系[5]。
基于叶绿体DNA水平的气孔分布差异可以识别山龙眼科班克木属的2个进化枝[17]。一个分支Cryptostomata的气孔下陷或呈气孔窝存在,另一个分支Phanerostomata(发生于潮湿生境的原始种)的气孔则分布于表面。于公元前5500~3500万年间,生境干燥的Cryptostomata从Phanerostomata中进化而来[18]。潮湿和干燥的气候差异引起的气孔位置的不同是2个分支不同分布和生存能力的一个重要决定因子[18]。地中海夏季和冬季间的气候差异导致了山龙眼科植物百瑞木(Cistusincanus)气孔分布发生变化:冷湿冬季产生的叶片大而扁平,为双面气孔型,下表皮气孔密度高;炎热干燥的夏季产生的叶片皱缩卷曲,为单面气孔型,分布于下表皮的气孔以气孔窝形式存在[19]。
式中,S(ci,cj)为两个QoS属性参数之间的相似度,u为两个QoS属性参数之间的相容性参数。引入此公式后,避免了那些没有比较意义的QoS属性比较过程,提高了效率。
禾本科约有1万个种,通过分析其叶绿体和核DNA,已构建了其宏观进化史[20]。禾本科的哑铃型气孔比肾形气孔进化。梯牧草保卫细胞采取了肾形阶段的过渡转变[5]。和肾形气孔相比,哑铃型的气孔间隙加宽、孔径增大[21],适应环境变化潜势增大,能量消耗减少,光合效率和水分利用率提高[22]。在禾草类作物早期进化中,以下(层林)木环境为特征。在凌晨和傍晚蓝光含量增加[22],气孔对蓝光的快速响应参与光合。
禾谷类植物起源于5.5~7亿年前[20],为热带雨林下(层林)木植物,其哑铃型气孔能够快速高效对开阔生境的光条件作出响应以避旱。动物取食和牧场耐牧灌丛和树增加了耐采食牧草的分布,尤其是开阔的林地,而草地较高反射率增强了地域性的干旱[23]。
3 气孔发育的环境调控
环境因子对气孔的大小及分布均会产生影响。在不同的物种和环境条件下,气孔大小为10~80 μm,密度为5~1500 mm-2[5,23~29](图1)。单面气孔型、双面气孔型及化石植物,气孔大小和密度变化较大,但是气孔大小和密度间存在相关性。除志留纪和泥盆纪时期早期的陆生植物之外,气孔密度低,气孔小,说明至少3亿年前就有这种关系的存在。基于此,气孔密度和大小特异的物种选择不明显。
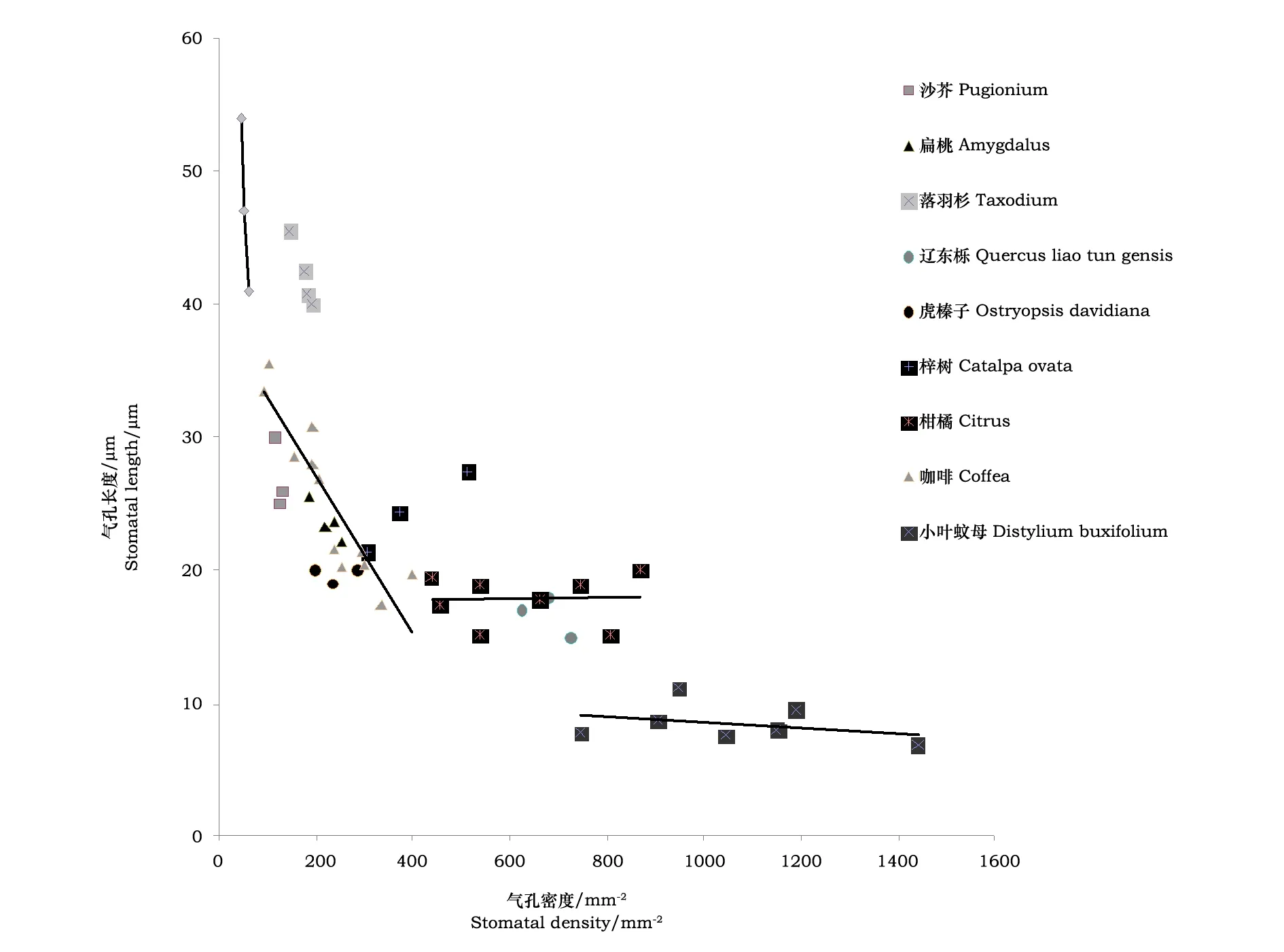
图1 不同植物的气孔长度和气孔密度
气孔对环境变化作出快速响应后,使水分从土壤运输到叶片[6]。气孔大小在干旱条件下,起主要作用,气孔长度和干旱感知间存在明显的负相关[30]。气孔越大,关闭越慢,表明干旱胁迫下,水力学功能障碍的巨大潜势。蕨类遮荫后气孔变大、气孔密度变小,在全遮阴下气孔开放[31,32]。短日照下,气孔的持续开放减少了气孔对光合的限制,这是光限制条件下光合增强的关键。因此,大的肾形气孔是植物在潮湿和遮阴条件下的重要特征,但是其慢的动态行为导致干旱条件下发生一系列问题。气孔小有利于迅速开闭,其与密度高的关系提供了在最适宜光合条件下,气孔导度的提高,最大限度摄入CO2[30]。CO2浓度增加对气孔密度和气孔指数增长的效应是环境控制气孔的最深入的研究之一。CO2浓度增加气孔密度在不同物种间及拟南芥的不同生态型间产生变化[33]。气孔密度变幅为45~720 nm-2,CO2加倍,气孔密度减少11%。CO2浓度增加、气孔密度降低,引起气孔导度减小、光合速度增加[15,16,33]。
气孔密度和气孔指数的降低与CO2浓度增加有关[34]。从物种间短期的可塑性变化到内在遗传响应,是长期选择的结果。倍性程度的改变也能导致气孔密度和大小产生变化。拟南芥不敏感品种在CO2倍增后,对气孔密度产生了小的调控响应,因为单基因突变导致了对CO2的非常明显的响应[35]。
环境信号可以调控气孔发育[35~40]。拟南芥中编码推定的3-ketoaoy1 COA合成(KCS)的HIC基因,在CO2浓度增加时,调控气孔发育[35]。因为在表皮/角质层中发现,KCS参与蜡质wax组成因子的合成。在hic中,阻遏子导致[35]表皮/角质层的结构特征改变,相关观察在拟南芥wax-缺失突变体中可以找到非正常气孔模式[35,36],对其他拟南芥突变体的分析显示,气孔指数的CO2响应在茉莉的突变体Fad-4中不存在,在乙烯中不敏感。突变体ein-2中,仅在叶片上表皮的气孔缺乏响应。茉莉酸甲酯和乙烯转导途径也有阻止病菌侵入的功能,cin-2突变体对病原体的侵入易感[37]。气孔发育对CO2浓度的响应与防御病原入侵的机制同等重要。不同的拟南芥种质对白粉病[38]及CO2浓度[33]均具有不同的抗性,目前尚未有证据能将这两种响应联系在一起。这两个过程的任何联系都会大大影响气孔对CO2响应的选择。从长远来看,研究时段越长,得到的结果越可靠[34]。和病原菌入侵响应相类似,提高CO2浓度,气孔发育会有系统性调控,因为成熟叶片可监测CO2并产生信号影响正在发育的叶片[39]。
叶片上、下表皮的气孔调控机制不同。乙烯对拟南芥ein-2突变体上、下表皮气孔发育的调控不同[40]。通过比较野生、栽培和嫁接周缘嵌合体番茄的气孔密度,发现嵌合体番茄具有野生番茄的表皮和栽培番茄的叶肉,说明上、下表皮的行为不同[41]。两个供体(野生番茄、栽培番茄)的下表皮气孔均比上表皮多,栽培番茄的气孔密度比野生番茄大。嫁接周缘嵌合体的上表皮气孔密度和表皮供体野生番茄的相同,然而下表皮的气孔密度显著低于其供体。
4 气孔孔径对环境信号的趋适响应
4.1 保卫细胞信号系统的无尺度网络特性
无尺度网络既牢固又易于变通,适宜于同时识别和处理多个信号。以上特性来源于网络自身而不是单独的组成元件[49,50]。无尺度网络由许多节点(即信号元件和中枢)组成,它们是网络的功能中心。无尺度网络的特征是通过节点幂律分布呈现应急特性,中枢元件允许出现故障但不能缺乏,发生差错有补救措施,一旦缺乏则会导致网络瘫痪[49]。通常无尺度网络的网络图谱至少需要1000个节点,以便于幂律分布的分析。目前保卫细胞信号系统的图谱小且不完整,尚不能进行幂律分布的分析。但是,在保卫细胞信号中有可能将这些元件组装成一个网络。
4.2 保卫细胞信号系统柔韧特性
无尺度网络具有柔韧特性,它们呈现出对节点去除后的高度耐性。某一信号元件缺失不会影响保卫细胞的作用。如拟南芥突变体携带蓝光受体基因PHOT1或PHOT2呈现野生型蓝光诱导的气孔开放。只有当phot1、phot2双突变体中的2个受体基因表达均失活才能引起气孔对蓝光不响应[51]。保卫细胞的柔韧特性优势可能在于保卫细胞在一定程度上调控CO2吸收和水分散失。
4.3 中枢元件缺失下保卫细胞信号系统的脆弱特性
中枢元件缺失脆弱是无尺度网络的特征[49]。保卫细胞信号系统存在类似性质吗?在信号系统中,中枢在处理刺激响应中起决定作用。目前,保卫细胞信号系统可能的中枢候选基因是增加保卫细胞钙离子浓度,其发生于ABA、胞间Ca2+、H2O2、CO2和IAA信号中[42,43]。前面已提到,有许多机制可导致保卫细胞钙离子的增加[52]。这些结果中,表型效应较小。无尺度网络的柔韧特征表明BAPTA进入保卫细胞胞质,无ABA介导的充盈丧失[53],这是中枢活动受阻后影响系统正常运行的例子。因此,保卫细胞信号系统具有无尺度网络的类似特征。准确描述保卫细胞信号系统的结构需要更多的佐证资料及精确严密的分析。
4.4 保卫细胞的趋适和节律行为
以网络形式存在的保卫细胞信号的突出特点是适应外部信号。生长在温室中的蚕豆的气孔没有生长在培养箱中的气孔对CO2敏感[54]。以上气孔对CO2的敏感性在分离的表皮制剂中也有发现。这表明以上特性是气孔发生了变化,而不是整个叶片的特征发生改变。连续4年的观察发现,树木在CO2倍增时,气孔导度下降21%[55],气孔密度也有类似响应[56]。
尽管尚不知道保卫细胞中适应环境的细胞基础,但是保卫细胞信号系统元件的组成已经逐渐搞清楚。如果CO2信号是独立通道,那么适应环境不影响保卫细胞对其他信号的响应。然而假设CO2浓度对气孔孔径的影响是通过信号网络来实现的,那么该信号的敏感度变化将给其他通道带来影响。从低浓度CO2中转移到高浓度CO2中,拟南芥的气孔导度下降[57]。但这种改变是跃迁的,很快气孔导度又会恢复为转移前的状态,以上情况说明气孔能快速适应高CO2浓度。高CO2浓度下生长的植物在ABA胁迫处理后,气孔导度增高[56],说明一个信号的适应可引起其他信号的敏感度发生改变,与网络组织相一致。
气孔受环境的影响具有节律性。这些节律直接控制气孔孔径或调整气孔响应其它信号。昼夜节律可以引起气孔昼开夜闭[57]、调节气孔对外源信号的感应[58]。研究发现蚕豆气孔的开张在黎明和白天分别与K+和蔗糖累积有关。气孔孔径的年变化可以通过保卫细胞的生理特性(膜电势)[59]、质膜(H+)ATP酶活性[60]的季节性变化)来检测。
4.5 气孔的自主特性和行使功能的全局性
气孔具有2个保卫细胞,研究发现,如果给其中的一个注射ADP 核糖后,该保卫细胞变小,而未注射的一个则维持形状不变[61],说明气孔发育早期,保卫细胞间缺乏胞间连丝联系[62]。单个气孔对叶片新陈代谢影响不大,但叶片所有气孔组成的气孔群的协同作用对植物体则大有裨益。这就可以合理解释为什么叶片上有的部分气孔开张,而另一部分气孔闭合[63]。局域性半自主行为常见于阔叶植物,典型的例子是下(层林)木中接受到穿过冠层的透射光的叶片的响应。光照下的气孔张开,而下层林木区缺乏光照的暗区气孔关闭,这有利于植物对光能的有效利用和保持含水量[32]。半自主行为旨在尽可能获取外部能量,局域性的集体行为可以作为气孔非自主性行为的证据[64]。
5 展望
文章综述了保卫细胞信号系统的无尺度网络特性、用已鉴定的大量的保卫细胞信号系统元件准确表述该网络结构。保卫细胞功能及发育的正向、反向遗传学应用及蛋白-蛋白互作整合运用,将产生一整套数据用以检测幂律分布能否应用到保卫细胞信号元件中。与线性通道形式相比,无尺度网络更能反映保卫细胞信号元件的组织形式。有必要对以下事件更新评估,用上位性分析方法定位彼此相关的信号元件。一系列前提条件满足后,运用上位性分析可知用于研究的信号和两个基因为表型的决定因素[65]。无尺度网络具有遗传冗余及牢固性,似乎和规则不一致。同样,该规则的运用,通过气孔孔径获得的表型数据解释得有疑问,因为该网络是由多个信号系统共同控制的。相应地,为了获得更多的保卫细胞信号系统的组成,用上位性分析法处理彼此相关的元件。最后,在信号系统网络中,无尺度网络的适应特性是保卫细胞信号系统的典型特征。
哑铃型气孔的进化在禾本科植物的地理分布、草食动物与区域气候协同进化方面均起到重要作用。地理学证据表明了自3.8亿年前的泥盆纪末期以来出现的三向互作:禾本科植物的放牧耐性进化、放牧有蹄类动物的增加及食草动物的减少[23]。泥盆纪末期气候干燥,耐旱的禾本科植物进入到树木和灌木生长地带[66]。从这个方面来看,高效率的哑铃型气孔的形成及其对新的生长环境的影响是禾本科植物进化的必要条件,是人类对放牧的动物进行驯化的先决条件。
[1]Ciais P,Denning A S,Tans P P,et al.A three-dimensional synthesis study of δO18in atmospheric CO2.I.Surface fluxes[J].J.Geophys.Res.Atmos,1997,102:5857-5872.
[2]Beerling D J,Woodward F I.Changes in land plant function over the Phanerozoic:reconstructions based on the fossil record[J].Bot J Linn Soc,1997,124:137-153.
[3]Jackson R B,Carpenter S R,Dahm C N,et al.Water in a changing world[J].Ecol.App,2001,11:1027-1045.
[4]Cramer W,Cramer W,Bondeau A,et al.Global response of terrestrial ecosystem structure and function to CO2and climate change:results from six dynamic global vegetation models[J].Global Change Bio,2001,7:357-373.
[5]Hetherington A M,Woodward F L.The role of stomata in sensing and driving environmental change[J].Nature,2003,424:901-908.
[6]Raven J.Selection pressures on stomatal evolution[J].New Phytol,2002,153:371-386.
[7]Farquhar G D,Von Caemmerer S,Berry J A.A biochemical model of photosynthetic CO2assimilation in leaves of C3 species[J].Planta,1980,149:78-90.
[8]Medlyn B E,Barton C V M,Broadmeadow M S J,et al.Stomatal conductance of forest species after long-term exposure to elevated CO2concentration:a synthesis[J].New Phytol,2001,149:247-264.
[9]Wullschleger S D,Tschaplinski T J,Norby R J.Plant water relations at elevated CO2-implications for water-limited environments[J].Plant Cell Environ,2002,25:319-331.
[10]Woodward F I.Potential impacts of global elevated CO2concentrations on plants[J].Curr.Opin.Plant Biol,2002,5:207-211.
[11]Lu Z,Percy R G,Qualset C O,et al.Stomatal conductance predicts yields in irrigated Pima cotton and bread wheat grown in high temperatures[J].J.Exp.Bot,1998,49:453-460.
[12]Dudley S A.Differing selection on plant physiological traits in response to environmental water availability:a test of adaptive hypotheses[J].Evolution,1996,50:92-102.
[13]Case A L,Barrett S C H.Ecological differentiation of combined and separate sexes ofWurmbeadioica(Colchicaceae) in sympatry[J].Ecology,2001,82:2601-2616.
[14]Edwards D,Kerp H,Hass H.Stomata in early land plants:an anatomical and ecophysiological approach[J].J.Exp.Bot.1998,49:255-278.
[15]Beerling D J,Woodward F I.Changes in land plant function over the Phanerozoic:reconstructions based on the fossil record[J].Bot.J.Linn.Soc,1997,124:137-153.
[16]Woodward F I.Do plant really need stomata? [J].J.Exp.Bot.1998,49:471-480.
[17]Mast A R,Givnish T J.Historical biogeography and the origin of stomatal distributions inBanksiaandDryandra(Proteaceae) based on their cpDNA phylogeny[J].Am.J.Bot.2002,89:1311-1323.
[18]Hill R S.(ed.) History of the Australian Vegetation[M].Cambridge:Cambridge Univ.Press,1994.
[19]Aronne G,De Micco V.Seasonal dimorphism in the MediterraneanCistusincanusL.subsp.incanus[J].Ann.Bot.2001,87:789-794.
[20]Kellogg E A.Evolutionary history of the grasses[J].Plant Physiol,2001,125:1198-1205.
[21]Raschke K.In Encyclopedia of Plant Physiology Vol.7 (eds Haupt W amp; Feinleib M E ) [M].Berlin:Springer,1979:383-441.
[22]Grantz D A,Assmann SM.Stomatal response to blue-light-water-use efficiency in sugarcane and soybean[J].Plant Cell Environ,1991,14:683-690.
[23]Retallack G J.Cenozoic expansion of grasslands and climatic cooling[J].The Journal of Geology,2001,109:407-426.
[24]马之胜,贾云云,王建学,等.桃树叶片气孔密度的研究[J].江西农业学报,2008,20(5):30-31.
[25]李润唐,张映南,田大伦.柑橘类植物叶片的气孔研究[J].果树学报,2004,21(5):419-424.
[26]邹锋,谭晓风,何小勇,等.不同种源小叶蚊母气孔长度、宽度与密度的关系[J].西南林学院学报,2009,29(3):19-21,43.
[27]李茂松,王春艳,宋吉青,等.小麦进化过程中叶片气孔和光合特征演变趋势[J].生态学报,2008,28(11):5385-5391.
[28]赵秋玲,王军辉,马建伟,等.梓树属植物叶片的气孔特征[J].东北林业大学学报,2011,39(8):21-24.
[29]郑淑霞,上官周平.近一世纪黄土高原区植物气孔密度变化规律[J].生态学报,2004,24(11):2457-2464.
[30]Aasamaa K,Sober A,Rahi M.Leaf anatomical characteristics associated with shoot hydraulic conductance,stomatal conductance and stomatal sensitivity to changes of leaf water status in temperate deciduous trees[J].Aust.J.Plant Physiol,2001,28:765-774.
[31]Allen M T,Pearcy R W.Stomatal versus biochemical limitations to dynamic photosynthetic performance in four tropical rainforest shrub species[J].Oecologia,2000a,122:479-486.
[32]Allen M T,Pearcy R W.Stomatal behavior and photosynthetic performance under dynamic light regimes in a seasonally dry tropical rain forest[J].Oecologia,2000b,122:470-478.
[33]Woodward F I,Lake J A,Quick W P.Stomatal development and CO2:ecological consequences[J].New Phytol,2002,153:477-484.
[34]Royer D L.Stomatal density and stomatal index as indicators of paleoatmospheric CO2concentration[J].Rev.Palaeobot.Palyno,2001,114:1-28
[35]Gray J E,Holroyd G H,van der Lee F M,et al.The HIC signalling pathway links CO2perception to stomatal development[J].Nature,2000,408:713-716.
[36]Chen X,Goodwin M S,Boroff V L,et al.Cloning and characterization of the WAX2 gene ofArabidopsisinvolved in cuticle membrane and wax production[J].Plant Cell,2003,15:1170-1185.
[37]Penninckx I A M A,Thomma B P H J,Buchala A,et al.Concomitant activation of jasmonate and ethylene response pathways is required for induction of a plant defensin gene in Arabidopsis[J].Plant Cell,1998,10:2103-2113.
[38]Adam L,Ellwood S,Wilson I,et al.Comparison ofErysiphecichoracearumandE.cruciferarumand a survey of 360Arabidopsisthaliana successions for resistance to these two powdery mildew pathogens[J].Mol.Plant Microbe Interact,1999,12:1031-1043.
[39]Lake J A,Quick W P,Beerling D J,et al.Signals from mature to new leaves[J].Nature,2001,411:154-155.
[40]Lake J A,Woodward F I,Quick W P.Long-distance CO2signalling in plants[J].J.Exp.Bot.,2002,53:183-193.
[41]Heichel G H,Anagnostakis S L.Stomatal response to light ofSolanumpennelli,Lycopersiconesculentum,and a graft-induced chimera[J].Plant Physiol,1978,62:387-390.
[42]Schroeder J I,Allen G J,Hugouvieux V,et al.Guard cell signal transduction [J].Annual Review of Plant Physiology and Molecular Biology,2001,52:627-658.
[43]Hetherington A M.Guard cell signaling[J].Cell,2001,107:711-714.
[44]McAinsh M R,Hetherington A M.Encoding specificity in Ca2+signalling systems[J].Trends Plant Sci,1998,3:32-36.
[45]Roelfsema M R G,Prins H B A.Effect of abscisic acid on stomatal opening in isolated epidermal strips of abi mutants ofArabidopsisthaliana[J].Physiol.Plant,1995,95:373-378.
[46]Webb A A R,Hetherington A M.Convergence of the abscisic acid,CO2,and extracellular calcium signal transduction pathways in stomatal guard cells[J].Plant Physio,1997,114:1557-1560.
[47]Leymarie J,Lasceve G,Vavasseur A.Interaction of stomatal responses to ABA and CO2onArabidopsisthaliana[J].Aust.J.Plant Physiol,1998,25:785-791.
[48]Leymarie J,Vavasseur A,Lasceve G.CO2sensing in stomata of abi1-1 and abi2-1 mutants ofArabidopsisthaliana[J].Plant Physiol.Biochem,1998,36:539-543.
[49]Albert R,Jeong H,Barabasi A L.Error and attack tolerance of complex networks[J].Nature,2000,406:378-382.
[50]Barabasi A L.Linked the New Science of Networks [M].Massachusetts:Perseus,2002:280.
[51]Kinoshita T,Doi M,Suetsugu N,et al.phot1 and phot2 mediate blue light regulation of stomatal opening[J].Nature,2001,414:656-660.
[52]Hunt L,Mills L N,Pical C,et al.Phospholipase C is required for the control of stomatal aperture by ABA[J].Plant J,2003,34:47-55.
[53]Webb A A R,Larman M G,Montgomery L T,et al.The role of calcium in ABA-induced gene expression and stomatal movements[J].Plant J,2001,26:351-362.
[54]Frechilla F,Talbott L D,Zeiger E.The CO2response ofViciaguard cells acclimates to growth environment[J].J.Exp.Bot,2002,53:545-550.
[55]Woodward F I,Kelly C K.The influence of CO2concentration on stomatal density[J].New Phytol,1995,131:311-327.
[56]Leymarie J,Lasceve G,Vavasseur A.Elevated CO2enhances stomatal responses to osmotic stress and abscisic acid inArabidopsisthaliana[J].Plant Cell.Environ,1999,22:301-308.
[57]Webb A A R.Biological Rhythms and Photoperiodism in Plants (eds Lumsden,P.J.amp;Millar,A.J.)[M].Oxford:Bios,1998:69-79.
[58]Talbott L D,Zeiger E.The role of sucrose in guard cell osmoregulation[J].J.Exp.Bot,1998,49:329-337.
[59]Thiel G,MacRobbie E A C,Blatt M R.Membrane transport in stomatal guard cells-the importance of voltage control[J].J.Membr.Biol,1992,126:1-18.
[60]Lohse G,Hedrich R.Characterization of the plasma membrane H.ATPase fromViciafabaguard cells modulation by extracellular factors and seasonal changes[J].Planta,1992,188:206-214.
[61]Willmer C,Sexton R.Stomata and plasmodesmata[J].Protoplasma,1979,100:113-124.
[62]Leckie C P,McAinsh M R,Allen G J,et al.Abscisic acid induced stomatal closure mediated by cyclic ADP ribose[J].Proc.Natl Acad.Sci.USA,1998,95:15837-15842.
[63]Weyers J D B,Lawson T.Heterogeneity in stomatal characteristics[J].Adv.Bot.Res,1997,26:317-352.
[64]Mott K A,Buckley T N.Patchy stomatal conductance:emergent collective behaviour of stomata[J].Trends Plant Sci,2000,5:258-262.
[65]Avery L,Wasserman S.Ordering gene function:the interpretation of epistasis in regulatory hierarchies[J].Trends Genet,1992,8:312-316.
[66]Bredenkamp G J,Spada F,Kazmierczak E.On the origin of northern and southern hemisphere grasslands[J].Plant Ecol,2002,163:209-229.
TheFunctionofStomatainSensingandAdaptingtoClimateFactors
Wang Ruiyun1,2, Lian Shuai1, Liu Xiaoyu1
(1.CollegeofAgriculture,ShanxiAgriculturalUniversity,TaiguShanxi030801,China; 2.KeyLaboratoryofCropGeneResourcesandGermplasmEnhancementonLoessPlateau,MinistryofAgriculture,TaiyuanShanxi030031,China)
Controlling the exchange of gases including water vapour and CO2between the interior of the organs and the atmosphere, stomata, spread on the surfaces of the organs such as stalks, leaves, fruits and seeds. They adapt to local and global changes on all timescales from minutes to millennia. Recent data from diverse fields are building their central importance to plant morphology, anatomy, physiology, genetic evolution, molecular regulation mechanisms and global ecology. Stomatal morphology, distribution and behaviour respond to a series of signals, from intracellular signalling to global climatic change. Such concerted adaptation results from a web of control systems, like a scale-free network, this will facilitate our understanding the stomata role better.
Stomata; Environmental factors; Sensing; Behaviour responsible for climate chang
2014-08-19
2014-09-25
王瑞云(1969-),女(汉),山西平定人,博士,副教授,研究方向:植物分子育种。
国家自然科学基金(31271791);山西省自然科学基金(2011011028-1);山西农业大学教学改革项目(2011)
Q948
A
1671-8151(2014)06-0481-07
(编辑:武英耀)
