响应面法优化金银花中黄酮类物质提取条件
2014-09-04关炳峰郭良起李向力
关炳峰,王 永,郭良起,李向力
(河南省商业科学研究所有限责任公司,河南郑州450002)
金银花含有多种对人体有利的植物活性成分,如绿原酸、异绿原酸、木犀草素等黄酮类化合物,具有抗衰防癌、轻身健体的良好功效。黄酮类物质的提取方法有水提法、乙醇提取法、超声波提取法、酶解醇提法等[1-4]。周春晖等[5]研究了水提法的工艺条件,李荣等[6]以总黄酮得率为指标,用乙醇法进行了提取工艺优化,李晓军[7]等研究了超声波法提取对金银花中黄酮类物质的影响。总的来说,水提法节省资源,但是得率低,并且杂质比较多,后续处理困难。超声波提取法局部产生较高的温度导致活性物质丧失活性,且生产成本高,很难适应工业化大规模生产的需求,因此不适宜采用。酶法在提取的同时可能与金银花中的其他物质发生反应,而降低了活性物质的提取量,而且酶的价格也比较昂贵,限制了酶解提取法在工业生产上应用。而乙醇提取法有成本低、得率高、对环境污染小等优点。
本文以乙醇为溶剂,采用响应面法优化了金银花中黄酮类物质提取条件,为工业化生产提供科学依据。
1 材料与方法
1.1 材料与仪器
金银花(水分含量1.00%,灰分含量6.31%)由浙江省温州市瑞安九谭金银花加工基地提供,金银花干花粉碎,过40目筛,密封保存;芦丁标准品武汉市华顺生物技术有限公司;乙醇、亚硝酸钠、氢氧化钠、硝酸铝 均为分析纯。
SD-250涡轮式粉碎机 浙江省嵊县特种粉碎设备厂;UV-265 FW型紫外可见分光光度计 日本岛津公司;RE52-99旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 单因素实验 以干燥粉末(水分含量为1.00%)为原料,称取2.000g样品,放到50mL烧杯中,加入乙醇,在电热恒温水浴锅中恒温加热一定时间,收集上部液体,重复加热提取。将液体真空抽滤,将滤液置于离心机中以4200r/min离心30min取出,在真空旋转蒸发仪中浓缩至乙醇含量很少(以不能闻出酒精味为宜),将浓缩液倒入50mL的容量瓶中,用蒸馏水定容。
按表1条件进行提取[8],提取后用分光光度法来测定并计算提取率,分析乙醇浓度、提取温度、料液比、提取时间、提取次数和提取液pH这6个因素对提取率的影响。

表1 提取条件的因素和水平表Table 1 Factors and levels of extraction
1.2.2 响应面法优化实验设计[9-14]以单因素实验确定响应面法设计实验的因素与水平,在料液比1∶15、提取次数3次、pH自然条件下,选取乙醇浓度X1、提取温度X2、提取时间X3三个因素,设计三因素二次回归旋转正交组合方案表2。
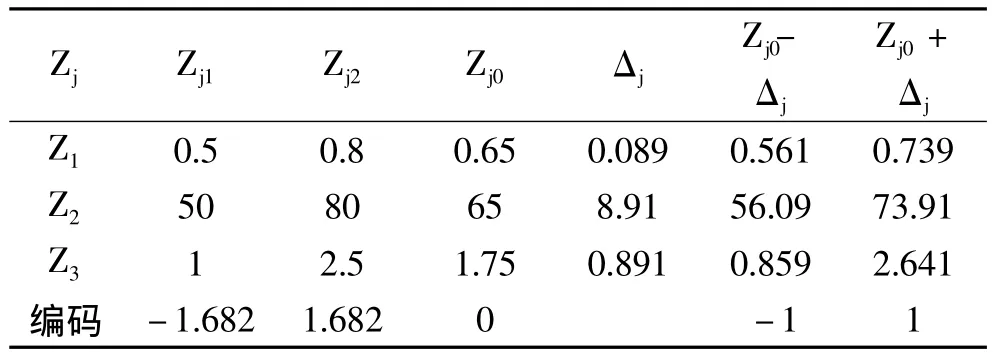
表2 二次回归正交旋转组合设计因素编码表Table 2 Factors and levels ofdual quadratic rotary combination design
1.2.3 金银花中黄酮类物质的测定 准确称取干燥至恒重的芦丁标准品0.0224g于100mL容量瓶中,95%乙醇溶解,摇匀,定容。取 0、2、4、6、8mL 标准品溶液于25mL比色管中,加5%亚硝酸钠溶液1mL,摇匀,放置6min,加10%硝酸铝溶液1mL,摇匀,放置6min,加10%氢氧化钠10mL,加水至刻度,摇匀,静置15min,在510nm波长处测定吸光度,以浓度为横坐标,吸光度为纵坐标,制作标准曲线[15]。将实验中测得的吸光度直接代入该公式,可以直接得到提取液中黄酮类物质的含量。
金银花中黄酮提取得率(mg/g)=金银花总黄酮提取液冻干后的质量/金银花粉末质量
1.2.4 数据处理 利用SAS软件,对设计的三因素二次回归旋转正交进行数据处理,并进行二次多元回归拟合,并考察3个因素之间的交互作用。
2 结果与分析
2.1 金银花中黄酮类物质提取单因素实验结果
选择温度60℃、料液比为1∶15、提取时间为2h、提取次数为3次,提取pH为7,研究乙醇浓度对提取率的影响。由图1可以看出,随着乙醇浓度的增大,黄酮类物质的含量不断升高。在乙醇的浓度达到60%前,黄酮类物质的得率随乙醇浓度的升高提高较快;当乙醇浓度大于60%后,黄酮类物质得率的增加速率明显变慢。因此,选择乙醇浓度为60%。

图1 乙醇浓度对提取的影响Fig.1 Effect of alcohol concentration on extraction
选择乙醇浓度为60%,其他条件不变,研究温度对提取率的影响。由图2可以看出,在60℃前黄酮类物质的得率随温度升高而升高,到达60℃时,黄酮类活性物质具有最高得率,而当温度高于60℃时,黄酮类物质的得率降低。当温度升高到一定程度时,金银花中黄酮类物质因温度高而发生变化,从而影响了黄酮类物质的提取。因此,选择提取温度为60℃。
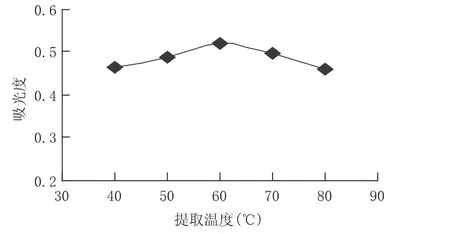
图2 提取温度对提取的影响Fig.2 Effect of temperature on extraction
选择乙醇浓度为60%、温度60℃,其他条件不变,研究料液比对提取率的影响。由图3可以看出,开始时黄酮类物质得率的增长较快,而在料液比为1∶20时,增长速度明显变慢。可见在一定范围内提取溶剂的增多,可以使黄酮类物质提取率增加,但是当提取溶剂增加到一定程度时,黄酮类物质的提取已经达到饱和,提取率增长速度就会变慢。因此,选择料液比是 1∶20。
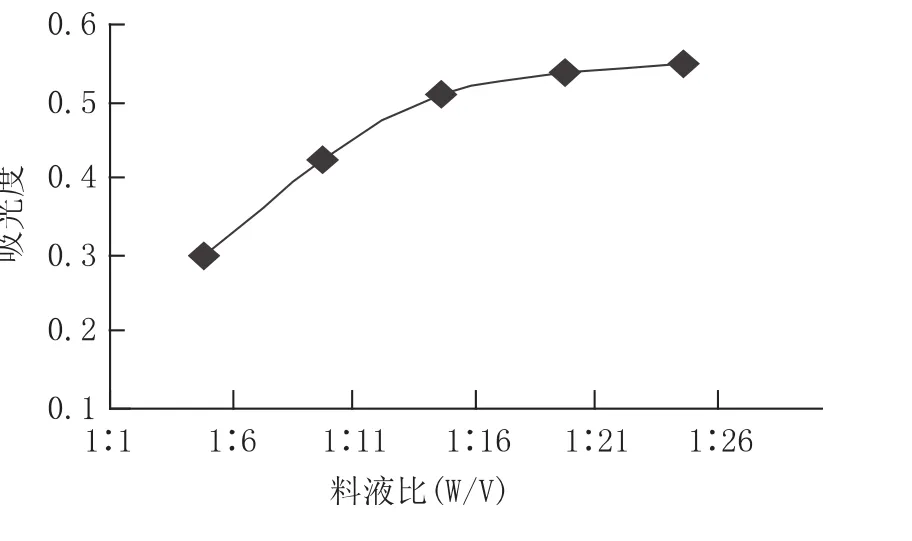
图3 料液比对提取的影响Fig.3 Effect of ratio of solid to liquids on extraction
选择乙醇浓度为60%、温度60℃、料液比为1∶20、提取时间为2h、提取pH不变,研究提取次数对提取率的影响。由图4可以看出,随着提取次数的增多,所获得的黄酮类物质是不断增多的,但是当提取次数达到3次以上时,黄酮类物质的得率增长速度变慢。可见,多次提取可以提高对金银花中黄酮类物质的提取,但是当提取次数到一定程度时,金银花中黄酮类物质的提取已经接近饱和,所以提取率的增长就会变小。因此,选择的提取次数为3次。

图4 提取次数对提取的影响Fig.4 Effect of extracting times on extraction
选择乙醇浓度为60%、温度60℃、料液比为1∶20,其他条件不变,研究提取时间对提取率的影响。由图5中可以看出,从1h开始,随着提取时间的增长,黄酮类物质的提取量增加,当提取时间到达2h后,黄酮得率开始明显降低。可见,随着提取时间的延长,对黄酮类物质的提取不利。因此,选择的提取时间为2h。

图5 提取时间对提取的影响Fig.5 Effect of extracting time on extraction
选择乙醇浓度为60%、温度60℃、料液比为1∶20、提取时间为2h、提取次数为3次,研究提取pH对提取率的影响。图6中可以看出,黄酮类物质的得率具有不规律性,当提取溶液pH为6时,黄酮类物质的得率最高,其它pH时,黄酮类物质的得率变动较大。当提取溶液的pH从7向酸碱两个方向移动时,黄酮类物质总的得率不断减少。可见,当提取溶液的pH呈现较强的酸性或碱性时,金银花中的黄酮类物质会因为pH的变化而发生一定的化学反应或本身性质发生变化,而不易被提取出来。因此,选择的提取pH为7。
2.2 旋转正交实验结果
按照三因素二次旋转正交回归设计方案,制备出23组浸提样,分别测定黄酮类物质的含量,用标准曲线y=11.088x-0.0002(R2=0.9999)计算结果。实验结果见表3:
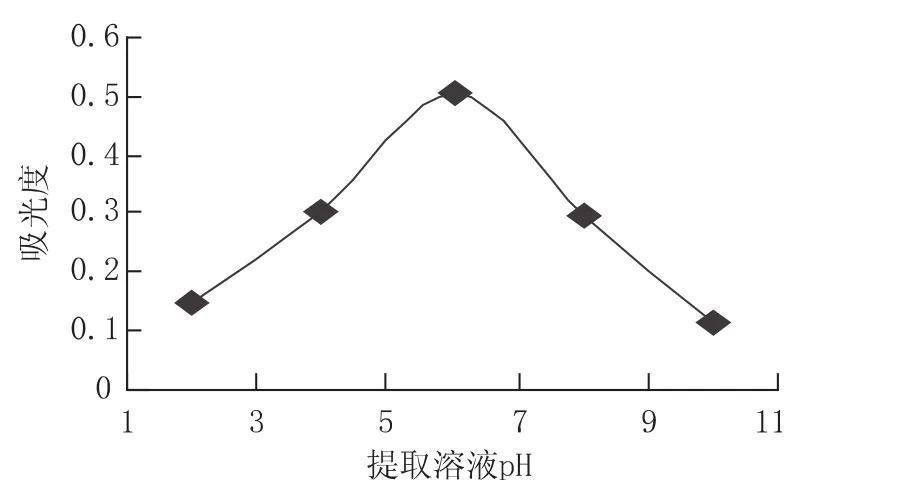
图6 溶液pH对提取的影响Fig.6 Effect of pH value on extraction
利用SAS软件,对表3数据进行分析,剔除不显著因素和不显著的交互作用,得到黄酮类物质的含量随乙醇浓度、提取温度、提取时间的标准回归模型为:Y=128.68X0-4.39X1-5.00-4.23
2.3 回归模型的检验
利用SAS软件,对表3数据进行分析。由表4可以得知,在显著水平α=0.01时,回归方程式F检验显著,说明回归方程与实际情况拟和较好。F检验反映的是回归模型的有效性,由表4可知,回归模型达到极显著水平,表明回归模型能够较好地描述各因素与响应值的关系。

表4 回归方差各项的方差分析Table 4 Coding coefficients for the independent variable
由表 5 T-检验结果表明,X2、X3、X1X2、X1X3和X2X3的回归系数不显著,因而原方程可以简化为:Y=128.68X0-4.39X1-5.00-4.23。根据各变量的显著性检验可以得出三个单因素的主次关系:乙醇浓度>提取温度>提取时间。通过SAS分析得到最佳工艺:乙醇浓度为65%、提取温度为65℃、提取时间1.75h。

表5 T-检验结果Table 5 The result of T-test
2.3.1 双因素交互作用对提取量的影响 由图7可见,乙醇浓度X1和提取温度X2有交互作用,在单因素对黄酮类物质提取的结果中,黄酮类物质的提取量随乙醇浓度的提高而增大;而由于乙醇浓度X1和提取温度X2有交互作用,使提取量出现一个峰值。因而提取金银花中黄酮类物质,乙醇浓度X1和提取温度X2不能升高过度。由图8可见,乙醇浓度X1和提取时间X3有交互作用。低浓度较长时间和低浓度较短时间的提取量相差不多,同一浓度随时间的延长提取量会先高后低。而提取时间过高长会影响提取量和提取物的性质。由图9可见,提取温度X2和提取时间X3有交互作用,当提取温度X2和提取时间X3都增大时,提取量也增大,当达到一定值时,提取量就有所下降。
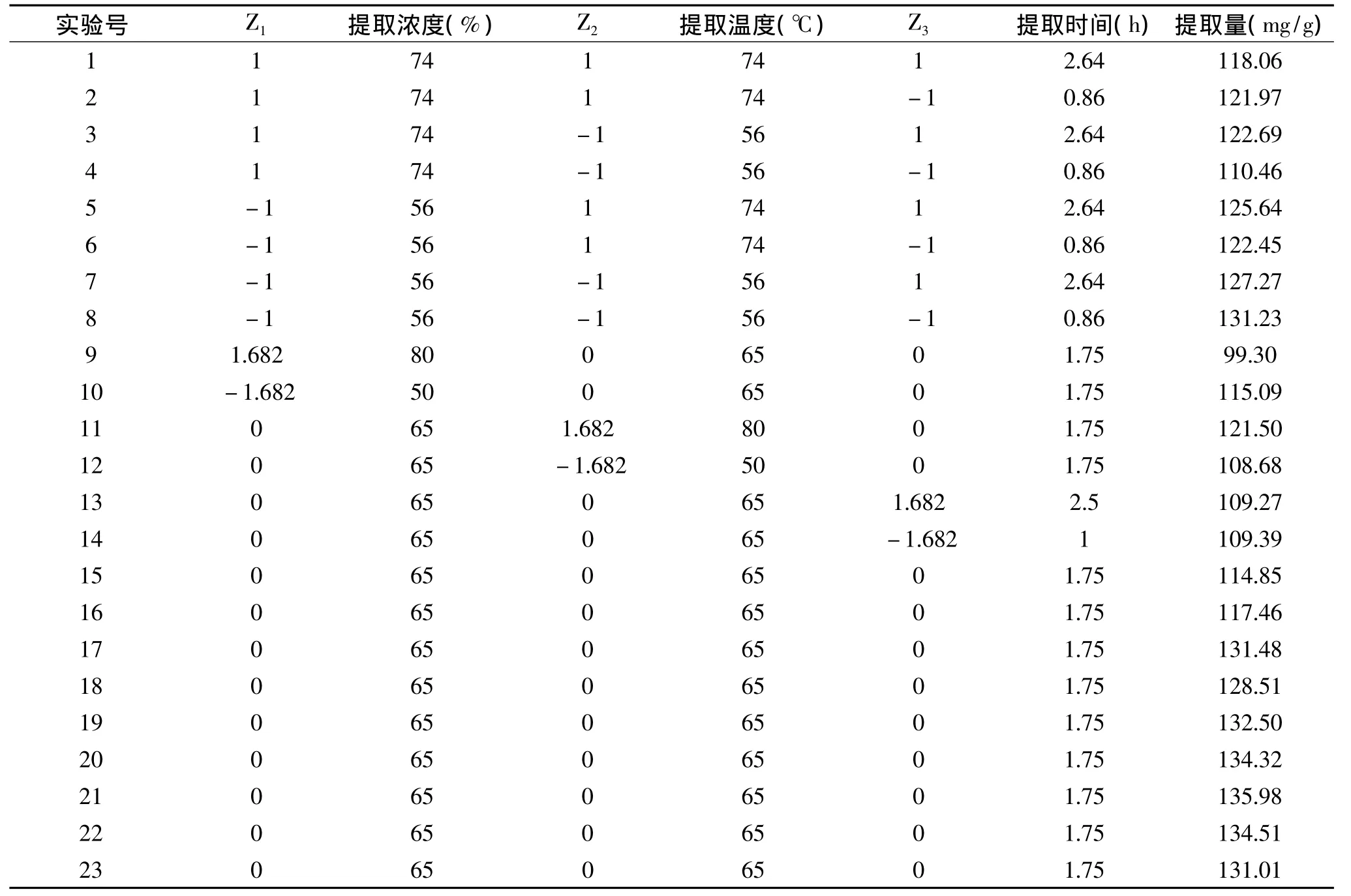
表3 二次回归正交旋转组合设计实验安排及结果表Table 3 Testing scheme and results of dual quadratic rotary combination design
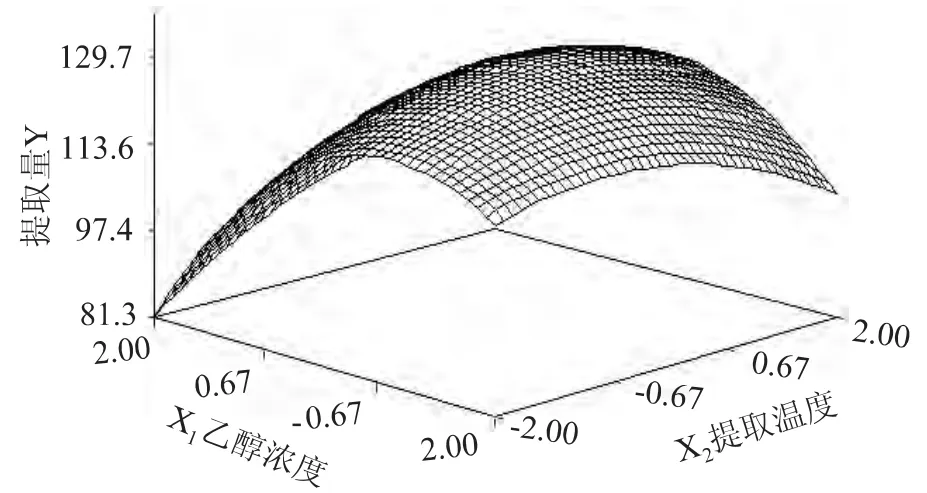
图7 乙醇浓度(X1)和提取温度(X2)对提取量(Y)的影响Fig.7 Effect of alcohol concentration and extracting temperature on extraction
2.3.2 模型的验证 在乙醇浓度为65%、提取温度为65℃、提取时间1.75h、料液比是1∶20、提取次数为3次、提取pH为7条件下进行验证实验,平行3次实验,验证实验结果分别为 128.21、129.04、128.55mg/g,平均值为128.60mg/g,相对误差为0.85%,与预测值较为接近,证明响应面分析法得到的金银花中黄酮类物质提取条件是可行的。

图8 乙醇浓度(X1)和提取时间(X3)对提取量(Y)的影响Fig.8 Effect of alcohol concentration and extracting time on extraction

图9 提取温度(X2)和提取时间(X3)对提取量(Y)的影响Fig.9 Effect of extracting temperature and extracting time on extraction
3 结论
通过单因素实验和旋转正交实验设计,金银花中黄酮类物质的最佳提取工艺条件为:乙醇浓度为65%、提取温度为65℃、提取时间1.75h、提取3次、料液比为1∶15、pH为7。在此优化的工艺条件下金银花中黄酮类物质的提取量达到128.60mg/g。
[1]Meng D S,Wang S L.Antitumor effect of quercetin[J].ChinTra-dit Herb Drugs,2001,32:186-188.
[2]王发国,叶华谷,马其侠,等.金银花及其药理作用[J].生物学通报,2004,39(5):17-18.
[3]丁利君,吴振辉,蔡创海,等.金银花中黄酮类物质最佳提取工艺的研究[J].食品科学,2002,23(2):62-66.
[4]胡普辉,杨雪红.中国金银花发展现状及对策探讨[J].陕西农业科学,2009(5):104-106.
[5]周春晖,李俊.β-环糊精辅助提取金银花中总黄酮的工艺研究[J].中成药,2010,32(10):1796-1798.
[6]李荣,胡成穆,彭磊,等.正交设计研究金银花总黄酮提取工艺[J].安徽医科大学学报,2006,41(4):410-412.
[7]李晓军.超声波辅助提取金银花中黄酮类化合物的研究[D].西安:陕西师范大学,2009:33.
[8]杨俊,张晓静,田丽娟,等.金菊双花总黄酮提取与纯化工艺研究[J].中药材,2005,28(8):703-705.
[9]余家林.农业多元实验统计[M].北京:北京农业大学出版社,1993:111-123.
[10]魏安池,代红丽.响应面分析法优化红花黄色素提取工艺条件[J].食品与机械,2006,22(2):11-13.
[11]关炳峰,谭军,周志娣.金银花提取物的抗氧化作用与其绿原酸含量的相关性研究[J].食品工业科技,2007,28(10):127-129.
[12]董发明,白喜婷.响应面法优化超声提取杜仲雄花中黄酮类化合物的工艺参数[J].食品科学,2008,29(8):227-231.
[13]何德贵,周芳勇,李仕先,等.金银花不同提取工艺及优选条件探讨[J].中国实验方剂志,2001,7(1):6-7.
[14]陈蓉,吴启南.响应面法优化芡实种皮多酚的提取工艺研究[J].食品工业科技,2013,34(13):205-210.
[15]凌关庭.抗氧化食品与健康[M].北京:化学工业出版社,2005:324-344.
