虾青素通过JNK和p38MAPK通路抑制Aβ诱导的神经毒性损伤
2014-06-28王洪权王玉敏赵伟丽张俊毅崔其福
王洪权,王玉敏,赵伟丽,张俊毅,崔其福
(赤峰学院附属医院:1. 神经内五科;2. 肿瘤内科;3. 病理科,内蒙古赤峰市 024005)
大量研究表明,氧化应激(oxidative stress, OS)损伤在阿尔茨海默病(Alzheimer’s disease, AD)的发病机制和进展中发挥着重要的作用[1]。OS与Aβ之间形成恶性循环,促进AD的发生[2-3]。鉴于OS在AD中的重要作用,因此,针对抗OS的治疗策略对AD的发生和发展是有效的治疗途径。虾青素(astaxanthin, ATX)为叶黄素类化合物,其主要存在于特定的海洋动物和植物,如鱼、虾和海藻内[4]。ATX是强效抗氧化剂,但是没有β-胡萝卜素的活性。ATX具有许多重要的生物功能[5]。最重要的是 ATX的抗氧化活性[6]。有报道显示,ATX可以在体外抑制6-羟多巴胺(6-hydroxydopamine,6-OHDA) 诱导的神经元凋亡的发生[7-8]。ATX可以通过抑制氧化应激、减少谷氨酸的释放和抗凋亡来减少脑组织因缺血引起的相关损伤[9]。前人研究表明ATX可以抑制Aβ25-35诱导的神经毒性损伤,但其机制不清楚。本研究探讨素ATX是否通过MAPK通路来抑制Aβ25-35诱导的神经毒性损伤。
1材料与方法
1.1材料Astaxanthin购自Enzo Life Sciences Int公司,MTT购自Sigma-Aldrich公司,Aβ25-35购自GL Biochem公司,H2DCF-DA购自Invitrogen公司,Rabbit anti-phospho-p38(Thr180/Tyr182)antibody(#9211),Rabbit anti-p38 antibody (#9212),Rabbit anti-phospho-SAPK/JNK(Thr183/Tyr185) antibody(#9251)和Rabbit anti-SAPK JNK antibody(#9252)购自CST公司。
1.2维状Aβ25-35的制备Aβ25-35溶于灭菌双蒸水,贮存浓度为2 mmol/L,于37 ℃条件下孵育7 d,使其纤维化。
1.3SH-SY5Y细胞培养SH-SY5Y细胞用DMEM培养基(含青霉素100 IU/mL,链霉素100 IU/mL)加入100 mL/L胎牛血清培养。于37 ℃、50 mL/L CO2条件下培养,选取对数生长期细胞进行实验。
1.4MTT检测MTT是一种四甲基偶氮哩盐,在活细胞线粒体玻拍酸脱氢酶的作用下被还原成蓝色甲攒颗粒,其形成量与活细胞数和线粒体玻拍酸脱氢酶的活性呈正相关。SH-SY5Y细胞以1×104个/孔密度接种于96孔板中,100 μL/孔。于37 ℃ 50 mL/L CO2孵箱中培养过夜。12 h后,吸弃上清液。96孔板中处理好的细胞,每孔加入20 μL(5 mg/mL)MTT,37 ℃孵育4 h,并加入150 μL DMSO,振荡8 min,待紫色结晶充分溶解后,置酶标仪上测各孔光吸收值(A)。然后以A值求细胞存活率。

1.6Westernblot法检测蛋白表达参照文献[19]的方法。
1.7统计分析结果以均数±标准误表示。资料采用GraphPad Prism 4.0 software(GraphPad Software, Inc.,San Diego, CA)分析软件进行统计分析,两组数据比较用studentttest,多样本均数比较用单因素方差分析。P<0.05被认为差异具有统计学意义。
2结果
2.1虾青素改善Aβ25-35诱导的细胞活力的降低我们首先检测ATX(分子结构式见图1)对Aβ25-35诱导的SH-SY5Y细胞活力的影响。ATX(1~10 μmol/L)预处理1.5 h后,25 μmol/L Aβ25-35处理细胞24 h(表1),Aβ25-35明显降低细胞活力。细胞活力检测显示,ATX(5和10 μmol/L)预处理组可以明显抑制Aβ25-35诱导的细胞活力的降低。

图1 虾青素的分子结构图

表1 ATX对Aβ25-35诱导的SH-SY5Y细胞存活率下降的影响
药物预处理细胞1.5 h后加入25 μmol/L Aβ25-35作用24 h;与正常对照组比较,##P<0.01;与Aβ25-35组比较,*P<0.05,**P<0.01。
2.2虾青素改善Aβ25-35对细胞内ROS产生的影响Aβ诱导的神经元损伤和死亡的机制中有氧化应激机制的参与。用荧光探针2′,7′-二氯荧光素二乙酸酯(H2DCF-DA)来检测细胞内活性氧簇ROS的聚集。H2DCF-DA进入细胞后能使细胞内的过氧化物、氢过氧化物等氧化分解为二氯荧光素(Dichlorofluorescein, DCF)而产生荧光,其荧光强度与活性氧的浓度呈线性关系。25 μmol/L Aβ25-35处理的SH-SY5Y 细胞组,其荧光强度明显增高,而ATX预处理可以剂量依赖性降低Aβ25-35引起的细胞内ROS的产生(表2)。结果表明,ATX可以抑制或清除Aβ25-35处理诱导的ROS产生。

表2 ATX对Aβ25-35诱导的SH-SY5Y细胞ROS产生的影响
药物预处理细胞4 h后加入25 μmol/L Aβ25-35作用24 h;与正常对照组比较,##P<0.01;与Aβ25-35组比较,**P<0.01。
2.3虾青素抑制Aβ25-35诱导的JNKs的激活丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)家族的激活参与氧化应激诱导的细胞死亡进程。目前,已知JNKs的激活介导Aβ诱导的细胞凋亡过程[10]。因此,我们接下来检测ATX对Aβ25-35引起的JNKs激活的影响。JNKs的苏氨酸183/酪氨酸185(Thr183/Tyr185)位点磷酸化是其激活的主要形式。用识别Phospho-SAPK/JNKs (Thr183/Tyr185) 的特异性抗体进行的分析显示,SH-SY5Y细胞经Aβ25-35作用24 h可引起JNKs(图2)的激活,而ATX预处理可以剂量依赖性抑制Aβ25-35引起的这种激活。
2.4虾青素抑制Aβ25-35诱导的p38MAPK的激活目前,已知p38MAPK的激活亦介导Aβ诱导的细胞凋亡过程[10]。因此,我们接下来检测ATX对Aβ25-35引起的p38MAPK的激活的影响。p38MAPK苏氨酸180/酪氨酸182(Thr180/Tyr182)位点磷酸化是其激活的主要形式。用识别Phospho-p38MAPK(Thr180/Tyr182)的特异性抗体进行的分析显示,SH-SY5Y细胞经Aβ25-35作用24 h可引起p38MAPK(图3)的激活,而ATX预处理可以剂量依赖性抑制Aβ25-35引起的这种激活。

图2 ATX对Aβ25-35诱导SH-SY5Y细胞中JNK激活的影响
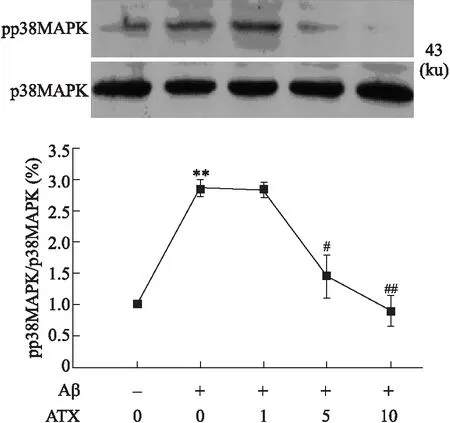
图3 ATX对Aβ25-35诱导SH-SY5Y细胞中p38MAPK激活的影响
3讨论
AD是一种老年性中枢神经系统退行性疾病,其发病率随着人口的老龄化而迅速增长。该病是老龄人口罹患痴呆最常见的原因,已成为继心血管疾病、癌症和中风之后的又一严重危害人类健康的疾患。AD的病因目前仍不明确,因此尚无确切有效的治疗方法。故探索预防和治疗AD的有效措施刻不容缓,对阿尔茨海默病的治疗有着重要的医学和社会意义。
大量研究表明,OS损伤在AD的发病机制和进展中发挥着重要的作用[1]。Aβ在特定脑区的聚集,介导OS损伤在AD的发生和进展中发挥主要的作用[1]。Aβ可以在体内和体外诱导OS[11],而OS可以增加Aβ的产生和聚集[2]。最近研究显示,OS促进Aβ的产生和聚集,反过来Aβ又诱导OS,进而增加Aβ的产生,如此在OS与Aβ之间形成恶性循环,促进AD的发生[2-3]。鉴于OS在AD中的重要作用,因此,针对抗OS的治疗策略对AD的发生和发展是有效的治疗途径。因此,一项具有广泛前景的预防和治疗AD的方法就是减弱或抑制Aβ诱导的氧化应激损伤。同时一些天然抗氧化剂,如石杉碱甲(huperzine A)[12]、姜黄(curcumin)[13],银杏(ginkgo biloba)[14]、丹参酮(tanshinone IIA)[15-16]、红景天甙(salidroside)[17]和番茄红素(lycopene)[18]和人参皂苷Rb1[20]已经证实可以抑制Aβ诱导的氧化应激损伤。
ATX其主要存在于特定的海洋动物和植物,如鱼、虾和海藻内。ATX是强效抗氧化剂,具有多种药理学作用。有报道显示,ATX可以在体外抑制6-羟多巴胺 (6-hydroxydopamine,6-OHDA)诱导的神经元凋亡的发生。ATX可以通过抑制氧化应激、减少谷氨酸的释放和抗凋亡来减少脑组织因缺血引起的相关损伤。同时,ATX在AD中的作用引起了研究者的关注。研究表明,ATX前人研究表明ATX可以抑制Aβ25-35诱导的神经毒性损伤,但其机制尚不清楚。本研究表明ATX可以通过抗氧化机制抑制Aβ25-35诱导的神经毒性损伤。许多研究表明,OS参与Aβ诱导的神经细胞损伤机制,ROS产生介导Aβ损伤机制。本研究表明,ATX可以抑制Aβ25-35诱导的细胞内ROS的过度产生(表2)。OS是MAPK激酶激活的主要刺激因素,是MAPK激酶激活参与凋亡的信号转导通路。研究显示JNK和p38 MAPK的激活与细胞毒性损伤相关,Aβ可促进二者的激活进而诱导神经毒性损伤的发生。本研显示Aβ25-35激活JNK和p38 MAPK,而ATX可以剂量依赖性抑制Aβ25-35诱导的JNK(图2)和p38 MAPK(图3)激活。这一结果表明,ATX通过抑制JNK和p38 MAPK激活,进而抑制Aβ25-35诱导的细胞损伤。
总之,我们的研究表明虾青素可以抑制Aβ25-35引起的ROS的产生增加,进而抑制JNK和p38 MAPK激活,从而发挥其神经保护作用。在AD中具有神经保护作用,这种保护机制与其抑制JNK和p38MAPK的激活有关。本研究为探讨虾青素作为AD的潜在预防和治疗药物奠定了坚实的实验基础。
参考文献:
[1] BUTTERFIELD D, DRAKE J, POCERNICH C, et al. Evidence of oxidative damage in Alzheimer's disease brain: central role for amyloid beta-peptide[J]. Trends Mol Med, 2001, 7(12):548-554.
[2] TAMAGNO E, GUGLIELMTTO M, ARAGNO M, et al. Oxidative stress activates a positive feedback between the gamma- and beta-secretase cleavages of the beta-amyloid precursor protein[J]. J Neurochem, 2008, 104(3):683-695.
[3] SHEN C, CHEN Y, LIU H, et al. Hydrogen peroxide promotes Abeta production through JNK-dependent activation of gamma-secretase[J]. J Biol Chem, 2008, 283(25):17721-17730.
[4] LAI J, JIANG Y, HE X, et al. Separation and determination of astaxanthin from microalgal and yeast samples by molecularly imprinted microspheres[J]. J Chromatogr B, 2004, 804(1):25-30.
[5] HUSSEIN G, SANKAWA U, GOTO H, et al. Astaxanthin, a carotenoid with potential in human health and nutrition[J]. J Nat Prod, 2006, 69(3):443-449.
[6] GUERIN M, HUNTLY M, OLAIZOLA M. Haematococcus astaxanthin: applications for human health and nutrition[J]. Trends Biotechnol, 2003, 21(5):210-216.
[7] IKEDA Y, TSUJI S, SATOH A, et al. Protective effects of astaxanthin on 6-hydroxydopamine-induced apoptosis in human neuroblastoma SH-SY5Y cells[J]. J Neurochem, 2008, 107(6):1730-1740.
[8] LIU X, SHIBATA T, HISAKA S, et al. Astaxanthin inhibits reactive oxygen species-mediated cellular toxicity in dopaminergic SH-SY5Y cells via mitochondria-targeted protective mechanism[J]. Brain Res, 2009, 1254(3):18-27.
[9] SHEN H, KUO C, CHOU J, et al. Astaxanthin reduces ischemic brain injury in adult rats[J]. FASEB J, 2009, 23(6):1958-1968.
[10] TAMAGNO E, ROBINO G, OBBILI A, et al. H2O2and 4-hydroxynonenal mediate amyloid beta-induced neuronal apoptosis by activating JNKs and p38MAPK[J]. Exp Neurol, 2003, 180(2):144-155.
[11] HENSLEY K, CARNEY J, MATTSON M, et al. A model for beta-amyloid aggregation and neurotoxicity based on free radical generation by the peptide: relevance to Alzheimer disease[J]. Proc Natl Acad Sci USA, 1994, 91(8):3270-3274.
[12] XIAO X, ZHANG H, TANG X. Huperzine A attenuates amyloid beta-peptide fragment 25-35-induced apoptosis in rat cortical neurons via inhibiting reactive oxygen species formation and caspase-3 activation[J]. J Neurosci Res, 2002, 67(1):30-36.
[13] PARK S, KIM H, CHO E, et al. Curcumin protected PC12 cells against beta-amyloid-induced toxicity through the inhibition of oxidative damage and tau hyperphosphorylation[J]. Food Chem Toxicol, 2008, 46(8):2881-2887.
[14] YAO Z, DIEU K, PAPADOPOULOS V. The Ginkgo biloba extract EGb 761 rescues the PC12 neuronal cells from beta-amyloid-induced cell death by inhibiting the formation of beta-amyloid-derived diffusible neurotoxic ligands[J]. Brain Res, 2001, 889(1-2):181-190.
[15] SHI LL, YANG WN, CHEN XL, et al. The protective effects of tanshinone IIA on neurotoxicity induced by beta-amyloid protein through calpain and the p35/Cdk5 pathway in primary cortical neurons[J]. Neurochem Int, 2012, 61(2):227-235.
[16] QIAN YH, XIAO Q, XU J. The protective effects of tanshinone IIA on beta-amyloid protein (1-42)-induced cytotoxicity via activation of the Bcl-xL pathway in neuron[J]. Brain Res Bull, 2012, 88(4):354-358.
[17] ZHANG L, YU H, ZHAO X, et al. Neuroprotective effects of salidroside against beta-amyloid-induced oxidative stress in SH-SY5Y human neuroblastoma cells[J]. Neurochem Int, 2010, 57(5):547-555.
[18] QU M, LI L, CHEN C, et al. Protective effects of lycopene against amyloid beta-induced neurotoxicity in cultured rat cortical neurons[J]. Neurosci Lett, 2011, 505(3):286-290.
[19] 王翔宇,杨红卫,梅元武. 姜黄素对多巴胺诱导PC12细胞凋亡的保护作用[J]. 西安交通大学学报:医学版, 2013, 34(1):115-117.
[20] 王洪财,蒋玉萌,赵雪,等. 人参皂苷Rb1对Aβ淀粉样蛋白诱导大鼠海马神经元损伤的保护作用[J]. 吉林大学学报:医学版, 2012, 38(3):447-450.
