一种电击转化枯草芽孢杆菌方法的优化
2014-06-27张爽薛正莲陈环苏燕南王洲
张爽,薛正莲,陈环,苏燕南,王洲
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
一种电击转化枯草芽孢杆菌方法的优化
张爽,薛正莲,陈环,苏燕南,王洲
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
提出了一种电击转化枯草芽孢杆菌的方法。该方法通过调节细胞培养和电击转化过程中培养基和溶液成分来调节细胞渗透压,提高细胞在高电场强度电击后的存活率而达到提高转化效率的目的。优化前的转化率为5.0×105cfu/μg,经优化后转化效率可达8×106cfu/ μg,比优化前提高了15倍。
枯草芽孢杆菌;电击转化;转化率
枯草芽孢杆菌(Bacillus subtilis)是一种重要的工业微生物,其遗传学和生理学特性已得到深入研究[1],人们对其遗传背景和生理特性的了解仅次于E.coli[2]。枯草芽孢杆菌能直接将目的基因产物分泌到培养基中,且表达产物可溶、可正确折叠,具有生物活性,同时表达产物与胞内蛋白分离,无需破碎细胞,利于分离纯化,是极具应用前景的基因表达宿主[2]。
但是,在枯草芽孢杆菌工程菌构建过程中,能自发形成感受态的菌株极少,且感受态持续时间短暂,分子克隆效率低,从而限制了外源蛋白在枯草芽孢杆菌中的高效表达[3]。目前外源基因导入宿主菌的主要手段有感受态法[4]、原生质体转化法[5]和电击转化法[6]。其中,电击转化法被认为是转化效率最高的一种方法。然而,电击转化过程中需要平衡转化效率和死亡率的关系,随着电场强度的增加,外源DNA进入宿主细胞的可能性越大,死亡率也随之增加。陆雁等[7]以不同预培养时间优化复制子转化至枯草芽孢杆菌WB600中,最高转化率为2.58×104cfu/μg;王培培等[8]对枯草芽孢杆菌NCD电转化条件进行优化,最高效率为6.07×104cfu/μg;而目前芽孢杆菌电击转化的转化效率最高为1.4×106cfu/μg[9-10],还不能满足高效率转化,如构建基因文库的要求。本实验通过对枯草芽孢杆菌制备感受态时生长状态、穿梭载体加入量、回复培养基、电击转化缓冲液以及电击时电压的选择等方面条件的优化,使枯草芽孢杆菌的转化率增大,为后续实验奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
枯草芽孢杆菌WB600、大肠杆菌JM109、穿梭载体pHY-p43均由江南大学生物工程学院余晓斌教授(实验室)惠赠;分子生物学试剂及试剂盒均购买于生工生物(上海)股份有限公司,其他试剂均为国产分析纯。
1.1.2 培养基
LB液体培养基的制备方法:胰蛋白胨质量浓度为10 g/L,酵母提取物质量浓度为5 g/L,氯化钠质量浓度为10 g/L,pH值为7.2。
LB固体培养基的制备方法:胰蛋白胨质量浓度为10 g/L,酵母提取物质量浓度为5 g/L,氯化钠(NaCl)质量浓度为10 g/L,琼脂粉质量浓度为1.5 g/L,pH值为7.2。
SLB培养基的制备方法:蛋白胨质量浓度为10 g/L,酵母粉质量浓度为5 g/L,NaCl质量浓度为10 g/L,山梨醇的浓度为0.5mol/L,pH值为7.2。
ORM培养基的制备方法:蛋白胨质量浓度为10 g/L,酵母粉质量浓度为5 g/L,NaCl质量浓度为10 g/L,山梨醇的浓度为0.8 mol/L,pH值为7.2。
RM培养基的制备方法:蛋白胨质量浓度为10 g/L,酵母粉质量浓度为5 g/L,NaCl质量浓度为10 g/L,山梨醇的浓度为0.5 mol/L,pH值为7.2。
1.1.3 试剂
氨苄青霉素:储存浓度为50 mg/mL,工作浓度为50 μg/mL;
四环素:储存浓度为5 mg/mL,工作浓度为50 μg/mL;
SMG缓冲液:0.5 mol/L山梨醇,0.5 mol/L甘露醇,10 g/L甘油。使用去离子水配制,121℃灭菌20 min;
SG缓冲液:0.5 mol/L山梨醇,10 g/L甘油,使用去离子水配制,121℃灭菌20 min;
MG缓冲液:0.5 mol/L甘露醇,10 g/L甘油,使用去离子水配制,121℃灭菌20 min;
Gly缓冲液:10 g/L甘油,使用去离子水配制,121℃灭菌20 min。
1.2 枯草芽孢杆菌制备
从4℃冰箱中取出保藏的枯草芽孢杆菌WB600,活化菌株;用移液枪吸取1 mL过夜培养物在无菌净化台接种于40 mL SLB培养基中,37℃,200 r/min振荡培养至OD600nm=0.7;将菌液冰水浴10 min后,放入离心管中,4℃,5 000 r/min离心5 min,弃上清,收集细胞;在无菌净化台上用0℃预冷的40 mL SMG缓冲液通过移液枪吹悬步收集的细胞,4℃,5 000 r/min离心5 min,弃上清,收集细胞,漂洗4次;用2 mL SMG缓冲液吹悬收集的细胞,分装于离心管(60 μL/管)中,-80℃保存,每管约有6×108个感受态细胞。
1.3 电击转化
取50 ng pHY-P43质粒DNA,加入到1管感受态细胞中,在冰上通过移液枪轻微吐吸使pHY-P43质粒DNA和感受态细胞充分混匀,冰浴2 min;将体系转移至0℃预冷的电击杯(1 mm)中,用电转仪进行电击(电压21 kV/cm,电容25 μF,电阻200 Ω,电击1次,时间常数=5 ms);立即向电击杯中加入1 mL ORM培养基,通过移液枪反复轻轻吹打混匀;将电击杯中的菌液全部吸出至离心管中,37℃,200 r/min振荡培养2小时后,将培养体系涂布于含有氨苄青霉素和四环素的LB固体培养基平板,37℃,过夜培养。然后随机挑取生长出来的单克隆,提取质粒琼脂糖凝胶电泳,在5 kb左右可见清晰的质粒条带,说明验证转化成功。计数菌落,计算转化率,转化率为每μg质粒DNA产生的转化子数。
2 结果与讨论
2.1 枯草芽孢杆菌转化子的验证
根据1.4节的步骤将pHY-p43转化至WB600中,电击后涂布在含有终浓度为50 μg/mL氨苄青霉素和50 μg/mL四环素的LB固体培养基平板,37℃,过夜培养。然后随机挑取生长出来的单克隆,提取质粒琼脂糖凝胶电泳。电泳结果如图1所示,在5 kb左右有清晰可见的质粒的条带,说明转化成功。在平板上计数转化子数量,平均转化率为5.0×105cfu/μg。

图1 转化子的PCR验证电泳结果
2.2 枯草芽孢杆菌细胞生长OD值的优化
为了考察枯草芽孢杆菌不同的生长状态对感受态的制备和后期转化的影响,培养细胞OD600值分别为0.3,0.5,0.7,0.9,1.1,1.3和1.5时,收集细胞,根据感受态制备方法,制备不同生长时期的感受态。将穿梭载体pHY-p43 50 ng通过电击转化至感受态细胞中,涂布于氨苄青霉素和四环素的LB固体培养基平板,计数转化菌落,计算转化率。由图2可知:当OD600值为0.7时,转化率达到最高,平均为9.8×105cfu/μg。

图2 不同生长OD值对转化率的影响
2.3 穿梭载体加入量的优化
在优化穿梭载体加入量的影响时,选择了枯草芽孢杆菌生长OD值为0.7时制备感受态。在点击转化中分别加入20,40,60,80,100和120 ng的穿梭载体pHY-p43,再进行电击转化,计算转化率。由图3可知:当穿梭载体的加入量为80 ng以上时,转化达到平衡为2.3×106cfu/μg,所以最终选择的载体的加入量为80 ng。
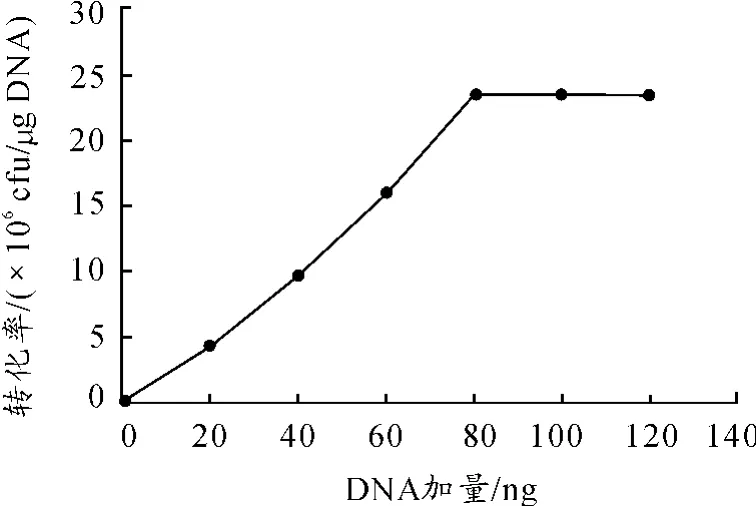
图3 不同载体加入量对转化率的影响
2.4 电击后回复培养基的优化
在OD600值为0.7时收集细胞用于感受态细胞的制备,在电击转化步骤时加入80 ng的穿梭载体进行电转化;电击完成后向电击杯中加入1 mL回复培养基,选择的山梨醇浓度分别为0.2,0.4,0.6,0.8,1和1.2 mol/L,其余实验条件与优化前相同。实验结果如图4所示:当山梨醇浓度为0.8 mol/L时,转化率达到最大值为3.1×106cfu/μg;当山梨醇的浓度大于0.8 mol/L时,转化效率快速下降,这可能是因为山梨醇浓度过大影响了细胞的渗透压。
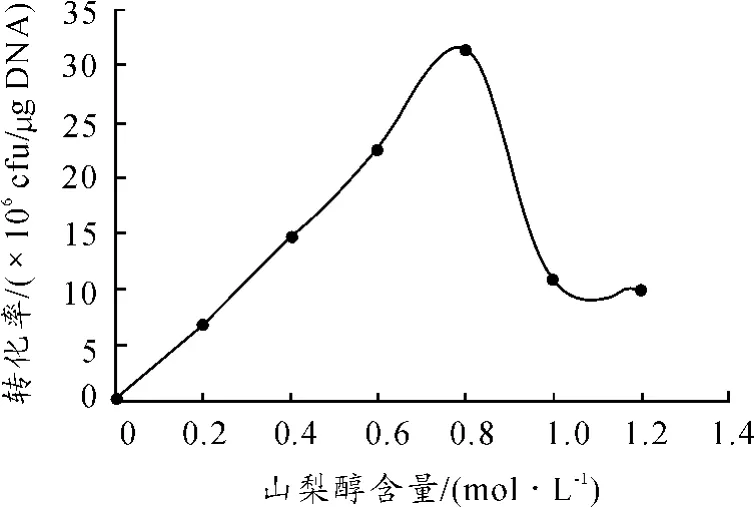
图4 山梨醇含量对转化率的影响
2.5 电击转化缓冲液的优化
在OD600值为0.7时收集细胞用于感受态细胞的制备,在电击转化步骤时加入80 ng的穿梭载体进行电转化;电击完成后向电击杯中加入1mL回复培养基,回复培养基中山梨醇浓度为0.8 mol/L,选择不同的电击转化缓冲液:SMG、SG、MG、Gly,其余实验条件与优化前相同,如图5所示。结果表明:使用SMG缓冲液作为电转缓冲液时转化率最高,可达4.5×106cfu/μg。

图5 不同电击转化缓冲液对转化率的影响
2.6 电击时电压的优化
在OD600值为0.7时收集细胞用于感受态细胞的制备,将制备的感受态细胞用SMG缓冲液重悬,在电击转化步骤时加入80 ng的穿梭载体进行电转化;电击完成后向电击杯中加入1 mL回复培养基,其中的山梨醇浓度为0.8 mol/L。选择不同的电压进行电转化操作:12 kV/cm、15 kV/cm、18 kV/cm、21 kV/cm、24 kV/cm,其余实验条件与优化前相同。由图5可知:在电压为21 kv/cm时转化率最高,为8.0×106cfu/μg。

图6 不同电压对转化率的影响
3 结束语
当细胞生长OD600值为0.7、质粒DNA加量为80 ng、回复培养基山梨醇浓度为0.8mol/L、电转缓冲液为SGM以及电场强度为21 kv/cm时,枯草芽孢杆菌转化率最高。经实验可知,其最高转化率为8.0×106cfu/μg,比报道技术效率高4.71倍。该方法为枯草芽孢杆菌的基因工程育种、遗传学以及分子生物学研究提供了参考。
[1]李明,双宝,李海涛,等.枯草芽孢杆菌的研究与应用[J].东北农业大学学报,2009,40(9):111-113.
[2]Tjalsma H,Antelmann H,Jongbloed J D H,et al.Proteomics of Protein Secretion by Bacillus subtilis:Separating the“secrets”of the Secretome[J].Microbiology and Molecular Biology Reviews,2004,68(2):207-233.
[3]Gary M D,Linda N L,Donald J L.Improved electroporation and cloning vector syst em for gram-positive bact eria [J].Applied and Environmental Microbiology,1991,57 (4):1194-1201.
[4]李瑞芳,薛雯雯,黄亮熊,等.枯草芽孢杆菌感受态细胞的制备及质粒转化方法研究[J].生物技术通报,2011(5):227-230.
[5]胡欣荣.利用原生质体融合技术选育高纤维素酶活枯草芽孢杆菌的研究[D].西安:西北大学,2006.
[6]陈涛,王靖宇,班睿,等.枯草芽孢杆菌感受态研究新进展[J].生命的化学,2004,24(2):130-134.
[7]陆雁,王青艳,朱绮霞,等.枯草芽孢杆菌高效转化及其转化子的验证方式[J].广西科学院学报,2012,28 (2)117-119.
[8]王培培,郭庆港、李社增,等.枯草芽孢杆菌NCD-2菌株的高效电击转化[J].中国生物防治学报,2012,27(3)368-372.
[9]Xue G P,Jennifer S J,Brian P D,et al.High osmolarity improves the electro-transformat ion efficiency of the gram-positive bacteria Bacillus subtilis and lichenif ormis [J].Journal of Microbiological Methods,1999,34:183-191.
[10]Kiers J L,Van Laeken A E A,Rombouts FM,et al,In vitro digestibility of Bacillus fermented soya bean[J].Internatonal Journal of Food Microbiology,2000,60:163 -169.
(责任编辑 何杰玲)
Optimization of a Method about Electro-transformation in Bacillus Subtilis
ZHANG Shuang,XUE Zheng-lian,CHEN Huan,SU Yan-nan,WANG Zhou
(Institute of Biologic&Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China)
This article provides a method of electro-transformation in Bacillus Subtilis.This method is to regulate cell osmotic pressure and solution composition by regulating cell culture and shock in the process of transformation medium,for improving the survival rate after cells in high electric field intensity of electric shock and achieving the goal that improve the transformation efficiency.The transformation rate is 5.0×105cfu/μg before optimizing.After optimizing,the transformation efficiency is up to 8×106cfu/μg,being 15 times higher than before optimization.It greatly promotes the conversion efficiency.
Bacillus subtilis;electro-transformation;transformation efficiency
Q785
A
1674-8425(2014)08-0060-04
10.3969/j.issn.1674-8425(z).2014.08.013
2014-04-08
安徽省自然科学基金项目(11040606M81);安徽省高校自然科学基金项目(KJ2009A168)
张爽(1989—),女,安徽宿州人,硕士研究生,主要从事微生物学研究;通讯作者薛正莲(1967—),女,安徽巢湖人,硕士,教授,主要从事酶工程研究。
张爽,薛正莲,陈环,等.一种电击转化枯草芽孢杆菌方法的优化[J].重庆理工大学学报:自然科学版,2014 (8):60-63.
format:ZHANG Shuang,XUE Zheng-lian,CHEN Huan,et al.Optimization of a Method about Electro-transformation in Bacillus Subtilis[J].Journal of Chongqing University of Technology:Natural Science,2014(8):60-63.
