金钱鱼脑型芳香化酶基因cDNA的克隆及表达分析
2014-06-26张敏智李广丽朱春华邓思平
张敏智,李广丽,朱春华,邓思平
(广东海洋大学 水产学院 南海水产经济动物增养殖广东普通高校重点实验室, 广东 湛江,524088)
金钱鱼(Scatophagus argue Linnaeus)又名金鼓鱼,隶属鲈形目 (Perciformes)金钱鱼科(Scatophagidae),金钱鱼属(Scatophagus)。国际上金钱鱼科仅金钱鱼1属 3 种,为广盐性亚热带鱼类,广泛分布于印度-太平洋水域[1],中国东南沿海及北部湾均有分布,其中在广东、台湾及广西沿岸为常见的鱼类。目前,金钱鱼大部分养殖种苗仍然来自野生资源,数量有限且呈逐年减少之势,市场对人工种苗的需求量逐渐增大。但人工繁育过程中金钱鱼卵巢不能充分成熟,且雄性性成熟早于雌性[2],为人工繁殖金钱鱼带来困难。因此,人工诱导金钱鱼卵巢发育是解决金钱鱼大批量苗种生产的关键所在。
在大多数哺乳动物中,芳香化酶由 Cyp19单基因编码,但在硬骨鱼类中却发现了两种芳香化酶基因,即脑型芳香化酶(Cyp19a1b)和性腺型芳香化酶(Cyp19a1a),分别以明显不同的形式存在于脑和性腺中[3-4]。研究表明,芳香化酶可影响哺乳动物中枢神经系统的发育和功能,调节神经内分泌和繁殖功能[5]。有报道指出[6]芳香化酶与性取向有关,若雌性先熟则芳香化酶的表达量减少,而雄性先熟则表达量增加。此外,芳香化酶的表达及其酶活性可受性类固醇激素和促性腺激素等的调控[7],也受到温度等环境因素的控制和调节[8]。研究发现, 性类固醇激素(E2)先与芳香化酶神经样细胞上的雌激素受体结合,而后激发芳香化酶基因的表达[9-10]。Carlos[11]证实,促性腺激素中卵泡刺激素(FSH)和黄体生成素(LH)是调节芳香化酶活性的重要因子。FSH可诱导产生芳香化酶,而 LH通过增加胞内环磷酸腺苷(cAMP)浓度活化蛋白激酶 C(PKC),PKC的活化则会阻碍FSH诱导产生芳香化酶。温度对鱼类性腺发育成熟过程的效应则有以下几点: (1)直接影响一些酶和激素的活性,进而影响性腺的发育;(2)影响性腺对促性腺激素(GtH)的敏感性;(3)影响脑垂体对 GtH的合成及分泌。在尖纹鲈(Lates calcarifer)[12]和半滑舌鳎(Cynoglossus semilaevis)[13]等的研究中都表明高温将抑制Cyp19a1b基因的表达。然而,迄今为止,有关鱼油对芳香化酶Cyp19的影响,以及温度和饲料中鱼油含量对金钱鱼卵巢发育相关基因的研究尚未见报道。
本研究采用 RT-PCR和 RACE法,克隆金钱鱼Cyp19a1b的cDNA全长,并采用实时荧光定量PCR检测了温度和鱼油处理后雌性金钱鱼脑垂体中Cyp19a1b mRNA的表达,旨在探讨 Cyp19a1b基因表达与温度及鱼油添加量的相互关系,为金钱鱼人工繁育奠定理论基础。
1 材料与方法
1.1 实验鱼
基因克隆所用金钱鱼购自湛江市霞山水产品批发市场,为雌性性成熟个体;温度和鱼油处理实验所用鱼均购自于广东省珠海市龙胜鱼苗培育基地,为二龄雌性金钱鱼(体质量: (316.3±70.3)g,体长:(21.4±2.0)cm),昼夜充氧,水体盐度为 10±2,自然光照,每日傍晚投喂1次。
1.2 实验方法
1.2.1 引物
简并引物P1和P2根据GenBank中已有鱼类脑型芳香化酶Cyp19a1b保守序列设计;特异性引物P3和 P4根据获得的 Cyp19a1b基因保守区片段设计,以检测温度和鱼油对雌性金钱鱼脑垂体中Cyp19a1b mRNA表达的影响;根据已知片段设计特异性引物BGSP1、NBGSP1和 BGSP2,其中 BGSP1、NBGSP1通过巢式PCR来扩增Cyp19a1b cDNA的5′末端,而BGSP2 用来扩增其 3′末端;β-actinF 和 β-actinR 作为内参引物扩增金钱鱼的 β-actin基因,以校正Cyp19a1b mRNA的相对表达量,所有引物见表 1,均由上海生工生物工程公司合成。
1.2.2 金钱鱼Cyp19a1b cDNA的扩增与克隆
取雌性金钱鱼脑垂体,抽提总 RNA,实验流程参照Trizol Reagent (Invitrogen)说明书操作。取2 μg总RNA按照M-MLV Reverse Transcriptase反转录试剂盒(Promega)合成cDNA第一链,以简并引物(P1和P2)扩增金钱鱼 Cyp19a1b 基因保守区片段。采用SMARTer RACE试剂盒(Clontech)克隆金钱鱼Cyp19a1b cDNA 3′末端和5′末端序列,按照SMARTer RACE试剂盒说明操作进行扩增。PCR产物于 1.2%琼脂糖凝胶上进行电泳,切下目的条带,用DC3511琼脂糖DNA胶回收试剂盒(Biomiga)纯化PCR产物。再将纯化的产物与载体pMD-19T按9︰1的比例进行连接反应。最后取连接产物 10 μL用于转化到DH5α中,进而恒温培养、阳性克隆以及测序,测序在上海生工生物工程公司完成。
1.2.3 序列分析与进化树的构建
应用 DNAMAN 5.0将测序所得保守区片段序列、5′端序列及3′端序列进行拼接,并推导氨基酸序列。将获得的 cDNA序列与 GenBank中已有鱼类Cyp19a1 cDNA序列进行相似性检索比对,应用CLUSTAL W将推导的氨基酸序列与GenBank中已有鱼类的 Cyp19a1氨基酸序列进行同源性比较。采用SignalP4.1server(http: //www.cbs.dtu.dk/ services/SignalP/)预测金钱鱼Cyp19a1b蛋白序列的信号肽。利用 MEGA5.0邻位相联法(Neighbor-joining),重复1000次,gap处理为缺失,基于Cyp19a1氨基酸序列构建各物种系统进化树。

表1 克隆金钱鱼Cyp19a1b cDNA序列及检测表达所用引物Tab.1 Primers used for cloning and expression analysis of Cyp19a1b in S.argus
1.2.4 温度和鱼油对金钱鱼脑垂体中 Cyp19a1b mRNA表达的影响
温度处理和鱼油处理实验均分为 3组,其中因金钱鱼适宜生长温度范围为 20~28℃,故温度处理实验鱼分别饲养在水温为 23、26和 29℃(加热棒控制)的塑料桶(500 L)中,各温度组温差范围控制在±1℃(温度计实时监测);鱼油处理实验鱼饲养在(1 m×1 m×2 m)的网箱中,分别投喂含0、2%和6%鱼油的海水鱼配制饲料(根据海水鱼配制饲料配方进行配制)。温度处理(3周和6周)、鱼油投喂处理(4周和8周)以及实验前(0周)时,每组随机取3尾鱼脑垂体组织,分别抽提总RNA。取2 μg RNA进行反转录,合成cDNA 第一链。取反转录产物 0.8 μL,荧光实时定量PCR检测Cyp19a1b mRNA的表达,实验流程参照荧光实时定量PCR测定试剂盒(BioRad)操作说明进行。
1.3 数据分析
运用 2ΔCt法计算Cyp19a1b和β-actin在金钱鱼脑垂体组织在温度和鱼油处理过程的表达量;采用SPSS 17.0统计软件中单因素方差分析(ANOVA)对数据进行分析,当 P<0.05时视为差异显著;并采用Duncan’s方法进行多重比较分析,数据均以平均值±标准误(± S.E.)表示。
2 结果与分析
2.1 金钱鱼Cyp19a1b基因全长 cDNA克隆
通过3个有重叠部分的PCR片段拼接获得金钱鱼Cyp19a1b cDNA全长。其中中间片段以雌性金钱鱼脑垂体中抽提的总 RNA为模板,利用 Cyp19a1b高度保守序列设计的简并引物P1和P2进行扩增,得到大小为 464bp的预期片段;利用特异性引物BGSP2和BGSP1、NBGSP1进行SMART-RACE-PCR,分别获得3′末端1249 bp及5′末端1187bp的预期条带,拼接后得到金钱鱼Cyp19a1b cDNA全长(登录号:JX841314)。金钱鱼Cyp19a1b cDNA 序列由2409个核苷酸组成,其开放阅读框(ORF)包含 1506 bp,编码 501个氨基酸,5′端非编码区(5′-UTR)有 164bp,3′-UTR(不包括 poly(A))有 712 bp(图 1),推测其蛋白质分子量为 56.697kDa。利用 SignalP对金钱鱼Cyp19a1b蛋白序列序列在线搜索,寻找信号肽序列,发现该蛋白存在信号肽的概率极低,不存在信号肽酶切位点,是一种非分泌蛋白。
2.2 序列分析与进化树的构建
金钱鱼Cyp19a1b cDNA序列与GenBank中已有鱼类 Cyp19a1 cDNA序列相似性检索比对显示,所获得序列与鱼类 Cyp19a1b cDNA序列的同源性为70%~87%,与Cyp19a1a同源性低于56%。氨基酸序列比对显示,金钱鱼 Cyp19a1b与黄锡鲷(Rhabdosargus sarba)和舌齿鲈(Dicentrarchus labrax)Cyp19a1b同源性较高,分别为86.2%、86.5%。与鲤鱼(Cyprinus carpio)、稀有 鲫(Gobiocypris rarus)、斑马鱼(Danio rerio)、赤点石斑鱼(Epinephelus akaara)、大黄鱼(Larimichthys crocea)、南方大口鲶(S.meridionalis)和鲻鱼(Mugil cephalus)Cyp19a1b 同源性为64.1%~84.4%,而与上述7种鱼Cyp19a1a 同源性低于 63.5%。与本实验室研究的胡子鲇(Clarias fuscus)Cyp19a1b同源性也达到了70.8%。此外,金钱鱼Cyp19a1b与人和家鼠脑型芳香化酶的亲缘关系最远,分别仅为52%和50.8%的同源性。与其他脊椎动物芳香化酶相似,金钱鱼Cyp19a1b也包含 I-螺旋区(I-helix region)、芳香化酶特异保守区Ⅱ(aromatase specific substrate binding region)和血红素结合区Ⅲ(heme-binding region)(图 2)。
摘录Genebank中大黄鱼Cyp19a1b(ACO350-42.1)、大黄鱼 Cyp19a1a (ACO35041.1)、斑马鱼 Cyp19a1b(AAK00642.1)、斑马鱼 Cyp19a1a (AAG-12243.1)、鲤鱼 Cyp19a1b (ACC95443.1)、鲤鱼 Cyp19a1a(ACB13197.1)、赤点石斑鱼 Cyp19a1b(A-AS58447.1)、赤点石斑鱼Cyp19a1a (AAS58448.1)、稀有 鲫Cyp19a1b(ADB44882.1)、稀有 鲫 Cyp19a1a(ADB29065.1)、舌齿鲈 Cyp19a1b(AAM-95455.1)、黄锡鲷 Cyp19a-1b(ABC70868.1)、细棘海猪鱼(Halichoeres tenuispinis)Cyp19a1a(AAR3704-8.1)和鲻鱼 Cyp19a1a(AAW7-2732.1)、胡子鲇Cyp19a1b (AFB77217.1)、南方大口鲇Cyp19a1a (AAP83133.1)的氨基酸序列构建氨基酸进化树,结果显示: 所有鱼类 Cyp19a1b聚为一类,而Cyp19a1a则聚为另一类。金钱鱼Cyp19a1b与黄锡鲷 Cyp19a1b同处于 Cyp19a1b一支,与大黄鱼、舌齿鲈和赤点石斑鱼Cyp19a1b同处于Cyp19a1b一大支,均属鲈形目不同亚目,而与斑马鱼、鲤鱼、稀有 鲫和胡子鲇 Cyp19a1b处于不同级不同分支,表明金钱鱼与黄锡鲷亲缘关系最近,与鲤形目中斑马鱼、鲤鱼、稀有鲫以及鲇形目的胡子鲇亲缘关系最远,分析结果与根据传统形态学和生化特征分类的结果相一致(图3)。

图1 金钱鱼Cyp19a1b全长cDNA序列及编码的氨基酸序列Fig.1 cDNA sequence and predicted amino-acid sequences of Cyp19a1b in S.argus

图2 金钱鱼脑型芳香化酶与其他脊椎动物芳香化酶部分氨基酸序列的比较Fig.2 Alignment of S.argus Cyp19a1b partial amino acid sequence and those of other species
2.3 温度对雌性金钱鱼脑垂体中 Cyp19a1b mRNA表达的影响
随处理时间的延长,26℃和29℃组金钱鱼脑垂体中Cyp19a1b mRNA的表达量都逐渐降低,但29℃组显著低于26℃组(P<0.05)。此外,23℃组表达量先减小后增加,且在 6周时显著高于 26℃和 29℃组(P<0.05),其表达量大约为26℃组2倍(图4)。
2.4 鱼油含量对雌性金钱鱼脑垂体中Cyp19a1b mRNA表达的影响
随着投喂时间的延长,3个鱼油投喂组脑垂体中Cyp19a1b mRNA的表达量均逐渐降低,鱼油对金钱鱼脑垂体中Cyp19a1b mRNA的表达量无显著影响(P >0.05)(图 5)。
3 讨论
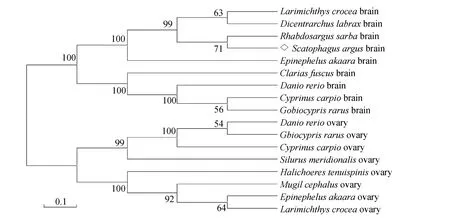
图3 基于NJ法构建的金钱鱼Cyp19a1b和其他鱼类的Cyp19a1系统进化树Fig.3 Phylogenetic tree of Cyp19a1b in S.argus and Cyp19a1 in other fish based on NJ method
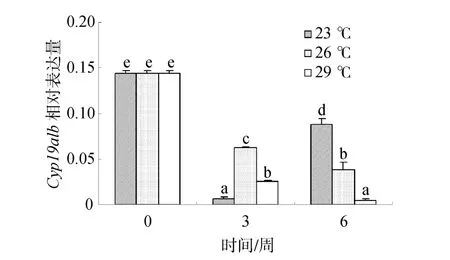
图4 温度对雌性金钱鱼脑垂体中Cyp19a1b mRNA表达的影响(n=3)Fig.4 Effects of temperature on pituitary Cyp19a1b mRNA expression in female S.argus (n=3)
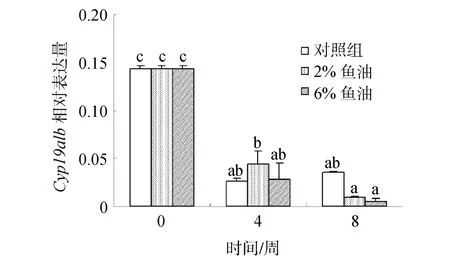
图5 鱼油对雌性金钱鱼脑垂体中Cyp19a1b mRNA表达的影响(n=3)Fig.5 Effects of fish oil on pituitary Cyp19a1b mRNA expression in female S.argus (n=3)
芳香化酶(Cyp19a1)研究的代表类群从文昌鱼(Branchiostoma)到人,表明Cyp19a1是一个在进化上起源早于脊椎动物的保守基因[14]。目前,在鱼类[15,16]、鸟类[17]、啮齿动物[18]和哺乳动物[19]的Cyp19a1 cDNA都已成功被克隆。本研究从金钱鱼脑垂体中成功克隆了脑型芳香化酶基因 Cyp19a1b,通过氨基酸序列的同源性及系统进化树分析可知,金钱鱼 Cyp19a1b与其他鱼类的Cyp19a1b同源性较高且聚为一支,与其他鱼类的性腺型芳香化酶基因 Cyp19a1a 同源性较低。因此,所获得的金钱鱼 Cyp19a1属于鱼类Cyp19a1b,与同为鲈形目的黄锡鲷同源性最高,亲缘关系最近,与鲤形目(Cypriniformes)中斑马鱼、鲤鱼、稀有 鲫以及鲇形目(Siluriformes)的胡子鲇亲缘关系最远,分析结果与根据传统形态学和生化特征分类的结果相一致。
在真核生物中,芳香化酶作为 1种膜结合蛋白,决定其定位在线粒体上还是内膜系统中,主要依赖于 N端信号序列。本研究中,通过在线对金钱鱼脑型芳香化酶信号肽进行预测分析发现,该蛋白存在信号肽的概率极低,不存在信号肽酶切位点,为非分泌型蛋白,可将其定位于线粒体内膜上。芳香化酶主要功能除了决定性别分化的方向外,对性腺发育也有显著影响[5,20]。有报道指出,脑芳香化酶可能参与脑-脑垂体-性腺轴的繁殖生理活动[21]。
大量研究表明,Cyp19a1b在硬骨鱼脑垂体中有较高的表达量,如胡子鲇[22]、虹鳟[23](Oncorhynchus mykisss)和欧洲舌齿鲈[24](Dicent rarchus labrax)等。因此,本研究采用实时荧光定量 PCR检测温度和鱼油处理后Cyp19a1b mRNA在脑垂体的表达,进而探讨温度和鱼油添加量与Cyp19a1b的关系。目前,关于温度对性腺型芳香化酶的报道较多,而对脑型芳香化酶的报道较少。在半滑舌鳎(Cynoglossus semilaevis)[13]和罗非鱼(Oreochromis mossambicus)[25]的研究中都表明,温度过高将会抑制 Cyp19a1b mRNA的表达。最新研究也表明,水温高于 28℃时尖纹鲈 (Lates calcarifer)脑中的芳香化酶活性将逐渐降低,而血浆中的 E2含量却逐渐升高[12],可能 E2增加反馈抑制了芳香化酶活性[26]。本研究发现,随着处理时间的延长,水温26℃和29℃组金钱鱼脑垂体中Cyp19a1b mRNA的表达量均逐渐降低,与本实验室6周E2的研究结果呈负相关(E2结果另文发表),可能是 E2增加对其的反馈抑制效应所致。此外,本研究还发现,实验结束(6周)时,29℃组金钱鱼脑垂体中Cyp19a1b mRNA表达量显著低于26℃组,表明高温抑制金钱鱼Cyp19a1b mRNA的表达,与前人研究结论一致;23℃组脑垂体中Cyp19a1b mRNA的表达量在3周急剧降低,但实验结束时又上升,这种现象在卵巢发育的过程中不能用E2反馈调节抑制来说明,其中的调节机制还有待进一步研究。
鱼油中因富含 n-3多不饱和脂肪酸(PUFA),尤其是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),在全球水产饲料中被大规模利用。而 EPA和 DHA与雌二醇(E2)密切相关[27],因此,鱼油对鱼类特别是海水鱼类的正常繁殖、生长和发育都起着非常重要的作用,是其生命过程中不可缺少的营养因子[28]。研究表明,鱼油中的PUFA可以诱导E2的增加,从而促进虹鳟[29]和黑鲈(Dicentrarchus labrax L.)[30]卵巢的发育。而E2是在芳香化酶Cyp19的催化作用下才能合成,因此,鱼油中的PUFA可能会促进芳香化酶Cyp19基因的表达。本研究实时荧光定量PCR结果显示,随着投喂时间的延长,3个鱼油投喂组脑垂体中Cyp19a1b mRNA的表达量均逐渐降低,与本实验室8周E2的研究结果呈负相关(E2结果另文发表),因此,可能亦是由于 E2增加对其的反馈抑制调节所致。与此同时,研究发现鱼油含量对金钱鱼脑垂体中Cyp19a1b mRNA的表达虽无显著影响,但 8周时,脑垂体中Cyp19a1b mRNA的表达量依次为: 对照组>2%鱼油组>6%鱼油组,与 E2关系相反,表明金钱鱼脑垂体中 Cyp19a1b mRNA的表达量随鱼油含量的增加而逐渐降低;鱼油可诱导 E2水平不断积累,当E2水平增加到一定水平将可能反馈抑制调节金钱鱼脑垂体中Cyp19a1b mRNA的表达。
综上所述,随着卵巢发育或鱼油含量的提高,可降低雌性金钱鱼脑垂体中 Cyp19a1b mRNA的表达,这种降低可能是 E2反馈调节所致;水温高于26℃将抑制Cyp19a1b mRNA的表达。
[1]Barry T P,Castanos M T ,Fast A W,et al.Gonadal maturation and spawning induction in female spotted scat (Scatophagus argus)[J].Journal of Aquaculture in the Tropics,1993,8: 121-130.
[2]兰国宝,阎冰,廖思明,等.金钱鱼生物学研究及回顾[J].水产科学,2005,24(7): 39-41.
[3]Dalla V L,Ramina A,Vianello S,et al.Cloning of two mRNA variants of brain aromatase cytochrome P450 in rainbow trout (Oncorhynchus mykiss Walbaum)[J].Journal of Steroid Biochemistry and Molecular Biology,2002,82: 19-32.
[4]Greytak S R,Callard G V.Aromatase in fish: History and future perspectives [J].Comparative Biochemistry and Physiology,2007,148 (Part A): S27-S28.
[5]Lephart E D.A review of brain aromatase cytochrome P450 [J].Brain Research Reviews,1996,22 (1): 1-26.
[6]Carreau P,Mercedes B.Aromatase distribution and regulation in fish [J].Fish Physiology and Biochemistry,2005,31: 215-226.
[7]洪万树,方永强.鱼类芳香化酶活性研究的进展[J].水产学报,2000,24(3): 285-288.
[8]王慧,李霞,张育辉.CYP19基因表达与芳香化酶活性调控因子的研究进展[J].中国组织化学与细胞化学杂志,2010,19(3): 304-308.
[9]翁幼竹,张为民,方永强,等.17β-雌二醇诱导鲻鱼雌性化的机制: 芳香化酶和雌激素受体双染定位研究[J].中国水产科学,2003,10(6): 446-449.
[10]Mélanie V,Yann L P,Bon-chu C,et al.17a-Ethinylestradiol disrupts the ontogeny of the forebrain GnRH system and the expression of brain aromatase during early development of zebrafish [J].Aquatic Toxicology,2010,99: 479-491.
[11]Carlos S.Aromatase expression in the ovary: Hormonal and molecular regulation [J].Steroids,2008,73:473-487.
[12]Saman A,Trevor A,Rockyde N.Effect of rearing water temperature on protandrous sex inversion in cultured Asian Seabass (Lates calcarifer)[J].General and Comparative Endocrinology,2012,175: 416-423.
[13]邓思平,陈松林,刘本伟,等.半滑舌鳎脑芳香化酶基因 cDNA克隆及表达分析[J].动物学研究,2008,29 (1): 17-24.
[14]Callard G V,Tchoudakova A.Evolutionary and functional signification of two CYP19 genes differentially expressed in brain and ovary of goldfish[J].Journal of Steroid Biochemistry and Molecular Biology,1997,61(3-6): 387-392.
[15]Leea Y M,Williamsb T D,Junga S O,et al.cDNA cloning and expression of a cytochrome P450 1A(CYP1A)gene from the hermaphroditic fish Rivulus marmoratus [J].Marine Pollution Bulletin,2005,51:769-775.
[16]Halm S,Kwon J Y,Rand-Weaver M,et al.Cloning and geneexpression of P450 17alpha-hydroxylase,17,20-lyase cDNA in the gonads and brain of the fathead minnow Pimephales promelas [J].General and Comparative Endocrinology,2003,130(3): 256-266.
[17]Silverrin B,Ballien M,Foidart A,et al.Distribution of aromatase activity in the brain and peripheral tissues of passerine and nonpasserine avian species [J].General and Comparative Endocrinology,2000,117 (1): 34-53.
[18]Serdar E B,Siby S,Kazuto T,et al.Cloning and characterization of the rat cytochrome P450 4F5(CYP4F5)gene [J].Gene,2002,297: 179-187.
[19]Bulun S E,Sebastian S,Takayama K,et al.The human CYP19 (aromatase P450)gene: update on physiologic roles and genomic organization of promoters [J].Journal of Steroid Biochemistry and Molecular Biology,2003,86: 219-224.
[20]文爱韵,尤锋,孙鹏,等.牙鲆 dmrt1基因的克隆及其与 P450arom 基因的组织表达分析[J].海洋科学,2010,34(11): 97-102.
[21]Cavaco J E,Baal J,Dijk W,et al.Steroid hormones stimulate gonadotrophs in juvenile male African catfish(Clarias gariepinus)[J].Biology Reproduction,2001,64: 1358-1365.
[22]孙晶,李广丽,朱春华,等.脑型芳香化酶基因全长cDNA克隆及表达[J].中国水产科学,2012,19(3):408-415.
[23]Valle L D ,Ramina A,Vianello S,et al.Cloning of two mRNA variants of brain aromatase cytochrome P-450 in rainbow trout Oncorhynchus mykisss Walbaum[J].Journal of Steroid Biochemistry and Molecular Biology,2002,82: 19-32.
[24]Alicia G,Francesc P.Aromatase activity in the European sea bass (Dicentrarchus labrax)brain.Distribution and changes in relation to age,sex,and the annual reproductive cycle [J].General and Comparative Endocrinology,2003,132: 223-230.
[25]Tsai C L,Wang L H,Chang C F,et al.Effects of gonadal steroids on brain serotonergic and aromatase activity during the critical period of sexual differentiation in tilapia,Oreochromis mossambicus[J].Journal of Neuroendocrinol,2000,12: 894-898.
[26]Kishida M,Callard G.Distinct cytochrome P450 aromatase isoforms in zebrafish (Denio rerio)brain and ovary are differentially programmed and estrogen regulated during early development [J].Endocrinology,2001,142: 740-749.
[27]Tacon A G J,Metian M.Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds: trends and future prospects [J].Aquaculture,2008,285: 146-158.
[28]许友卿,庄丽,丁兆坤.多不饱和脂肪酸对海水仔稚鱼生长发育的影响及机理[J].饲料工业,2010,31(14):13-18.
[29]Fremont L,Leger C,Petridou B,et al.Effects of a n-3 polyunsaturated fatty acid-deficient diet on profiles of serum vitellogenin and lipoprotein in vitellogenic trout(Salmo gairdneri)[J].Lipids,1984,19: 522-528.
[30]Jose M N,Evaristo M,Mark T,et al.Effect of dietary lipid composition on vitellogenin,17β-estradiol and gonadotropin plasma levels and spawning performance in captive sea bass (Dicentrarchus labrax L.)[J].Aquaculture,1998,165: 65-79.
