微波协同酶法提取蛹虫草基质多糖工艺的优化研究
2014-05-17汪振炯王仁雷吴雨龙顾忠美曹志敏陈晓鹏
汪振炯,王仁雷,吴雨龙,周 峰,华 春,* ,顾忠美,曹志敏,何 盟,陈晓鹏,3
(1.南京晓庄学院生物化工与环境工程学院,江苏南京211171;2.江苏第二师范学院,江苏南京210013;3.南京师范大学生命科学学院,江苏南京210046)
蛹虫草(Cordyceps militaris),又名北冬虫夏草,与著名的中药材冬虫夏草(Chinese Caterpillar Fungus)归为同一个属。蛹虫草是虫菌结合的中药材,其菌体内含有多种生物活性成分,可与冬虫夏草相媲美[1]。蛹虫草可以人工栽培,目前从大米、高粱米、小米、玉米渣等多种基质上均可培养出蛹虫草子实体[2-3]。但是,在蛹虫草的规模化栽培中发现,蛹虫草的人工栽培需要消耗大量的人力物力,产量不高,并且在其栽培后会有大量的废基质产生,通常被当作废物扔掉。而这些废基质中含有大量蛹虫草菌丝体,造成宝贵资源浪费。
虫草多糖是蛹虫草菌丝体中含量最多的药理活性物质,大量研究表明,虫草多糖有着多种生物活性功能,如具有抗肿瘤、降血糖、抗肝纤维化,抗氧化活性,抗菌活性等作用,并可增强单核巨嗜细胞系统的功能,提高免疫力,治疗肝病毒性感染等[4-5],具有广阔的开发前景。因此,从虫草的废弃培养基中提取蛹虫草多糖,对提高蛹虫草人工栽培的附加值和生产保健食品和药品等具有重要意义。
随着现代分离技术的发展,超声、微波和生物酶技术在多糖等生物活性物质提取工艺中的应用得到广泛的关注,且有不少报道[6-8]。目前,国内外有关蛹虫草培养基中虫草基质多糖的提取报道,多集中于传统的水浴提取法,亦有微波和超声波助提等[9-12]。本文采用微波协同酶法提取基质多糖,利用酶降解、破坏菌丝体细胞壁,并采用微波促使多糖成分溶出,提高多糖的得率,并对其提取工艺进行了优化,以期提高基质多糖得率,为蛹虫草基质多糖的进一步纯化和活性研究奠定基础,同时也为蛹虫草保健食品的开发提供一条新的工艺。
1 材料与方法
1.1 材料与仪器
脱脂蛹虫草培养基基质,过60目筛 海安泓寿生物技术有限公司;纤维素酶(酶比活力50000U/g)江苏锐阳生物科技有限公司;硫酸(CP)无锡市晶科化工有限公司;无水乙醇(AR)国药集团化学试剂有限公司;苯酚(AR)汕头市西陇化工厂有限公司。
紫外-可见分光光度计 北京普析通用仪器有限责任公司;HH-4数显恒温水浴锅 常州国华电器有限公司;PHS-3C型pΗ计 上海精密科学仪器有限公司;格兰仕微波炉 广东格兰仕微波炉电器有限公司;Centrifuge 5810R冷冻离心机 德国Eppendorf公司,上海安亭科学仪器厂;旋转蒸发器RE-3000 上海亚荣生化仪器厂;SHZ-111型循环水真空泵 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 提取工艺 准确称取脱脂虫草基质粉末1g→缓冲液调pH→纤维素酶酶解→灭酶冷却→微波提取→冷却→过滤后得上清液→浓缩→加4倍体积90%乙醇于4℃冰箱静置12h→离心(4600r/min,10min)→收集沉淀→真空干燥得蛹虫草粗多糖。
1.2.2 多糖含量测定及得率计算 采用苯酚-硫酸法测定蛹虫草多糖含量[13]。
葡萄糖标准曲线的绘制:精确称取105℃干燥恒重的葡萄糖100mg,置100mL容量瓶中定容。准确称取标准溶液 20、40、60、80、100、120、140μL,分置于比色管中,各补加蒸馏水至体积为2.0mL,再分别加入5%的苯酚1.0mL,摇匀,迅速滴加浓硫酸5.0mL,充分摇匀后静置30min,补充浓硫酸至刻度,以蒸馏水为空白对照,于波长490nm处测定吸光度以葡萄糖浓度为横坐标,吸光值为纵坐标,绘制标准曲线,并求出回归方程并计算其标准曲线回归方程:y=6.0845x+0.0121,R2=0.9939。
多糖得率的计算:粗多糖得率以1g干品中提取出来的粗多糖总量的百分含量表示,计算公式如下:
虫草多糖得率(%)=多糖的质量/培养基基质样品干物质的质量×100
1.2.3 单因素实验
1.2.3.1 料液比对多糖提取的影响 以蒸馏水为提取液,在纤维素酶用量1500U/g、酶解温度50℃、酶解时间40min、酶解体系pH5.5、微波功率480W、微波时间 3min 的条件下,料液比依次为 1∶10、1∶20、1∶30、1∶40、1∶50、1∶60 下提取,测定其在 490nm 下的吸光度,并计算得率,实验重复3次。
1.2.3.2 酶添加量对多糖提取的影响 以蒸馏水为提取液,在料液比为1∶30、酶解温度50℃、酶解时间40min、酶解体系 pH5.5、微波功率480W、微波时间3min的条件下,纤维素酶用量依次为 500、1000、1500、2000、2500、3000U/g 下提取,测定其在 490nm下的吸光度,并计算得率,实验重复3次。
1.2.3.3 酶解pH对多糖提取的影响 以蒸馏水为提取液,在料液比为1∶30、纤维素酶用量1500U/g、酶解温度50℃、酶解时间40min、微波功率480W、微波时间3min的条件下,酶解体系 pH 分别为3.5、4、4.5、5、5.5、6、6.5下提取,测定其在490nm下的吸光度,并计算得率,实验重复3次。
1.2.3.4 酶解温度对多糖提取的影响 以蒸馏水为提取液,在料液比为1∶30、纤维素酶用量1500U/g、酶解体系pH5.5、酶解时间40min、微波功率480W、微波时间3min的条件下,酶解温度依次为35、40、45、50、55、60、65℃下提取,测定其在490nm下的吸光度并计算得率,实验重复3次。
1.2.3.5 酶解时间对多糖提取的影响 以蒸馏水为提取液,在料液比为1∶30、纤维素酶用量1500U/g、酶解温度50℃、酶解体系pH5.5、微波功率480W、微波时间3min的条件下,酶解时间依次为10、20、30、40、50、60min下提取,测定其在490nm下的吸光度并计算得率,实验重复3次。
1.2.3.6 微波功率对多糖得率的影响 以蒸馏水为提取液,在料液比为1∶30、纤维素酶用量1500U/g、酶解温度50℃、酶解体系pH5.5、酶解时间40min,微波时间3min的条件下,微波功率依次为320、400、480、560、640、720、800W 下提取,测定其在 490nm 下的吸光度并计算得率,实验重复3次。
1.2.3.7 微波处理时间对多糖得率的影响 以蒸馏水为提取液,在料液比为1∶30、纤维素酶用量1500U/g、酶解温度50℃、酶解时间40min、酶解体系pH5.5、微波功率480W的条件下,微波时间依次为1、2、3、4、5、6min下提取,测定其在490nm下的吸光度并计算得率,实验重复3次。
1.2.4 响应面法优化提取工艺 在单因素实验的基础上,选取纤维素酶用量、酶解时间、微波功率、微波处理时间4个因素作为自变量,并分别以多糖得率作为响应值,采用Box-Behnken法设计四因素三水平的二次回归方程拟合因素和指标(响应值)之间的函数关系,并采用响应面分析法分析各因素之间的交互作用,确定最佳的工艺参数,因素和水平见表1。
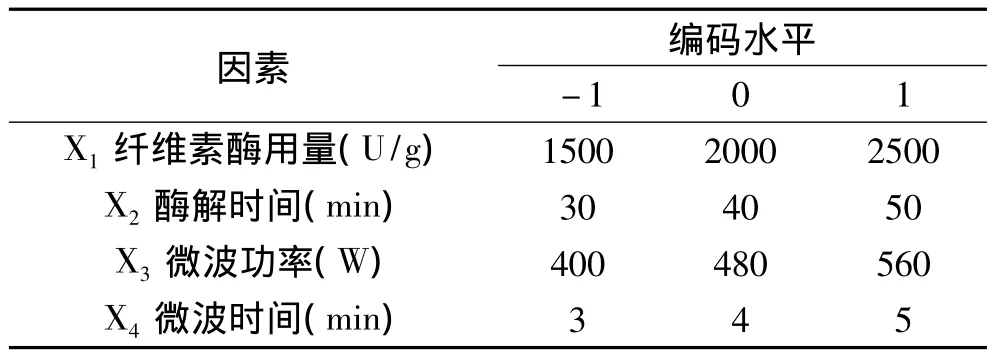
表1 响应面模型的因素水平设计表Table 1 Factors and levels for response surface design
2 结果与讨论
2.1 单因素条件对蛹虫草基质多糖得率的影响
2.1.1 料液比的确定 不同料液比对多糖得率的影响结果见图1。料液比小于1∶30时,多糖得率随液料比的增大而增加,当料液比大于1∶30后,多糖的提取曲线趋于平缓,甚至略有下降。水量增加利于水溶性的虫草基质多糖溶出,但加水量过大之后,会增加浓缩过程中工作量和能耗负担,同时增大了浓缩过程中多糖损耗,从而影响多糖得率,不利于实际操作和生产。
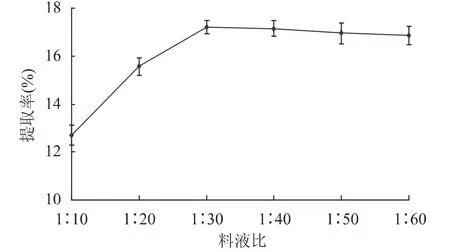
图1 料液比对虫草基质多糖得率的影响Fig.1 Effect of solid-liquid ratio on extraction yield of Cordyceps militaris polysaccharides
2.1.2 酶添加量对多糖提取的影响 不同纤维素酶用量对蛹虫草基质多糖提取的影响如图2所示。随着纤维素酶添加量的增加,多糖的提取量不断增加;当酶添加量至1500U/g,多糖得率的增加呈现出相对平缓的趋势。经纤维素酶处理后,多糖的提取量显著提高。这是因为菌丝体的主要成分是纤维素,纤维素被酶解后,加快了虫草多糖的溶出,从而提高了多糖提取量[10]。
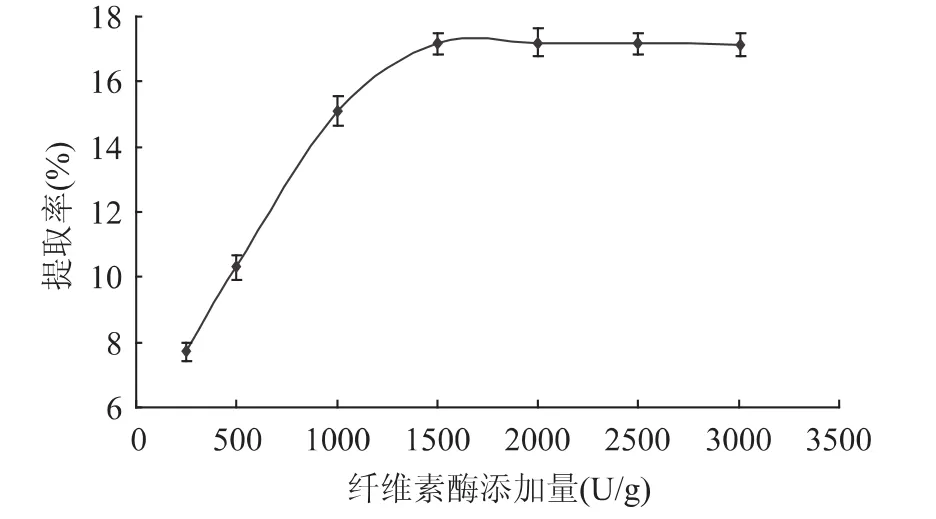
图2 纤维素酶添加量对虫草多糖得率的影响Fig.2 Effect of enzyme contents on extraction yield of Cordyceps militaris polysaccharides
2.1.3 酶解pH对多糖提取的影响 pH是影响酶活的主要因素。由不同酶解pH下蛹虫草基质多糖的得率(图3)可知,当pH为5.5时,多糖的得率最高。pH增大或减小,得率均开始下降。说明在pH5.5时的纤维素酶活较强,pH过高或过低均会对酶的活性产生影响,从而导致得率下降。选取酶解pH在5~6之间比较合适。
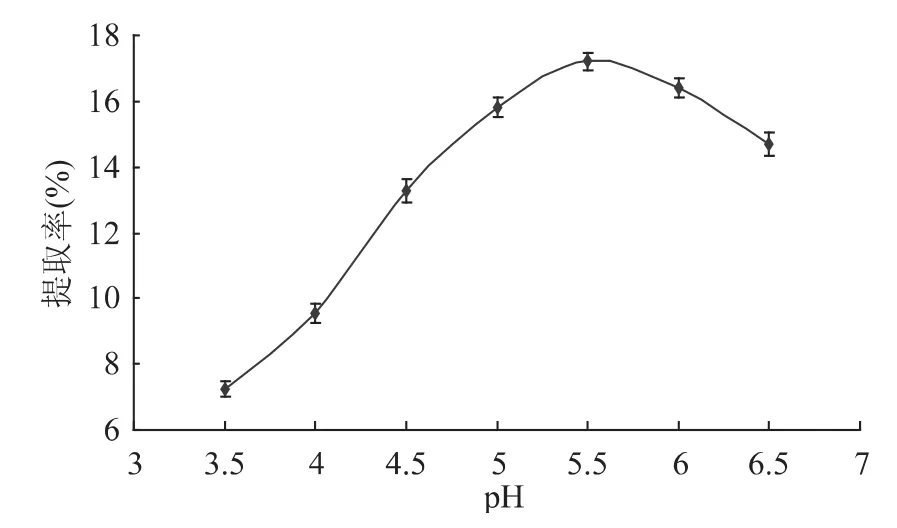
图3 pH对虫草基质多糖得率的影响Fig.3 Effect of pH on extraction yield of Cordyceps militaris polysaccharides
2.1.4 酶解温度对多糖提取的影响 酶解温度对蛹虫草基质多糖提取的影响如图4所示。温度会影响纤维素酶的活性,由图4可知,酶解温度在35~50℃时,随着温度升高,多糖的得率不断增大,在50℃达到最大值。当酶解温度大于50℃时,纤维素酶活性受到抑制,多糖得率随温度升高反而逐渐下降。因此酶解温度在50℃为宜。
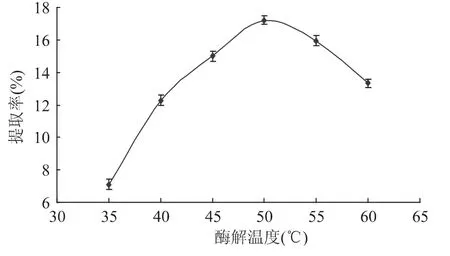
图4 酶解温度对虫草基质多糖得率的影响Fig.4 Effect of enzymolysis temperature on extraction yield of Cordyceps militaris polysaccharides
2.1.5 酶解时间对多糖提取的影响 由图5可知,酶解时间低于30min时,随着处理时间的增加多糖的得率不断增加,多糖得率提高比较显著,30~40min之间得率的增加不明显,40min之后得率有略微下降趋势。故酶解时间以30~50min为宜。
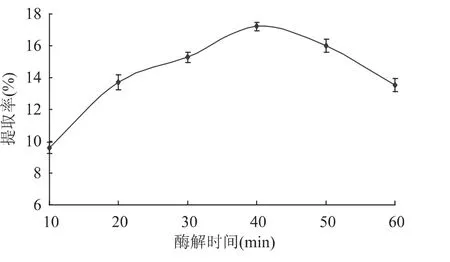
图5 酶解时间对虫草基质多糖得率的影响Fig.5 Effect of enzymolysis time on extraction yield of Cordyceps militaris polysaccharides
2.1.6 微波功率对多糖得率的影响 由图6可知,多糖得率随着微波功率的增大先增加后减小。当微波辐射时间一定时,微波功率越高,物系吸收微波能越多,菌丝体细胞内部温度上升越快,对基质中的细胞壁的破坏作用就越大,有利于物料有效成分浸出,从而增加多糖的得率。但如果功率过高,得率会有所下降,因瞬间加热作用会使被处理成分发生变性,对提取介质的渗入造成较大的阻碍,同时,局部温度过高,可能会导致多糖类化合物的分解,从而导致有效成分得率下降,因此适宜的微波功率应该在400~600W之间。
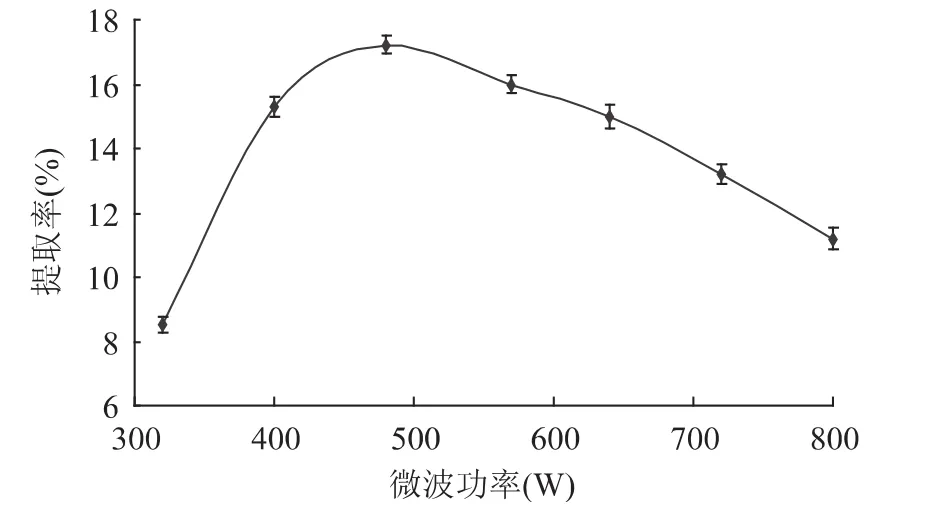
图6 微波功率对虫草基质多糖得率的影响Fig.6 Effect of microwave power on extraction yield of Cordyceps militaris polysaccharides
2.1.7 微波处理时间对多糖得率的影响 不同微波处理时间对多糖提取率的影响结果见图7。随时间增加多糖得率快速升高,微波处理4min时达到最高值,其原因在于微波短时间内即对菌丝体细胞产生很大破坏作用,提高溶出物的量,从而提高多糖得率。之后随时间增加,多糖得率有下降趋势,因为微波处理时间过长,不但会由于微波能的过剩,造成物料的焦糊和变性,影响提取的正常进行[14],而且会促进非多糖类物质的溶出,使产品的纯度降低,表现为产品得率下降。故选取3~5min作为微波提取时间考查范围。
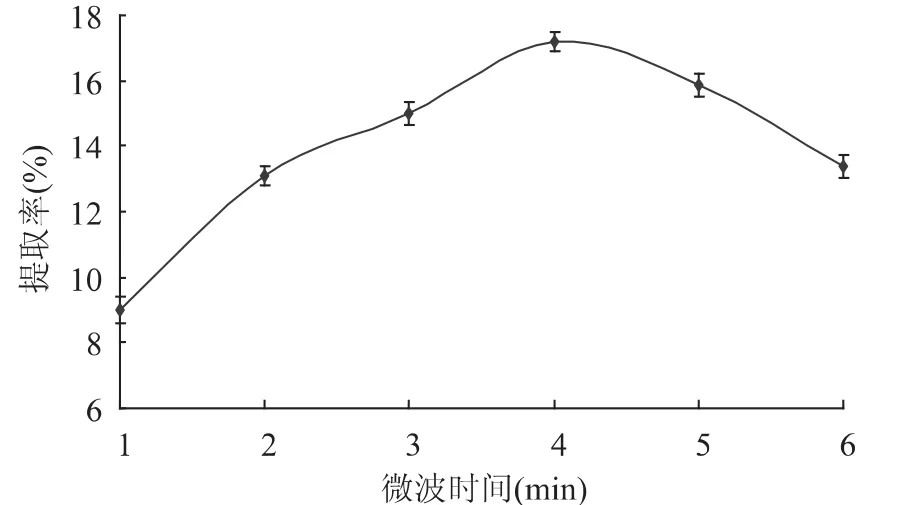
图7 微波提取时间对虫草基质多糖得率的影响Fig.7 Effect of microwave extract time on extraction yield of Cordyceps militaris polysaccharides
2.2 响应面实验结果分析
2.2.1 实验统计模型的建立 响应面分析结果见表2,运用design expert 8.06程序对29个实验点的响应值Y分别进行回归分析,并建立相应的响应面回归模型,得到回归方程如下:
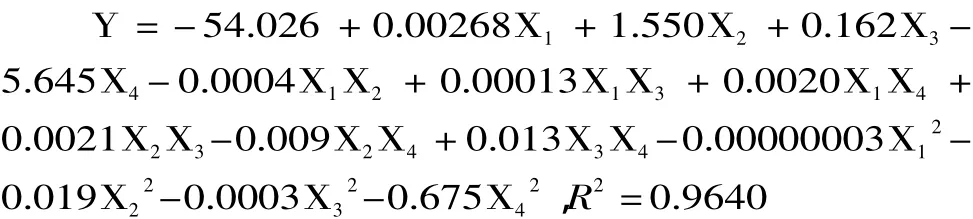
2.2.2 方差分析 对表2进行方差分析,其结果分别见表3。一般情况下,决定系数(R2)反映方程对数据的拟合程度,在0~1之间取值,Joglekar等指出R2大于0.80表明方程的拟合情况较好[15]。回归方程的R2为0.9640,该模型可以解释96.4%的响应值变化,表明各因子与多糖提取得率之间的线性关系很好;因此方程具有良好的拟合程度,可以对酶-微波法提取蛹虫草培养基基质多糖进行得率的分析和预测。此外,从表3的方差分析结果可得,所得的蛹虫草多糖提取得率的回归方程极显著(p<0.0001),且失拟检验不显著,说明该回归模型比较理想。从4个因素对多糖得率的影响来看,回归方程一次项中,X2-酶解时间、X3-微波功率、X4-微波时间均对多糖得率有极显著的影响,且影响顺序为X3>X2>X4。二次项中影响显著;交互项中,X1X2、X1X4、X2X3、X3X4对多糖提取得率的影响显著,X1X3、X2X4不显著。

表2 Box-Benhnken响应面实验结果Table 2 Results of Box-Banhken experiment
2.2.3 模型的验证 为了解回归模型的预测能力,对其进行数学分析,可以得到蛹虫草基质多糖得率的最佳平衡响应值对应的因素条件为加酶量1630U/g、酶解时间 43.82min、微波功率 480.82W,微波时间3.34min,在此条件下得出的多糖得率预测值为18.17%。考虑到实际操作的可行性,将参数修正为加酶量1650U/g、酶解时间44min、微波功率480W、微波时间3.5min。按照上述修正的优化提取条件进行5次平行实验验证,得到实际测得的平均得率为18.45%。与理论预测值相比,其相对误差在0.5%以内,表明该模型具有很好的有效性,可以用来预测实验结果,具有一定的参考价值。
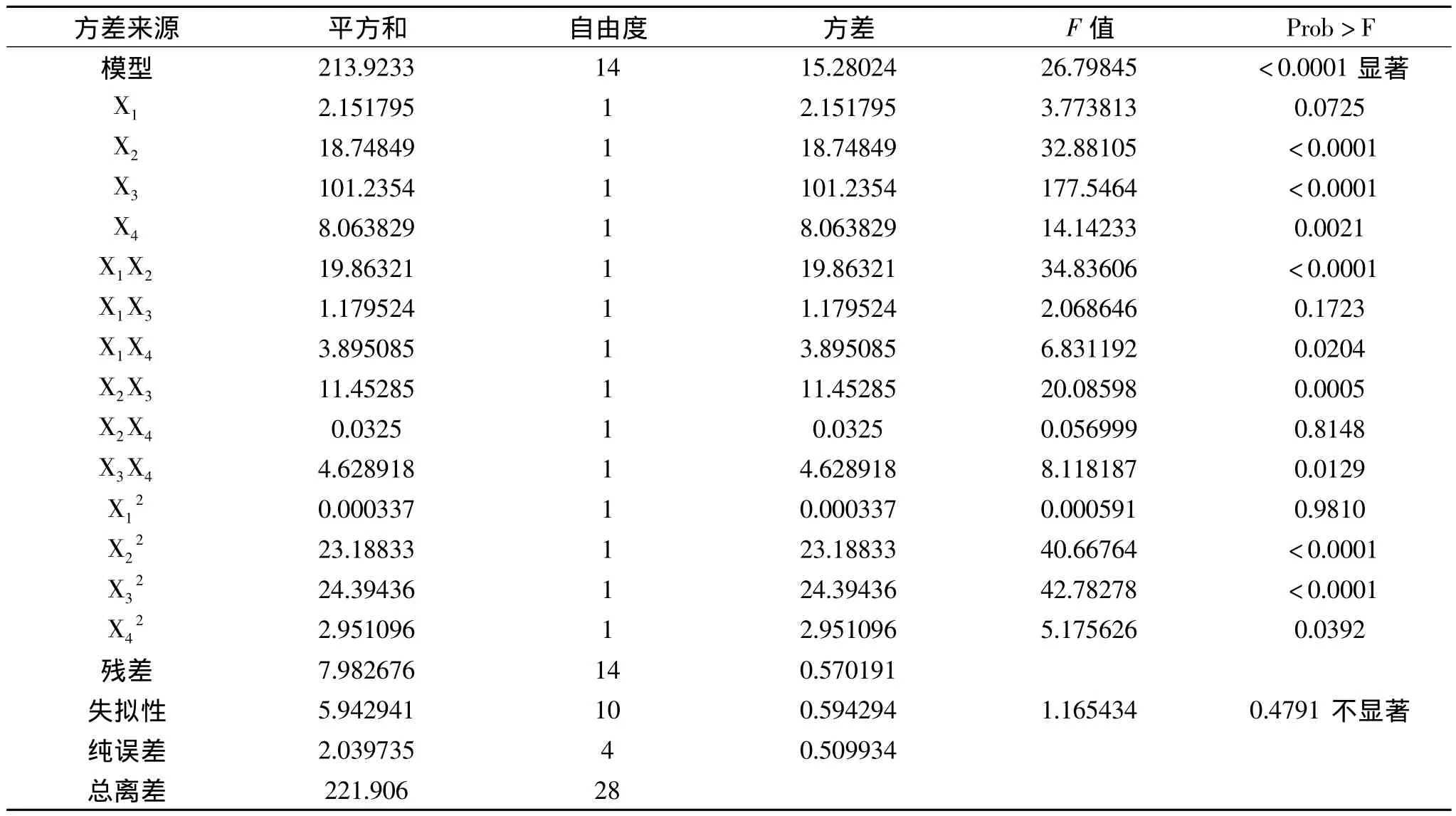
表3 蛹虫草多糖得率回归模型方差分析表Table 3 Variance analysis for regression equation of the extraction yield of Cordyceps militaris polysaccharides
3 结论
通过单因素及响应面实验研究,获得了微波酶解协同法提取蛹虫草多糖的最佳提取工艺,即料液比为1∶30,纤维素酶用量 1650U/g,在 55℃、pH5.5 条件下,酶解处理44min后进行微波提取,微波功率为微波功率480W、提取时间3.5min,最终多糖得率为18.45%,微波协同纤维素酶法从蛹虫草培养基质中提取虫草多糖可以提高效率,节约成本,提高多糖得率。
[1]刘春泉,宋江峰,李达婧,等.北冬虫夏草多糖组分的分离纯化及结构研究进展[J].食品科学,2007,28(1):370-373.
[2]王雅玲,郑双双,吕国忠,等.我国蛹虫草人工栽培培养基的现状调查[J].食用菌,2009(1):1-2.
[3]郑贵朝,喻孟君,张善信,等.固体培养基上蛹虫草菌丝体生长情况的观察[J].中国食用菌,2008,27(6):46-48.
[4]Chen X,Wu G,Huang Z.Structural analysis and antioxidant activities of polysaccharides from cultured Cordyceps militaris[J].International Journal of Biological Macromolecules,2013,58:18-22.
[5]Wang L,Wang G,Zhang J,et al.Extraction optimization and antioxidant activity of intracellular selenium polysaccharide by Cordyceps sinensis SU-02[J].Carbohydrate Polymers,2011,86(4):1745-1750.
[6]黄小葳.多糖的非常规提取研究[J].北京联合大学学报:自然科学版,2011,25(1):59-63.
[7]苗晓燕,陈萍,崔珏,等.微波酶解协同提取猴头菌丝体多糖工艺[J].食品科学,2012,33(2):94-97.
[8]Wang J L,Zhang J,Zhao B T,et al.A comparison study on microwave-assisted extraction ofPotentilla anserina L.polysaccharides with conventional method:Molecule weight and antioxidant activities evaluation[J].Carbohydrate Polymers,2010,80(1):84-93.
[9]赵丰丽.预处理对水提取醇沉法提取虫草多糖效果的影响研究[J].食品工业科技,2008,29(1):140-142.
[10]白霞,尹莲花,冯艳伟.微波法在蛹虫草多糖提取中的应用[J].大连民族学院学报,2005,5(3):23-24.
[11]宋江峰,李大蜻,刘春泉.响应曲面法优选人工蛹虫草多糖微波提取工艺[J].江苏农业学报,2009,25(5):1143-1150.
[12]秦秀丽,李凤林.超声波法提取蛹虫草多糖的工艺研究[J].江苏农业科学,2011,39(5):378-380.
[13]张志军,刘建华,李淑芳,等.灵芝多糖含量的苯酚硫酸法检测研究[J].食品工业科技,2006,27(2):193-195.
[14]陈红,张艳荣,王大为,等.微波协同酶法提取玉米须多糖工艺的优化研究[J].食品科学,2010,31(10):42-46.
[15]Joglekar A M,May A T.Product excellence through design of experiments[J].Cereal Food World,1987,32(12):857-868.
