酵母突变株Y518的生理特性分析
2014-05-17刘莉娟朱益波王立梅
刘莉娟,朱益波,齐 斌,王立梅,*
(1.苏州大学基础医学与生物科学学院,江苏苏州215123;2.常熟理工学院发酵工程技术研究中心,苏州市食品生物技术重点实验室,江苏常熟215500)
酿酒酵母(Saccharomyces cerevisia)是重要的模式生物,广泛应用于发酵和酿造工业,同时酿酒酵母也是工业上生产谷胱甘肽的常见菌株[1]。在酿造工业中,酿酒酵母易发生突变,产生呼吸缺陷型,主要是线粒体缺失染色体阻断了电子传递链。呼吸缺陷型酵母细胞和正常酵母细胞在形态上无多大差别,菌落较正常者小。由于其菌落较小,又称为小菌落突变型(Petite Mutant)[2-4]。
研究发酵菌株的生理特性以及代谢调控,有助于揭示其生命活动机理,并可以通过改变细胞的生理状态来提高目标产物的合成,这对发酵工业具有重要指导意义[5]。本实验室采用亚硝基胍对一株酿酒酵母菌株2-10515进行诱变,并获得一株高产GSH的突变株Y518[6]。为了解突变菌株Y518的发酵特性,本文对突变菌株Y518发酵过程中的生理特性进行了研究,以期为Y518在工业化生产过程中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
酿酒酵母2-10515与Y518为本实验室保藏;3,5-二硝基水杨酸(DNS)国药集团化学试剂有限公司;2,3,5-氯化三苯基四氮唑(TTC)上海金穗生物科技有限公司;十二烷基磺酸钠(SDS)北京鼎国生物技术责任有限公司;其他所用试剂均为分析纯;YEPD培养基 葡萄糖20g,蛋白胨20g,酵母提取物10g,用水定容至 1000mL,pH6.0;发酵培养基[7]葡萄糖20g,酵母提取物5g,硫酸铵5g,磷酸二氢钾6g,硫酸钾 3g,硫酸镁1.5g,用水定容至 1000mL,pH6.0;TTC培养基[8]下层:葡萄糖1%,酵母提取物0.15%,蛋白胨0.2%,磷酸二氢钾0.15%,硫酸镁0.04%,琼脂2%;上层:葡萄糖 0.5%,琼脂 1.5%,灭菌;TTC1%,无菌膜过滤后,两者于50℃混合;醋酸钠固体培养基[9]醋酸钠20g,酵母提取物 5g,蛋白胨 20g,琼脂20g,用水定容至1000mL。
UV-2450分光光度计 SHIMADZU公司;超声波细胞破碎机 宁波新芝生物科技股份有限公司;高速台式离心机 Thermo公司;高效液相色谱仪SHIMADZU公司。
1.2 实验方法
1.2.1 菌种培养 活化后的菌株接种到YEPD培养基中过夜培养,以10%的接种量接种到发酵培养基中进行发酵,30℃,180r/min,定时取样。
1.2.2 菌落形态比较 制备适当浓度的菌体悬浮液,涂布培养观察其菌落形态。
1.2.3 细胞浓度测定 采用比浊法。取不同时间的发酵液4mL于4℃,10000r/min离心5min,弃上清,并用生理盐水洗涤菌体后稀释20倍,测定发酵液OD600值。
1.2.4 残糖含量测定 采用3,5-二硝基水杨酸法(DNS法)[10]。取样后稀释20倍在520nm处比色测定。
1.2.5 发酵pH测定 用pH计测定发酵液的pH。
1.2.6 菌体蛋白含量测定 取不同时间的发酵液4mL于4℃,10000r/min离心10min,收集菌体,并用0.85%NaCl洗3次。加入95℃的SDS样品缓冲液500μL,煮沸 5min,冰浴上冷却,加入 500μL 硫脲裂解液,室温轻微振荡1h,超声破碎5min,10000r/min离心5min,取上清液[11]。用Lowry法定量蛋白浓度,以牛血清白蛋白为标准蛋白。
1.2.7 乙醇和甘油含量测定 准确量取4mL发酵液,经12000r/min离心5min后取上清液,经0.22μm水系膜过滤后用高效液相色谱仪进行测定。色谱条件[12]为:Aminex HPX-87H柱有机酸分析柱(300mm×7.8mm);流动相:0.05mol/L H2SO4;流速:0.5mL/min,进样量:5μL;柱温:50℃;示差折光检测器温度:50℃。
1.2.8 TTC检测 菌种活化培养后稀释到适当浓度,在TTC下层培养基涂布,30℃培养2~3d,小心覆盖TTC上层培养基,避光30℃培养3~4h,观察菌落颜色[8]。
1.2.9 醋酸钠培养基培养 菌种活化培养后稀释到适当浓度后涂布在醋酸钠培养基上,30℃培养2~3d,观察菌落生长情况。
2 结果与讨论
2.1 Y518与2-10515生长性能的比较
将同样浓度的Y518和2-10515菌液进行涂布后培养2~3d,观察二者的菌落形态。从图1中可以看出二者的菌落形态无明显差别,Y518的菌落较2-10515小。在同样条件下培养Y518和2-10515,每4h取样测定菌体浓度。结果表明两者的生长趋势几乎相同,接种到新鲜培养基后迅速开始生长,在48h达到最大值。但是Y518生长速率缓慢,其生长的最大值(OD600为15.67)低于原始菌株2-10515(OD600为19.32)(图2)。
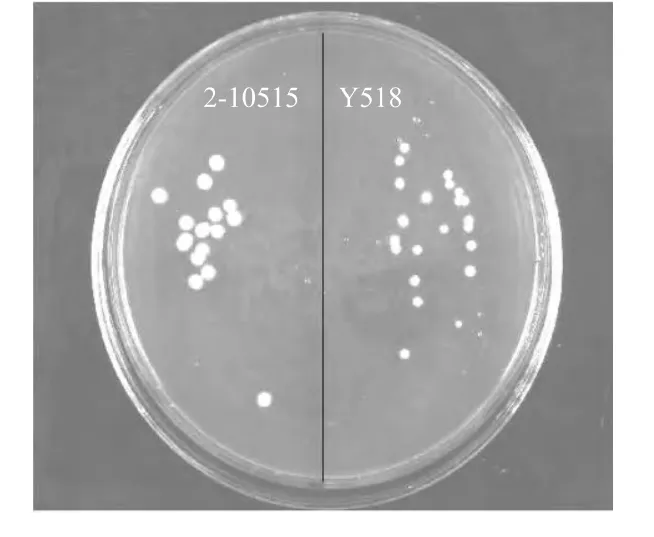
图1 突变株Y518和原始菌株2-10515的菌落形态的比较Fig.1 The difference in colonial morphology between Y518 and 2-10515
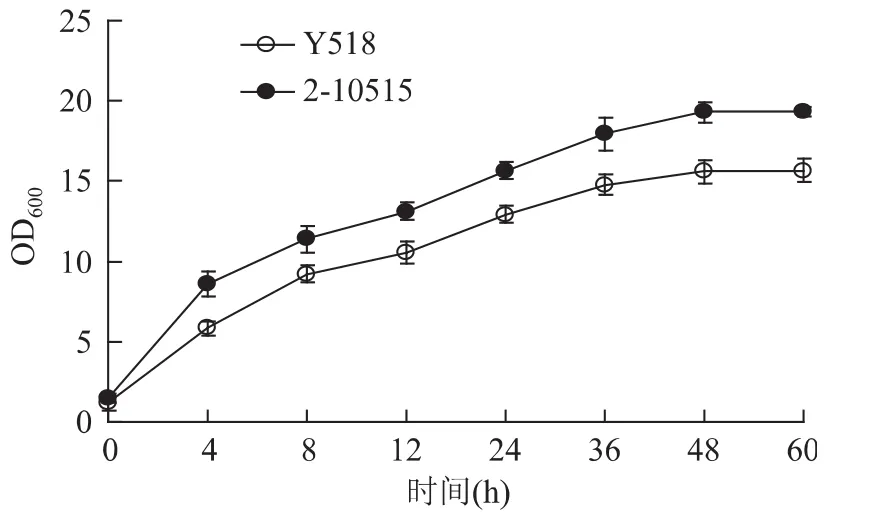
图2 突变株Y518和原始菌株2-10515细胞生长比较Fig.2 The difference in cell growth between Y518 and 2-10515
2.2 Y518和2-10515的葡萄糖代谢及发酵液pH的变化
葡萄糖作为YEPD培养基中的碳源,其代谢活性可表征微生物的生理生化状态和生物活性。从图3中可以看出2-10515与Y518葡萄糖消耗的趋势一致,在6h时发酵液中的葡萄糖消耗完毕。但是与2-10515相比,Y518的耗糖速率明显减慢。随着发酵的进行,细胞大量合成乙酸、乳酸并积累二氧化碳等酸性物质,引起 pH下降[5]。从图4中可以看出Y518在12h时前与2-10515的发酵pH相似。随着代谢的进行,Y518的发酵液pH逐渐低于2-10515,这可能是Y518的代谢通路发生改变,酸代谢变慢导致的。
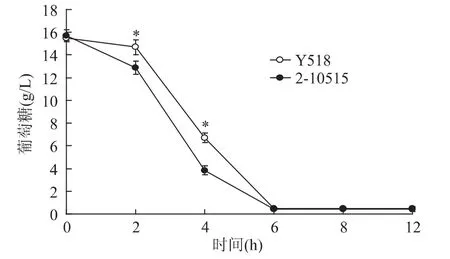
图3 不同发酵时间发酵液中葡萄糖含量Fig.3 Content of glucose at different fermentation time
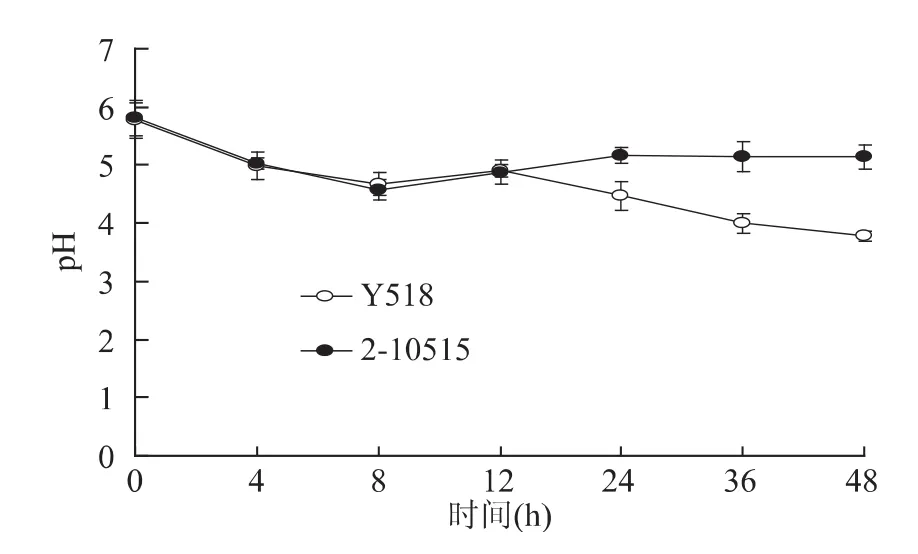
图4 Y518和2-10515的发酵液pH比较Fig.4 Changes of pH between Y518 and 2-10515
2.3 TTC检测
由于突变菌株Y518的平板菌落形态与2-10515差别不大,但是菌落小,生长速率慢,因此推断Y518可能发生了呼吸缺陷突变。实验中采用TTC[8]染色来鉴定突变菌株Y518是否为呼吸缺陷型菌株。TTC(2,3,5-氯化三苯基四氮唑)是一种能与氧气竞争呼吸链中的还原氢产生三苯基甲腈(TF,在细胞内以红色结晶体形式存在)的显色剂。呼吸正常的酵母能够产生还原氢还原TTC使菌落呈红色,而呼吸缺陷型酵母因线粒体基因部分缺失不能产生还原氢,不能还原TTC生成红色的TF,所以菌落呈白色。实验结果表明,Y518经 TTC(图5A)染色为白色,而2-10515经TTC染色为红色。
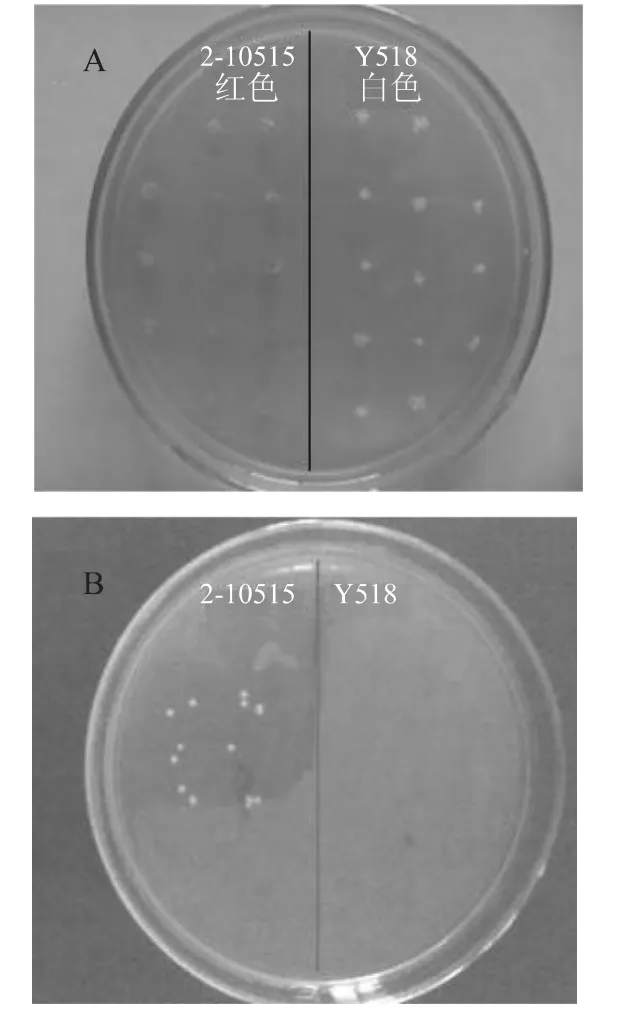
图5 Y518和2-10515的TTC检测(A)和对非发酵型物质醋酸钠(B)的反应Fig.5 TTC staining(A)and reaction on the non-fermented material acetic acid sodium(B)of Y518 and 2-10515
为做进一步确定,根据呼吸缺陷型酵母不能氧化非发酵性物质,如甘油、醋酸等的原理[2]。将活化的菌种在醋酸钠培养基上涂布,观察其生长情况。结果表明突变菌株Y518在醋酸钠(图5B)为碳源的培养基上不能生长,而原始菌株2-10515在醋酸钠培养基上生长良好。
2.4 Y518与2-10515的菌体蛋白含量比较
从蛋白水平来看,突变菌株Y518和原始菌株2-10515的蛋白表达有着明显的差异。Y518的菌体蛋白表达量始终高于2-10515。Y518蛋白的高表达可能是与原始菌株2-10515相比Y518对环境变化更敏感,再加上发酵的过程中产生的各种胁迫,其通过提高相应的应激蛋白的表达和分泌以保证菌体的生存。
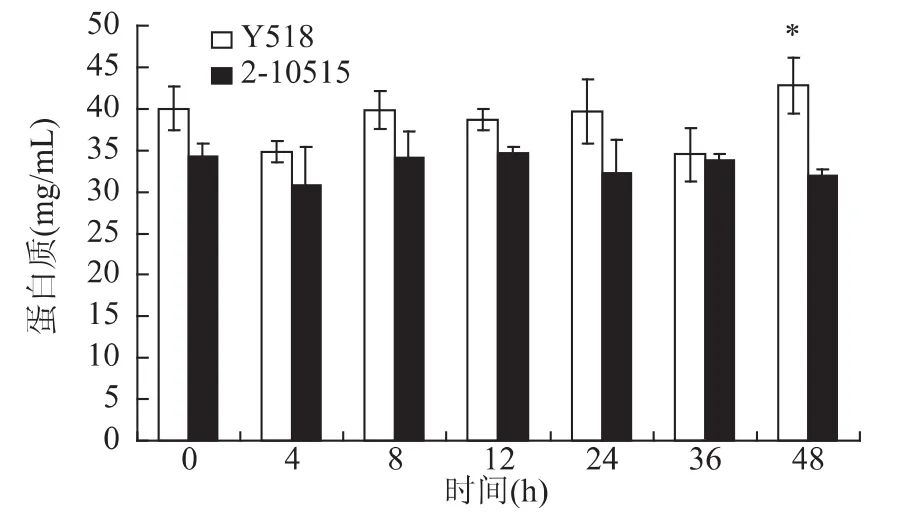
图6 Y518和2-10515的菌体蛋白表达量Fig.6 Changes of cell total protein of Y518 and 2-10515
2.5 Y518和2-10515乙醇和甘油产量分析
同样条件下培养Y518和2-10515,不同时间点取样检测发酵液中乙醇和甘油含量。从图7中可以看出在发酵初期原始菌株2-10515的乙醇产量高于突变株Y518。随着发酵的进行,Y518和2-10515的乙醇产量越来越接近,分别为69.91g/L和72.56g/L。从图8中可以看出,在发酵的过程中 Y518和2-10515的甘油产量逐渐降低,而且Y518产生的甘油的量低于2-10515。甘油不仅可以保护酵母高渗胁迫的作用,还能在厌氧或微氧条件调节酵母细胞胞内氧化还原电势平衡的重要途径之一[13]。对比甘油和生长量、葡糖糖消耗以及菌体蛋白的发酵规律可以推测,由于甘油的保护作用,2-10515生长迅速,代谢正常,而Y518的甘油产量低,故生长缓慢,代谢发生了改变。
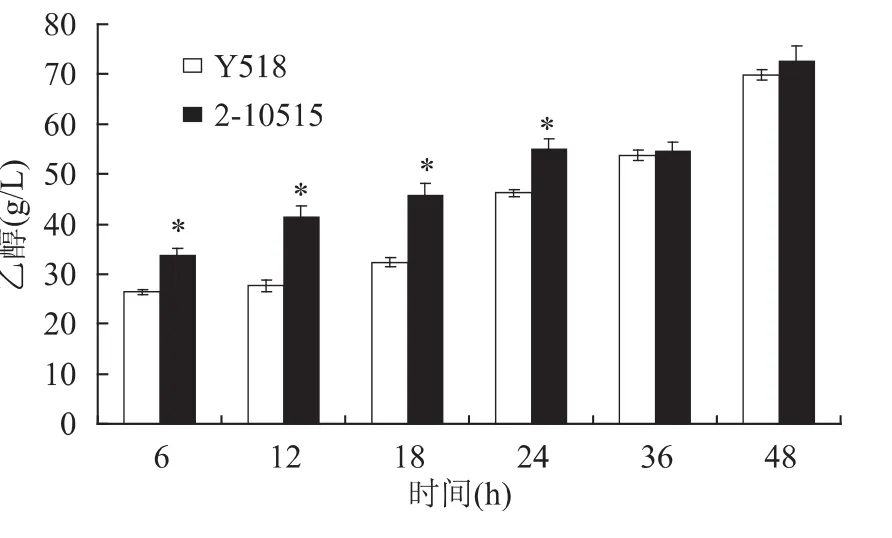
图7 发酵过程中Y518和2-10515的酒精产量比较Fig.7 Ethanol production of Y518 and 2-10515 in the process of fermentation
3 结论
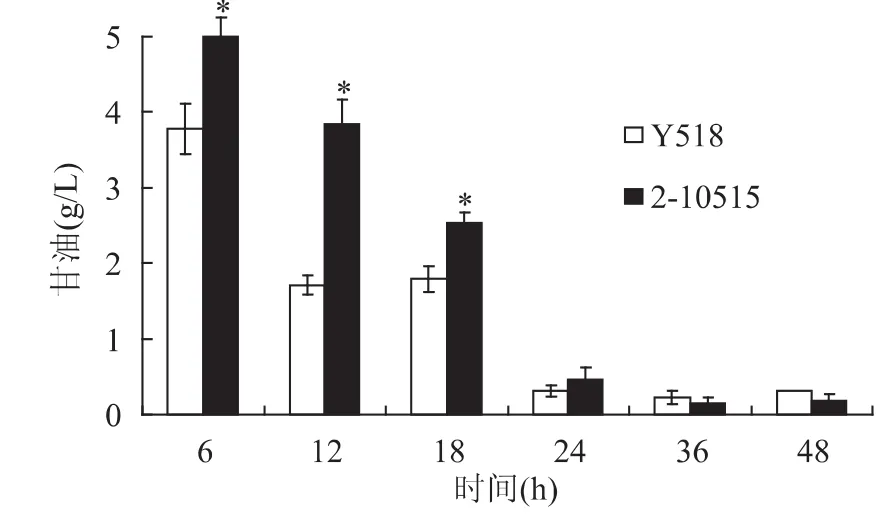
图8 发酵过程中Y518和2-10515的甘油产量比较Fig.8 Glycerol production of Y518 and 2-10515 at different fermentation time
本实验对经亚硝基胍诱变得到的酵母突变株Y518进行了初步的生理生化研究,发现与原始菌株2-10515相比,Y518在生理和代谢上发生了显著变化,而且其呼吸存在缺陷。这些数据不仅为接下来的代谢和转录组等方面研究提供实验依据,也为以后的发酵条件改进提供指导。
[1]陈叶福,李军侠,沈世超,等.酿酒酵母谷胱甘肽产量与镉盐抗性关系的研究与应用[J].中国酿造,2012,31(4):40-43.
[2]鲍晓明,高东.酵母菌呼吸缺陷型的选育[J].华中农学院学报,1984,3(2):44-47.
[3]王莉,阳蕾.啤酒酵母呼吸缺陷型菌株的检测[J].啤酒科技,2002,2:10-12.
[4]Viktor K,Margita O,Jitka U,et al.Induction of respirationdeficient mutants in Saccharomyces cerevisiae by chelerythrine[J].FEMS Microbiology Letters,1994,120:87-92.
[5]王继花,薛永常,高圣,等.高渗胁迫下啤酒酵母的生理特性研究[J].中国酿造,2008,5:45-47.
[6]王雅楠,梅艳珍,郑丽雪,等.酵母突变株Y518谷胱甘肽合成酶结构分析[J].食品科学,2009,30(17):258-261.
[7]江洁,卜红宇.酿酒酵母菌产谷胱甘肽的发酵条件研究[J].中国酿造,2009,(1):59-61.
[8]吴小映,李慧萍,何春燕,等.呼吸缺陷型酵母发酵性能研究[J].啤酒科技,2007,4:18-21.
[9]赵炯,中药抗真菌活性测定和酵母利用非发酵碳源基因的筛选[D].天津:天津大学,2007.
[10]舒馨,刘雄民,梁秋霞,等.3,5-二硝基水杨酸吸光光度法测定八角残渣中总糖,还原糖含量[J].食品工业科技,2010,31(6):341-343.
[11]Alois H,Robert W,Arek N,et al.Comparison of yeast cell protein solubilization procedures fortwo-dimensional electrophoresis[J].Electrophoresis 1999,(20):826-829.
[12]袁文杰,孔亮,孜力汗,等.高效液相色谱法测定克鲁维酵母菊芋发酵液中的乙醇,糖和有机酸类代谢成分[J].分析化学,2009,37(6):850-854.
[13]陈献忠,王正祥,诸葛健.酵母细胞甘油代谢与生理功能研究进展[J].中国生物工程杂志,2010,30(5):140-148.
