探讨不同因素对白背飞虱在稻苗间传播南方水稻黑条矮缩病毒效率的影响
2014-05-13李有志
曹 杨, 李有志
探讨不同因素对白背飞虱在稻苗间传播南方水稻黑条矮缩病毒效率的影响
曹 杨, 李有志*
(湖南农业大学 植物保护学院 植物病虫害生物学与防控湖南省重点实验室, 湖南 长沙, 410128)
结果表明, 白背飞虱(5龄若虫、长翅型和短翅型成虫)在18~34 ℃的温度区间内均能在不同生育期的水稻上传毒, 传毒率在3.3%~41.2%间. 介体发育阶段、环境温度和水稻生育期均能显著影响该虫的传毒能力(< 0.01), 不同发育阶段白背飞虱的传毒能力依次是5龄若虫>短翅型成虫>长翅型成虫; 26℃时该虫传毒率最高, 其次是22 ℃, 最后依次是28 ℃、18 ℃和34 ℃; 苗龄越低传毒率越高. 这三者中任意2因素间都有极显著的互作效应(< 0.01), 它们对该虫传毒的影响顺序依次是温度>水稻生育期>介体发育阶段>环境温度×介体发育阶段>环境温度×水稻生育期>介体发育阶段×水稻生育期. 不同品种的感染率不同, 5个品种感染率从高到低的顺序分别是陵两优268(41.7%)、金优899(37.6%)、金优284(36.2%)、培两优981(32.1%)和威优644(29.3%). 其中, 陵两优268的感染率显著高于其它品种(< 0.05), 金优898和金优284之间感染率差异不显著(< 0.05), 威优644的感染率显著低于其它品种(< 0.05). 禁食时间在12 h以上时, 该虫传毒能力显著降低(< 0.05). 白背飞虱在稻苗间的传毒效率与水稻品种、环境温度、该虫发育阶段、水稻品种及生育期、该虫禁食时间长短密切相关, 其中水稻生育期、温度和白背飞虱的发育阶段间还存在极显著的互作效应.
白背飞虱; 南方水稻黑条矮缩病毒; 环境温度
南方水稻黑条矮缩病是近年在中国南方各省水稻产区暴发流行的一种新的病毒病, 其病原为南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus, SRBSDV), 白背飞虱可在多种寄主植物间传播SRBSDV[1—4]. 迄今为止, 市场上尚无有效防治该病毒病的药剂, 当前防治该病主要是采取防虫控病的策略. 因此, 阐明不同因素对该虫在稻苗间传毒效率的影响对于制定有效的防控措施具有重要意义. 温度影响介体昆虫的传毒效率是虫传病毒的共同特征[5—7]. 温度对介体昆虫传毒效率的影响主要包括影响病毒粒子在寄主植物和传毒介体体内的增殖[5, 7]、感染过程[4—5, 7]和取食、扩散行为等[8]. 研究人员比较了蚜虫在不同温度时获取香蕉束顶病毒(Banana bun- chy top virus) 的效率, 该虫在16 °C时没有获毒能力而在27 °C时的获毒效率最高[9]. 实际上, 环境温度影响寄主和病毒自身的代谢速率必然会影响病毒粒子在寄主体内的增殖速度[4, 7, 10]. 此外, 环境温度和寄主植物种类的改变也会改变介体昆虫的行为和介体昆虫取食过程中的刺探频率[8, 10—11]. 在许多植物-病毒系统中, 介体的发育阶段也与其传毒效率有关, 如若蚜传播蚕豆坏死黄化病毒Faba bean necrotic yellow virus 的效率高于成蚜[12]; 仅1龄期蓟马能获取番茄斑萎病毒Tomato spotted wilt virus[13]. 介体发育阶段和环境温度在传毒效率方面普遍存在互作效应[5—6]. 由此可见, 介体的传毒效率与多种因素有关. 在植物病毒中, 对蚜传黃症病毒科(Luteoviridae)病毒的研究较深入, 多种因素影响luteoviruses病毒的传播, 这些因素包括介体虫态、寄主植物种类以及病毒品系[11, 13—15]. 尽管迄今已探明SRBSDV的介体白背飞虱的传毒特性[3]及该虫在不同寄主植物间的传毒效率[4], 但有关温度、寄主水稻品种及生育期等因素对传毒效率的影响、SRBSDV-介体-寄主植物间在传毒效率方面是否存在互作关系尚不清楚. 本研究拟揭示不同因素(环境温度、水稻品种及生育期、介体发育阶段、介体禁食与否)对白背飞虱在稻苗间的传毒效率的影响, 以及环境温度、介体发育阶段和水稻生育期对该虫传播SRBSDV是否存在互作效应, 为阐明白背飞虱在影响SRBSDV生态学和流行学方面扮演的作用以及为制定该病毒病的防治策略提供参考依据.
1 材料与方法
1.1 材料
供试水稻品种为陵两优268、金优898、培两优981、金优284和威优644(湖南亚华种子有限公司提供); 白背飞虱由南京农业大学提供, 在室内连续多代饲养, 寄主植物为陵两优268稻苗; 毒苗为事先经RT-PCR检测带有SRBSDV的盆栽陵两优268水稻苗.
TRIzol Total RNA Reagent由Invitrogen公司提供; M-MLV逆转录酶、DNA Polymerase和dNTPs由贝博生物试剂公司提供; 氯仿(分析纯)等为国药集团化学试剂有限公司生产; 引物由周倩等[16]设计, S10F(5'-TTAAGTTTATTCGCAACTTCGAAG-3'), S10R( 5'-GTGATTTGTCAGCATCTAAAGCG-3'), 扩增产物约500 bp.
1.2 水稻中SRBSDV的检测方法
水稻中SRBSDV的检测方法同相关文献[3], 具体方法如下:
总RNA提取: 取待测水稻叶片50~100 mg左右, 在液氮中充分研磨后, 加1 000 μL TRIzol. 混匀后转入1.5 mL离心管中, 加500 μL氯仿/异戊醇(/= 24: 1), 涡旋振荡后冰浴15 min. 12 000 rpm, 4℃离心15 min, 取上层水相, 加500 μL异丙醇, 冰盒中放置15 min. 12000 rpm, 4 ℃离心10 min, 弃上清. 用1000 μL 80%乙醇洗涤沉淀, 12 000 rpm, 4 ℃离心5 min. 去上清液后真空干燥3~5 min, 再用20 μL DEPC水(ddH2O)溶解沉淀,-20 ℃保存.
cDNA链的合成: 取RNA样品3.0 μL, ddH2O 7.0 μL, 引物S10F和S10R(10 mmol/L)各1.0 μL, 65 ℃变性5 min. 加入M-MLV Buffer 4.0 μL, dNTP(10mmol/L) 2.0 μL, 30 ℃10 min. 再加入M-MLV 1 μL, 42 ℃20 min. 然后99 ℃5 min, 自然冷却至室温后,-20 ℃保存.
PCR扩增: 取cDNA 2.0 μL, 引物S10F和S10R(10mmol/L)各1.0 μL, Taq Buffer 2.5 μL, dNTP (2.5 mmol/L)2.0 μL, 2.5 U/μL Taq 0.5 μL, 反应总体系为25.0 μL. 94 ℃预变性5 min; 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1 min, 35个循环; 72 ℃延伸10 min. 取反应产物5.0 μL, 加1.0 μL上样缓冲液. 经1%琼脂糖凝胶电泳, EB染色后, 通过凝胶成像系统观察并照相.
1.3 环境温度、白背飞虱发育阶段和水稻生育期对白背飞虱在水稻上接毒的影响
试验采用三因素完全随机设计[17—18], 接虫时环境温度分别为18 ± 1 ℃、22 ± 1 ℃、26 ± 1 ℃、30 ± 1 ℃和34 ± 1 ℃. 水稻品种为培两优981, 45株稻苗/盆, 生育期分别为三叶一心、五叶一心、七叶一心、分蘖期和孕穗期; 毒虫为在毒苗内孵化后继续取食毒苗, 进入供试虫态12~24 h的5龄若虫、短翅型成虫和长翅型成虫.
每盆稻苗接虫1头(盆外罩有可阻止飞虱出入的防虫网), 接虫2 d后喷洒高剂量的敌敌畏杀死毒虫, 然后将所有盆栽水稻转移到环境温度为30 ± 1℃的玻璃温室内. 接虫后25 d经RT-PCR单苗检测盆内的每株稻苗是否感染SRBSDV(部分低龄稻苗如出现SRBSDV感染症状, 在其死亡前及时检测), 统计每盆感染SRBSDV稻苗的比例, 即该盆稻苗接入白背飞虱的传毒率. 如果某盆内稻苗的感染率为0, 则将该盆稻苗上所接飞虱判定为无毒虫, 即该盆稻苗/毒虫为无效样本. 每处理的有效样本数为30个. 稻苗内SRBSDV的检测方法见1.2. 为确保盆内稻苗始终为单株单苗, 试验过程中在分蘖株出水前及时将其剪除.
1.4 白背飞虱在不同水稻品种间的传毒率
水稻为盆栽七叶一心期稻苗, 品种为陵两优268、金优898、培两优981、金优284和威优644. 盆栽水稻外套有防虫网, 每个盆内种植上述5个品种, 每个品种50株, 共250株稻苗分5行交错均匀分布在盆内, 株间距离约5 cm, 每株稻苗用标签注明品种. 在分蘖株出水前及时将其剪除, 确保水稻始终为单苗. 毒虫为在毒苗内孵化后并在毒苗上取食、发育至供试虫态12~24 h的5龄若虫. 每盆稻苗接入1头虫. 接虫3 d后喷高剂量敌敌畏药剂杀死传毒昆虫, 接虫25 d后经RT-PCR检测盆内每株水稻是否感染SRBSDV, 并分别统计各盆内5个品种的感染率. 如果某盆内所有稻苗均未被感染, 则将该盆水稻视为无效样本. 统计30个有效样本中各品种的感染率, 即30头毒虫在30盆稻苗不同品种上的传毒效率. 接毒虫前后环境温度均为26 ± 1 ℃.
1.5 白背飞虱长翅型成虫在禁食处理后48h内的传毒率
供试毒虫为在毒苗上饲育10 d以上并已发育至长翅型的白背飞虱成虫. 在环境温度为26 ± 1 ℃时, 将一批发育基本一致的长翅型成虫(羽化后约12~24h)饥饿0(对照组)、4、12、24、48、60 h后, 单虫分别转移至养虫笼(50 cm× 50 cm × 50 cm)内, 每养虫笼内放置30株七叶一心盆栽威优644稻苗. 接虫48 h后, 喷洒高剂量的敌敌畏将其杀死. 接虫后正常肥水管理, 及时剪除分蘖苗, 仅保留主茎. 喷药后20 d检测每个养虫笼内稻苗的感染率. 单苗检测, 检测方法见1.2. 如果网室内有1株稻苗感染SRBSDV, 则判定该养虫笼内稻苗接虫成功. 每个禁食时间段统计25个接虫成功的养虫笼内稻苗的感染率.
1.6 白背飞虱长翅型成虫在禁食处理后至其自然死亡前的传毒株数
供试介体昆虫为在毒苗上饲育10 d以上并已发育至长翅型的白背飞虱成虫. 在环境温度为26±1℃时, 将长翅型成虫(羽化后约12~24 h)分别饥饿0 (对照组)、4、12、24、48和60 h后, 单头分别转移至覆盖防虫网的养虫笼(50 cm× 50 cm × 50 cm)内的盆栽威优644七叶一心稻苗上, 30株/养虫笼. 正常肥水管理, 及时剪除分蘖苗, 确保每株始终为单苗. 观察记录每头接入飞虱的死亡日期. 接虫25 d(所有飞虱均已死亡)后, 检测每个养虫笼内的稻苗是否感染SRBSDV, 单苗检测, 检测方法见1.2. 如果网室内有1株稻苗感染SRBSDV, 则判定该养虫笼内稻苗接虫成功. 最后每个禁食时段统计30个接虫成功的养虫笼中的染病株数, 即为该禁食时间后每头长翅型飞虱在其自然死亡前感染的水稻株数.
1.7 数据统计分析
温度、水稻生育期和介体发育阶段对传毒率的影响采用三因素完全随机设计统计分析方法[17]; 利用DPS 数据处理系统[18]软件 (Version 9.5)进行统计, 统计分析中感染率数据经反正弦平方根转换, 均值差异显著性通过Duncan’s 新复极差法进行多重分析比较.
2 结果与分析
2.1 温度、白背飞虱发育阶段和水稻生育期对白背飞虱传毒的影响
不同发育阶段的白背飞虱在18~34 ℃时均能在不同生育期稻苗上传播SRBSDV, 传毒成功率在3.3%~41.2%间(表1). 表1数据的F测验结果(表2)表明, 介体发育阶段、环境温度和水稻生育期对该虫传播SRBSDV都有极显著的影响, 它们中的任意2个因素组合对传毒有极显著的互作效应 (< 0.01), 它们对传毒的影响表现为环境温度((= 4,= 9241.9,< 0.01)>水稻生育期(= 4 656.34,< 0.01)>介体发育阶段(= 2,= 585.17,< 0.01)>环境温度× 介体发育阶段(= 8,= 346.14,< 0.01)>环境温度×水稻生育期(= 16,= 147.55,< 0.01)>介体发育阶段× 水稻生育期(= 8,= 67.79,< 0.01).
表1和表2结果还表明, 不同发育阶段白背飞虱的传毒能力差异极显著(= 2,= 585.17,< 0.01), 其顺序依次是5龄若虫的传毒能力>短翅型成虫>长翅型成虫; 环境温度对传毒的影响极显著(= 4,= 9241.9,< 0.01), 26℃时传毒效率最高, 其次是22 ℃, 其余依次是28 ℃、18 ℃和34 ℃; 水稻生育期对传毒效率也呈现极显著的影响(= 4,= 4 656.34,< 0.01), 苗龄越低传毒效率越高. 可见, 5龄若虫的传毒能力大于成虫的传毒能力; 该虫在26 ℃时传毒效率最高; 苗龄越低越有利于该虫传毒.
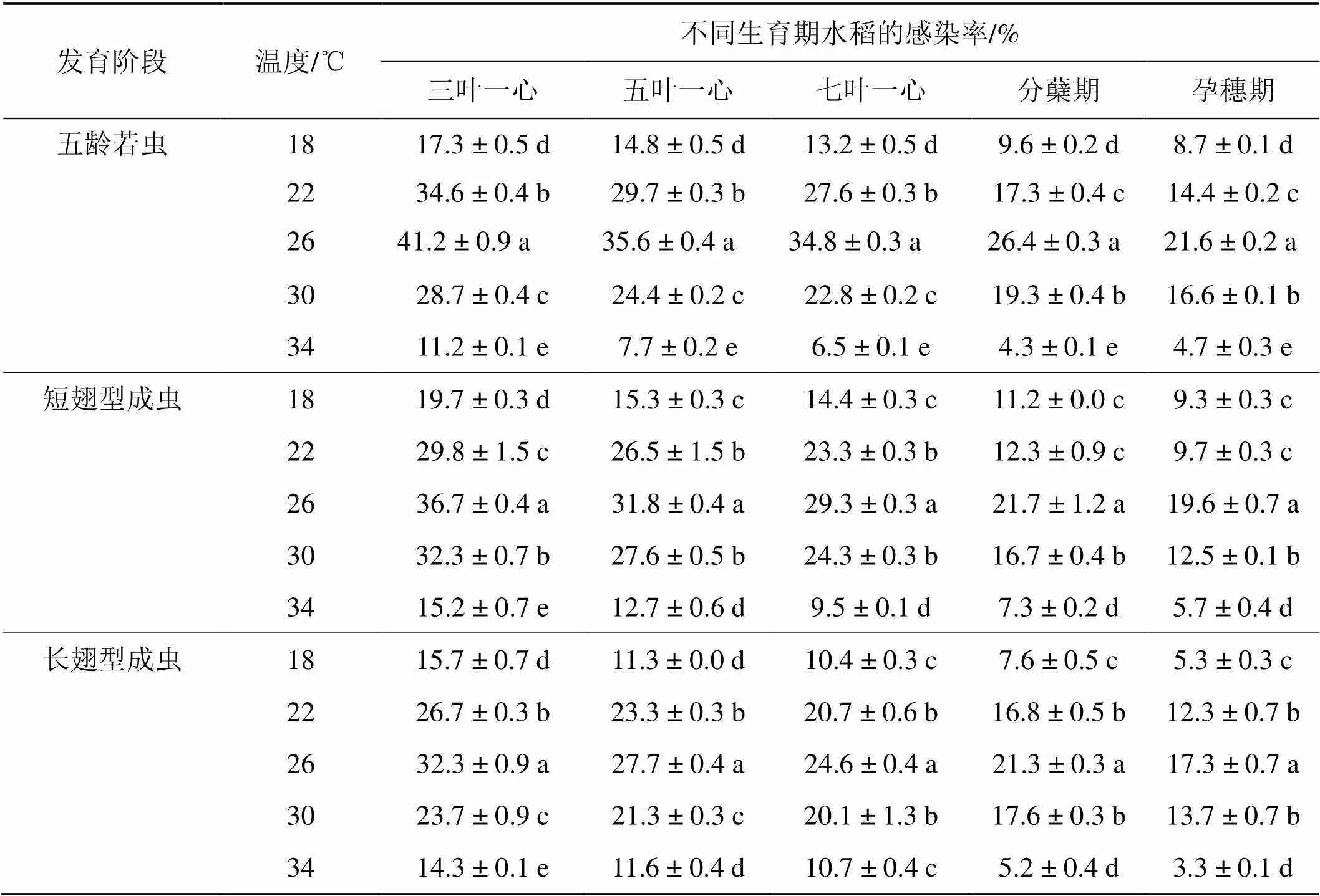
表1 不同发育阶段的介体在不同环境温度、不同生育期水稻上的传毒效率
注: 数据为平均值±SE, 表中数据后随字母不同者表明两者间差异显著(< 0.05).
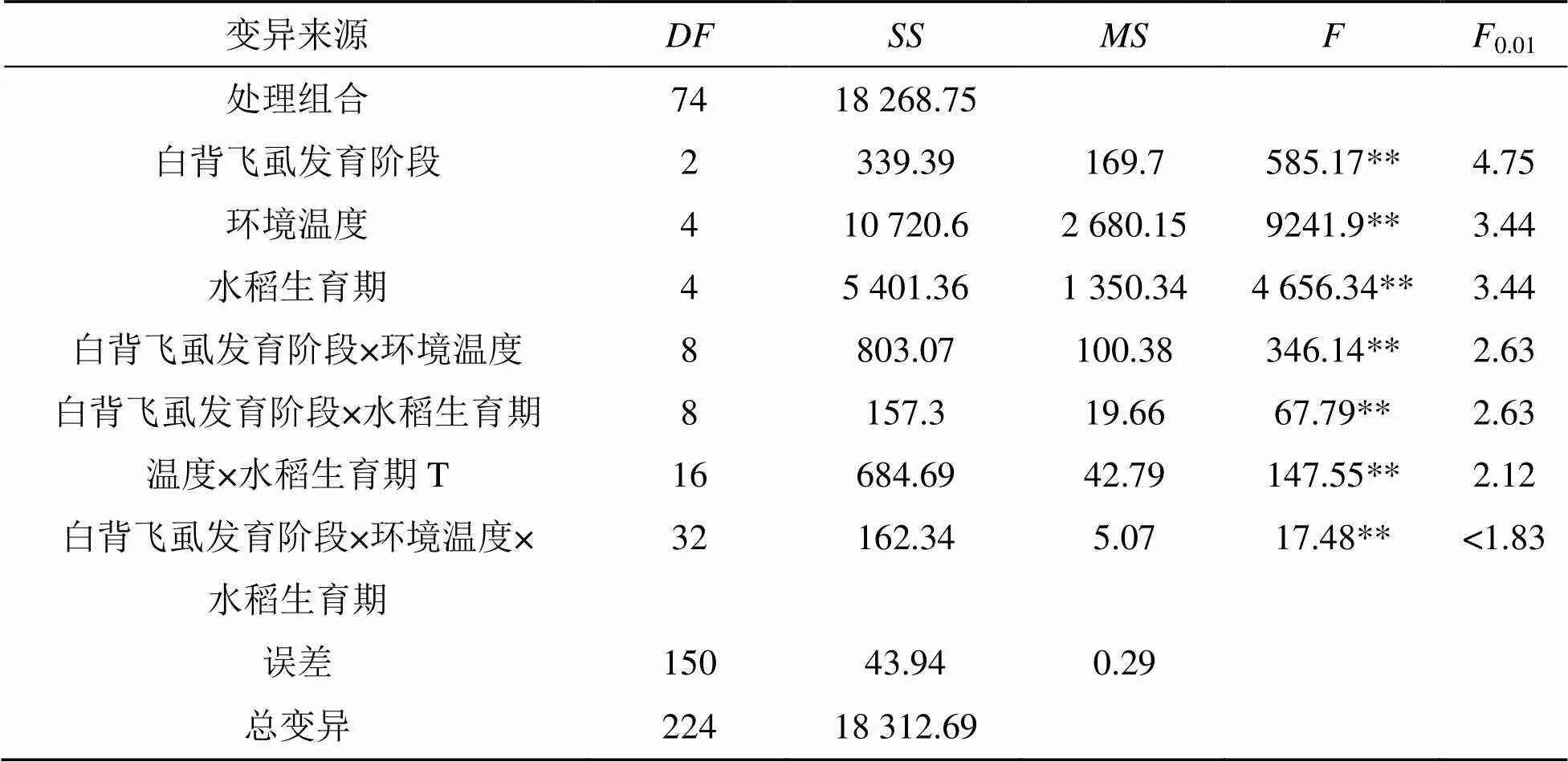
表2 介体发育阶段、环境温度和水稻生育期三因素完全随机试验的方差分析结果
注:值后随**表示差异极显著(< 0.01).
2.2 白背飞虱在不同水稻品种间的传毒率
不同品种的病毒感染率不同(图1), 5个品种感染率从高到低的顺序分别是陵两优(41.7%)、金优899(37.6%)、金优284(36.2%)、培两优981(32.1%)和威优644(29.3%). 在这5个品种间, 陵两优的感染率显著高于其它品种(< 0.05), 金优898和金优284之间感染率差异不显著(< 0.05), 威优644的感染率显著低于其它品种(< 0.05). 图2中各品种的感染率即白背飞虱在它们间的传毒率表明该虫的传毒效率与品种有关.

图1 26℃时白背飞虱在七叶一心期不同水稻品种的传毒效率
2.3 禁食处理对长翅型成虫传毒能力的影响
该虫在禁食处理后, 不同处理间每头毒虫48 h内感染的稻苗数分别是3.4、3.5、3.3、3.5、3.3和3.5株, 稻苗感染率分别是13.6%、13.8%、13.2%、13.9%、13.3%和14.1%(表3), 不同处理间感染率差异不显著(< 0.05), 这表明禁食处理对该虫禁食后短期内(48 h)的传毒效率影响不显著. 表3结果还表明短期禁食对该虫禁食后的存活时间也没有显著的影响, 禁食处理后该虫的存活时间近15 d, 不同处理间差异不显著(< 0.05).

表3 26 ℃时白背飞虱长翅型成虫经禁食处理后在水稻上的传毒效率
注: 数据后随字母不同者表明两者间差异显著(< 0.05).
从该虫禁食处理后至其自然死亡前导致的染毒稻苗株数来看, 各处理稻苗感染株数分别是23.2、22.8、23.6、17.6、13.3、9.6株(表3), 其中前3个处理间差异不显著(< 0.05), 但都显著高于后3个处理(< 0.05). 这表明当该虫禁食时间为0 (对照)、4和12 h时, 处理组和对照组每虫在其自然死亡前感染的稻株数差异不显著; 当禁食时间在12 h以上时, 该虫禁食后在其自然死亡前感染的稻株数量会显著减少.
可见, 禁食处理不影响该虫禁食后的存活时间, 也不影响该虫禁食后短期(48 h)内的传毒率. 禁食对该虫传毒能力是否有影响, 取决于禁食时间的长短, 当禁食时间在12 h以内时, 禁食对其传毒能力没有影响, 但禁食时间在12 h以上时其传毒能力下降.
3 结论与讨论
3.1 结论
白背飞虱在稻苗间的传毒效率与水稻品种、环境温度、介体自身发育阶段、寄主植物水稻品种、水稻生育期以及该虫禁食时间长短密切相关. 稻苗苗龄越低, 越易感染SRBSDV; 5龄若虫的传毒能力比成虫期的传毒能力高; 不同水稻品种对SRBSDV的敏感性不同; 该虫在18~34 ℃的温度范围内均能传毒, 26 ℃时该虫传毒率最高; 尽管禁食12 h以上的该虫传毒能力下降, 但仍能传毒, 这暗示即使远距离迁入的毒虫仍有传毒能力. 水稻品种、环境温度和白背飞虱的发育阶段不仅显著影响该虫的传毒能力, 而且它们之间还存在显著的互作效应. 阐明这些因素对白背飞虱传毒效率的影响有助于了解SRBSDV在田间的暴发与流行, 更重要的是可据此采取一些有效的防治措施, 减轻田间的发病率.
3.2 讨论
白背飞虱既是SRBSDV的传播介体又是SRBSDV的寄主. 感染SRBSDV的白背飞虱在潜伏期后终生具有传毒能力[1, 3], 可在多种寄主植物间传播SRBSDV[4]. 可见, 该虫在影响SRBSDV生物学、生态学和流行学方面扮演着极其重要的角色.
(1) 温度、介体发育阶段、水稻生育期对白背飞虱传毒能力的影响.
介体昆虫的传毒效率通常取决于介体在寄主植物间的行为和扩散能力[8]. 多种介体昆虫的行为和扩散能力不仅与环境温度和寄主植物种类(甚至包括品种)有关[19—25], 而且与其自身的发育阶段及生理状态相关[6—7]. 不同生育期的水稻自身的生理状态对SRBSDV的增殖速度具有影响. 此外, 不同生育期的水稻由于具有不同的组织结构 (表面结构中硅细胞群、刺毛、木栓组织、蜡被层; 内部的维管束细胞壁、筛板上的胼胝质沉积等)和生化物质迫使白背飞虱放弃或阻碍对寄主的取食、产卵和栖息行为[20], 因此, 温度和寄主植物对介体昆虫传毒能力的影响主要是通过影响病毒粒子的增殖速度、介体取食、扩散行为从而在传毒效率上体现出来. 可见, 在白背飞虱-SRBSDV-水稻这一复合系统中, 白背飞虱传毒过程包括多个环节, 如稻苗获毒、病毒增值和取食接毒. 在此期间, 影响任一环节的因素均会影响该虫的传毒效率. 表2结果证明环境温度、介体发育阶段和水稻生育期都对白背飞虱的传毒效率有极显著的影响(< 0.01). 本研究结果还表明, 介体发育阶段、环境温度和水稻生育期这3因素中的任意2个组合都存在极显著的互作效应(< 0.01). 可见, 本研究测定的传毒效率是多种影响因素综合作用的结果, 目前仅是定性分析, 如何量化不同因素对传毒效率的贡献还有待进一步研究.
本研究为探明环境温度、水稻生育期和介体发育阶段对传毒效率的影响采用三因素完全随机设计, 利用三因素完全随机试验的线性模型进行统计分析, 然后根据值大小确定效应或互作效应的大小[17—18].表1和表2正是基于三因素完全随机设计线性模型统计分析的结果. 然而, 在SRBSDV-白背飞虱-水稻这一复合系统中, 它们对传毒效率的影响是否为线性关系目前尚不清楚. 因此, 能否简单地将所有因素及其交互作用按值大小进行排序也是值得进一步研究的问题.
(2) 水稻品种对白背飞虱传毒率的影响.
不同水稻品种所含生化物质种类和数量不同, 其叶鞘组织结构 (表面结构中硅细胞群、刺毛、木栓组织、蜡被层; 内部的维管束细胞壁、筛板上的胼胝质沉积等)也不完全相同, 这些差异常迫使白背飞虱放弃或阻碍对寄主植物的取食、产卵和栖息行为[19—25]. 本研究结果表明不同品种的感染率不同(图1), 5个品种感染率从高到低的顺序分别是陵两优(41.7%)、金优899(37.6%)、金优284(36.2%)、培两优981(32.1%)和威优644(29.3%). 在这5个品种间, 陵两优的感染率显著高于其它品种(< 0.05), 金优898和金优284之间感染率差异不显著(< 0.05), 威优644的感染率显著低于其它品种(< 0.05). 图1中各品种的感染率即白背飞虱在它们间的传毒效率是室内模拟田间试验的结果, 与田间的真实传毒情形可能会有一定的差异, 也不能确定其传毒率的差异是由于白背飞虱对不同品种的选择性差异的结果, 还是不同品种对病毒的敏感性差异不同的结果, 但这个结果还是表明该虫传毒效率的高低与品种密切相关. 该结果暗示选用抗白背飞虱品种对减轻SRBSDV的田间发病率具有重要意义.
(3) 禁食对白背飞虱传毒效率的影响.
长时间禁食导致白背飞虱处于饥饿状态, 必然影响该虫的生理机能和行为, 甚至影响昆虫的存活时间, 表3的结果清楚表明短期禁食(60 h以内)对该虫寿命没有影响. 从禁食处理后48 h内的稻苗感染率来看, 禁食似乎对该虫的传毒能力没有影响, 但从该虫在禁食后至其自然死亡前感染的水稻株数来看, 当禁食时间在24 h以上时, 该虫传毒能力将会显著下降(表3). 因此, 推测该虫传毒能力减低可能是长时间禁食导致其生理机能下降的结果.
白背飞虱为迁飞性害虫, 迁飞中的该虫处于被动飞行状态, 在降落之前处于禁食状态. 根据本研究的结果可推测迁飞时间在12 h以内时, 即傍晚起飞后黎明前后降落的飞虱, 迁飞对其传毒能力影响不大, 而迁飞时间在24 h以上, 其传毒能力降低.
(4) 影响因素与防治措施.
通常, 植物病毒病大规模的流行与否取决于多种因素的相互作用[11, 26—29]. 本研究结果表明白背飞虱在稻苗间的传毒效率与环境温度、水稻生育期及该虫发育阶段密切相关(< 0.01), 同时还与作为寄主植物的水稻品种有关(图1). 此外, 禁食对该虫的传毒能力也有一定的影响(表3). 这些因素间存在有利于传毒效率的互作效应(表2). 因此, 田间SRBSDV的暴发与流行是多种有利因素组合在一起的必然结果. 可见, 为了减缓田间的发病率, 可采取一些措施调控除气温以外的其它因素.
白背飞虱是稻田重要的SRBSDV传播介体. 鉴于目前市场上缺少有效防治该病毒病的药剂, 对于该病的防治主要采取防虫控病的防治策略. 尽管本研究结果表明长时间的迁飞可能降低其传毒能力, 但仍具有传毒能力. 因此, 田间防治应加强该虫迁入和迁出的监测, 及时采取药剂防治, 降低其基数. 由于白背飞虱在不同品种间的传毒效率存在差异, 秧苗期对SRBSDV是一个危险生育期[3], 白背飞虱在秧苗期的传毒成功率较高(表1、表2). 因此, 秧田期覆盖防虫网对防治该病应是一个有效的措施.
[1] Zhou G H, Wen J J, Cai D J. Southern rice black-streaked dwarf virus: A new proposed Fijivirus species in the family Reoviridae[J]. Chinese Science Bulletin, 2008: 3677—3685.
[2] Ha V C, Nguyen V H, Vu T M, Masaru M. Rice dwarf disease in North Vietnam in 2009 is caused by southern rice black-streaked dwarf virus (SRBSDV)[J]. Bull. Inst. Trop. Agr., Kyushu Univ., 2009, 32: 85—92.
[3] 曹杨, 潘峰, 周倩, 等. 南方水稻黑条矮缩病毒介体昆虫白背飞虱的传毒特性[J]. 应用昆虫学报, 2011, 48(5): 1314—1320.
[4] LI Y Z, Cao Y, Zhou Q, Guo H M, Ou G C. The efficiency of Southern rice black- streaked dwarf virus transmission by the vectorto different host plant species[J]. Journal of Integrative Agriculture, 2012, 11(4): 621—627.
[5] Daugherty M P, Bosco D, Almeida R P P. Temperature mediates vector transmission efficiency: inoculum supply and plant infection dynamics[J]. Annals of Applied Biology, 2009, 155(3): 361—369.
[6] Anhalt M D, Almeida R P. Effect of temperature, vector life stage, and plant access period on transmission of banana bunchy top virus to banana[J]. Phytopathology, 2008, 98(6): 743—748.
[7] Creamer R, He X, Styer W E. Transmission of sorghum stunt mosaic rhabdovirus by the leafhopper vector,sonora (Homoptera: Cicadellidae)[J]. Plant Disease, 1997, 81(1): 63—65.
[8] Fereres A, Moreno A. Behavioural aspects influencing plant virus transmission by homopteran insects[J]. Virus Res, 2009, 141(2): 158—168.
[9] Wu RY, Su H J. Transmission of banana bunchy top virus by aphids to banana plantlets from tissue culture[J]. Bot. Bull. Acad. Sinica, 1990, 31: 7—10.
[10] 苗进, 武予清, 郁振兴, 等. 基于EPG 的麦长管蚜、麦二叉蚜和禾谷缢管蚜取食行为比较[J]. 生态学报, 2011, 31(1): 175—182.
[11] Bosque-Pérez N A. Eight decades of maize streak virus research[J]. Virus Research, 2000, 71: 107—121.
[12] Franz A, Makkouk K M, Vetten H J. Acquisition, retention and transmission of Faba bean necrotic yellows virus by two of its aphid vectors,(Koch) and(Harris)[J]. J. Phytopathol, 1998, 146: 347—355.
[13] van de Wetering F, Goldbach R, Peters D. Tomato spotted wilt tospovirus ingestion by first instar larvae of Frankliniella occidentalis is a prerequisite for transmission. Phytopathology, 1996, 86: 900—905.
[14] Schenck S, Leherer A T. Factors affecting the transmission and spread of Sugarcane yellow leaf virus[J]. Plant Disease, 2000, 84(1): 1085—1088.
[15] Buchman J L, Sengoda V G, Munyaneza J E. Vector transmission efficiency of Liberibacter by(Hemiptera: Triozidae) in Zebra chip potato disease: Effects of psyllid life stage and inoculation access period[J]. Journal of Economic Entomology, 2011, 104(5): 1486—1495.
[16] 周倩, 朱俊子, 梁晋刚, 等. 南方水稻黑条矮缩病毒快速检测[J]. 基因组学与应用生物学, 2010, 29(5): 1009—1012.
[17] 盖钧镒. 试验统计方法[M]. 北京: 中国农业出版社, 2000.
[18] 唐启义, 冯明光. 实用统计分析及其DPS数据处理系统[M]. 北京: 科学出版社, 2011.
[19] 肖英方, 张存政, 顾正远. 水稻品种对白背飞虱的抗性机理[J]. 植物保护学报, 2001, 28(3): 198—202.
[20] 叶海芳. 水稻叶鞘表皮结构对白背飞虱抗性的研究[J]. 西南农业大学学报, 1989, 11(2): 150—154.
[21] 俞晓平, 巫国瑞, 胡萃. 水稻品种对白背飞虱的抗性及其与稻株营养成分的关系[J]. 中国水稻科学, 1989, 3(20): 55—61.
[22] 许跃, 俞晓平. 水稻品系“9101”对白背飞虱产卵的抗性及植株游离氨基酸含量与抗性的关系[J]. 植物保护学报, 1988, 15(1): 61—62.
[23] 叶海芳. 水稻叶鞘氨基酸与白背飞虱危害的关系研究[J]. 西南农业大学学报, 1989, 11(1): 60—66.
[24] 刘光杰, Wilkins R M, Saxena R C. 白背飞虱对不同抗虫性稻株糖类物质的利用[J].昆虫学报, 1995, 38(4): 421—427.
[25] 吴刚, 吴中孚, 赵士希, 等. 水稻品种抗性对白背稻虱羧酸酯酶和磷酸酯酶活力的影响[J]. 植物保护学报, 1993, 20(2): 139—142.
[26] Bedford I D, Briddon R W, Brown J K. Geminvirus transmission and biological characterization of(Gennadius) biotypes from different geographic region[J]. Annals of Applied Biology, 1994, 125: 311—325.
[27] Jeger M J, van Den Bosche F, Madden L V, Holt J. A model for analysing plant-virus transmission characteristics and epidemic development[J]. IMA Journal of Mathematics Applied in Medicine & Biology, 1998, 15: 1—18.
[28] Ng J C K, Tian T Y, Falk B W. Quantitative parameters determining whitefly () transmission of Lettuce infectious yellows virus and an engineered defective RNA[J]. Journal of General Virology, 2004, 85: 2679—2707.
[29] Lowles A J, Tatchell G M, Harrington R, Clark S J. The effect of temperature and inoculation access period on the transmission of barley yellow dwarf virus by(L.) and(F.)[J]. Ann Appl Biol, 1996, 128: 45—53.
Effect of various kinds of factors on the transmission efficiency of southern rice black- streaked dwarf virus by white blacked planthopper among rice plants
CAO Yang, LI YouZhi
(Hunan Provincial Key Laboratory for Biology and Control of Plant Diseases and Insect Pests, College of Plant Protection, Hunan Agricultural University, Changsha 410128, China)
The fifth instar nymph, macropter and brachypter could transmit SRBSDV among rice plants at different growth stage under the temperature range from 18 ℃to34 ℃, and the transmission efficiency ranged from 3.3% to 41.2%. Transmission efficiency was affecting significantly by vector life stage, temperature, and rice growth stages (<0.01), transmitting capacity of the vector in order was the fifth instar nymph > brachypter > macropter, transmission efficiency of WBP reached the maximum value at 26℃, and then declined in turn at 22 ℃, 28 ℃, 18 ℃ and 34 ℃, and infection rate of rice plants by the vector was declined with the plants being growing. Any two of three factors (e.g. vector life stage, temperature and rice growth stages) presented noted interaction effect on WBP to transmitting SRBSDV (<0.01), the importance of these factors in order was temperature > rice growth stage > vector life stage > temperature × vector life stage > temperature × rice growth stage > vector life stage × rice growth stage. Five rice varieties exhibited different SRBSDV-infected rate, with the respective infection rate being 41.7% on Lingliangyou268, 37.6% on Jinyou 899, 36.2% on Jinyou 284, 32.1% on Peiliangyou 981, and 29.3% on Weiyou 644. Infection rate on Lingliangyou268 was remarkably higher than that of the other varieties(<0.05), there was no significant difference between infected-rate on Jinyou 899 and that on Jinyou 284(<0.05), SRBSDV-infected rate on Weiyou 644 was lower than that of any other varieties(<0.05). When fasting period was above 12 hours, capacity of the macropter to transmit SRBSDV markedly declined(<0.05). These factors (i.e., temperature, vector life stage, rice growth stages, rice variety and fasting) could significantly affect the efficiency of WBP to transmit SRBSDV. In addition, temperature, vector life stage and rice growth stages exhibited positive interaction effect on the efficiency by WBP to transmit SRBSDV.
white blacked planthopper; Southern rice black-streaked dwarf virus; temperature; vector life stage; rice growth stage; rice variety; fasting; transmission efficiency
S 435.11
1672-6146(2014)01-0030-08
10.3969/j.issn.1672-6146.2014.01.008
通讯作者email: liyouzhi2008@sina.com.
email:233552663@qq.com.
2013-12-05
国家公益性行业(农业)科技专项(201303021); 湖南省科技支撑计划重点项目(2011NK2009); 湖南省大学生创新性项目(SCX1306)
(责任编校:谭长贵)
